03.01.2024
Rundum informiert
Morbus Crohn bei Erwachsenen
Der folgende Artikel gibt einen Überblick über die Erkrankung Morbus Crohn sowie deren Diagnose und Therapie.
Morbus Crohn zählt ebenso wie Colitis ulcerosa zu den chronisch-entzündlichen Darmerkrankungen. Schubförmig aufflammende oder dauerhaft bestehende Entzündungen des Magen-Darm-Trakts prägen das Krankheitsbild.
In Deutschland wird die Prävalenz des Morbus Crohn auf 100 bis 200 Erkrankte pro 100.000 Einwohner·innen geschätzt1. Die Gesamtinzidenz liegt in Deutschland bei 6,6 Neuerkrankungen pro 100.000 Einwohner·innen und Jahr2. Die höchste altersspezifische Inzidenz liegt im vierten Lebensjahrzehnt, und zwar zwischen 33 und 45 Jahren. Morbus Crohn ist also keineswegs eine Erkrankung des Alters. Fast jede•r dritte Betroffene ist bei der Diagnose jünger als zehn Jahre3.
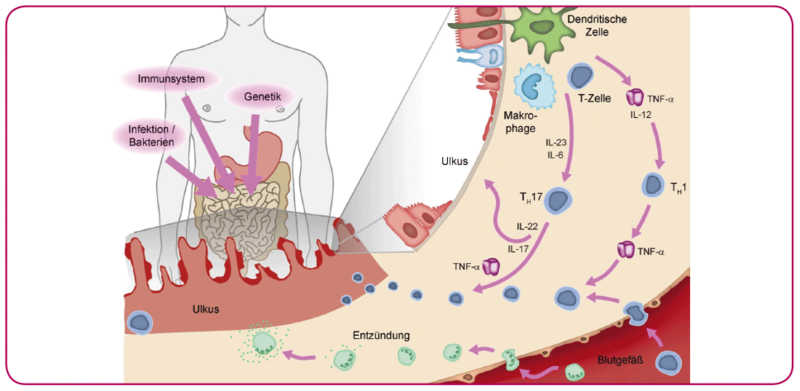
Ätiologie und Pathogenese des Morbus Crohn sind bislang noch nicht vollständig verstanden. Man geht heute davon aus, dass proinflammatorische Zytokine und Chemokine im Zentrum des Krankheitsgeschehens stehen. Eine multifaktorielle Genese, bei der die genetische Disposition im Zusammenspiel mit Umweltfaktoren (z. B. Rauchen) zu einer fehlerhaften Regulation des Immunsystems der Darmmukosa führt, erscheint nach aktuellem Wissensstand plausibel4.
Bei Morbus Crohn scheint eine vorwiegend durch Typ-1-T-Helferzellen (Th1-Zellen) ausgelöste immunvermittelte Entzündung zu dominieren, während die Entzündungsprozesse bei der Colitis ulcerosa überwiegend durch Th2-Zellen stimuliert werden5. Morbus Crohn und Colitis ulcerosa haben gemeinsam, dass die Immunreaktionen bei beiden Erkrankungen auch über Th17-Zellen erfolgen6. Der Zusammenbruch der intestinalen Barriere führt sekundär zu einer vermehrten Ausschüttung von proinflammatorischen Zytokinen wie TNFα (Tumornekrosefaktor-alpha), IL-1 (Interleukin-1) oder IL-13 (Interleukin-13).
Abb. 1: Schematische Darstellung der gestörten Immunantwort in der entzündeten Darmmukosa
Genetische Risikofaktoren
Das Risiko, Morbus Crohn zu entwickeln, ist erhöht, wenn bereits ein anderes Familienmitglied daran erkrankt ist7. Bei eineiigen Zwillingen mit einem genetisch erhöhten Risiko erkranken in etwa 50 % aller Fälle beide Geschwister8. Morbus Crohn wird unter anderem mit Mutationen im NOD2-Gen in Verbindung gebracht, das an der Erkennung und Abwehr von potenziell krankheitsauslösenden Darmbakterien beteiligt ist. Bei Menschen mit bestimmten NOD2-Mutationen bildet das Immunsystem nur wenig Defensine, was zu der für Morbus Crohn typischen Barrierestörung des Darms beitragen könnte9. Dadurch können Bakterien – auch solche der natürlichen Darmflora – und andere Antigene in die Darmmukosa eindringen und dort Immunreaktionen auslösen10.
Zudem scheint der Transkriptionsfaktor NF-κB bei Menschen mit NOD2-Mutationen übermäßig aktiv zu sein. NF-κB reguliert die Aktivität von Immunzellen, die entzündungsfördernde Zytokine produzieren9. In der Literatur sind darüber hinaus noch weitere Genorte beschrieben, die mutmaßlich mit einem erhöhten Erkrankungsrisiko in Verbindung stehen11.
Einfluss von Umweltfaktoren
Zu den Umweltfaktoren, die als gesicherte Risikofaktoren für eine Morbus-Crohn-Erkrankung gelten, zählt das Rauchen. Nikotinkonsum, aber auch die Anwendung von nichtsteroidalen Schmerzmitteln und oralen Kontrazeptiva kann den Verlauf der Erkrankung negativ beeinflussen. Stress ist zwar kein kausaler Risikofaktor für Morbus Crohn, kann aber bei einer bereits bestehenden Erkrankung weitere Entzündungsprozesse begünstigen. Nicht zuletzt tragen vermutlich auch hohe Hygienestandards dazu bei, dass manche Menschen an Morbus Crohn erkranken12. Dahinter steckt die Vermutung, dass eine Minderexposition gegenüber Antigenen – insbesondere in der Kindheit – zu einer Fehlregulation des Immunsystems führen kann.
Gastroenterologische Komplikationen
Da die Entzündung im Darm nicht von allein wieder abklingt, kann sie das Organ langfristig schädigen. Morbus Crohn kann teils schwerwiegende Komplikationen wie Darmstenosen, Fistelbildung in benachbarte Hohlorgane oder Abszesse nach sich ziehen. In fortgeschrittenen Stadien müssen diese Komplikationen oft chirurgisch behandelt werden13. Morbus-Crohn-Patient•innen haben auch ein erhöhtes Risiko für kolorektale Karzinome14. Mögliche Folgen von Morbus Crohn:
- 20 Jahre nach Krankheitsbeginn hat etwa jede•r fünfte Patient•in mit Morbus Crohn fibröse Darmstenosen entwickelt14.
- Bei bis zu 40 % der Morbus-Crohn-Patient•innen entstehen im Krankheitsverlauf Fisteln. Diese können als enteroenterische, enterogenitale, enterovesikale oder enterokutane (z. B. perianale) Fisteln auftreten14.
- Abszesse sind bei 10–30 % der Morbus-Crohn-Patient•innen nach längerer Krankheitsgeschichte im Abdomen oder Becken als Folge der Fistelbildung zu finden. Sie sind häufig periananal und/oder perirektal lokalisiert und können zu Enddarmverengung, Inkontinenz und Beschwerden beim Sitzen oder Gehen führen14.
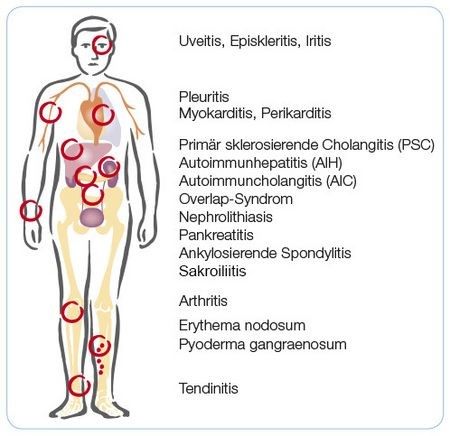
Extraintestinale Manifestationen
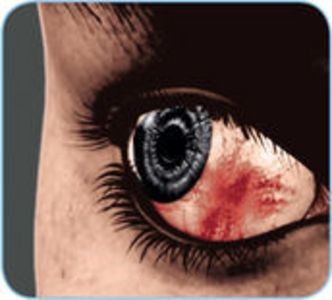
Obwohl Morbus Crohn als chronisch-entzündliche Darmerkrankung klassifiziert ist, können auch andere Körperregionen oder Organe von der Entzündung betroffen sein. Man spricht dann von extraintestinalen Manifestationen (EIM). Diese treten am häufigsten im Bereich der Gelenke, der Haut, der Leber oder der Augen auf15.
Wie EIM mit der intestinalen Grunderkrankung konkret zusammenhängen, ist noch nicht eindeutig entschlüsselt. Denkbar ist, dass sich die überschießenden Immunreaktionen im Darm von Morbus-Crohn-Patient•innen – z. B. durch den Transport von aktivierten T-Zellen und anderen Entzündungsmediatoren über das Blut – auf weitere Organe ausweiten. Eine andere Theorie ist, dass EIM von der chronisch-entzündlichen Darmerkrankung unabhängige Phänomene sind, die auf ein grundlegend verändertes angeborenes Immunsystem und/oder ein gestörtes Mikrobiom zurückzuführen sind16.
Gelenkmanifestationen
- Eine periphere Arthritis manifestiert sich bei bis zu 20 % der Morbus-Crohn-Patient•innen17. Periphere Arthritiden vom Typ 1 (meist asymmetrischer Befall von ≤ 5 Gelenken) stehen meist im direkten Zusammenhang mit der Krankheitsaktivität des Morbus Crohn. Periphere Arthritiden vom Typ 2 (meist symmetrischer Befall von ≥ 5 Gelenken) scheinen dagegen nicht mit der Entzündungsaktivität der Darmerkrankung assoziiert zu sein18.
- Bis zu 10 % der Morbus-Crohn-Patient•innen entwickeln eine ankylosierende Spondylitis, unabhängig von der intestinalen Krankheitsaktivität. Zwei Drittel dieser Patient•innen sind HLA-B27-positiv19.
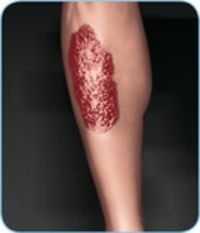
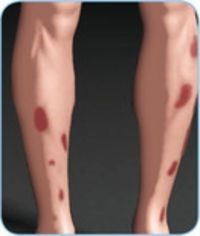
Hautmanifestationen
- Eine Psoriasis betrifft 5–10 % der Morbus-Crohn-Patient•innen, unabhängig von der intestinalen Krankheitsaktivität20.
- Ein Erythema nodosum tritt bei 4–15 % der Morbus-Crohn-Patient•innen auf. Hier gibt es einen Zusammenhang mit der Aktivität der Darmerkrankung. Die Hauterkrankung Pyoderma gangraenosum tritt dagegen vergleichsweise selten und unabhängig von der Schwere der Darmerkrankung bei Morbus-Crohn-Patient•innen in Erscheinung21.
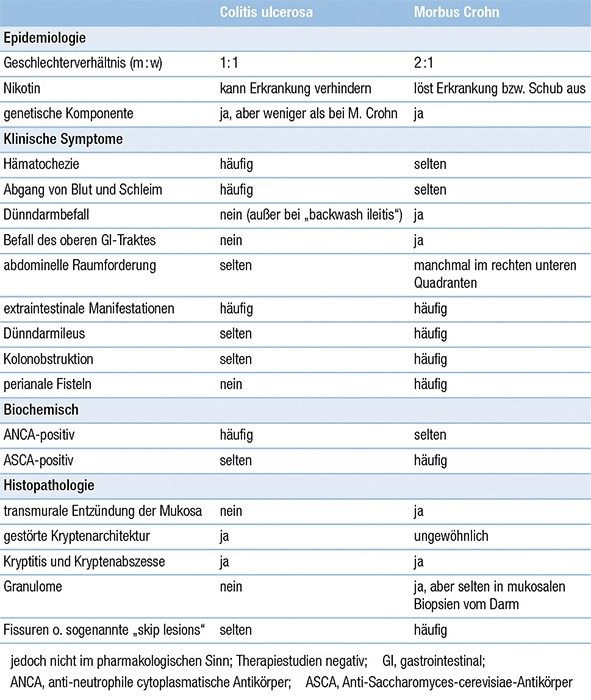
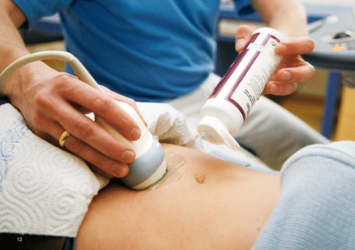
Die Entzündung breitet sich beim Morbus Crohn diskontinuierlich im Darm aus. Entzündete und gesunde Darmabschnitte wechseln sich also ab. Grundsätzlich kann der gesamte Gastrointestinaltrakt vom Mund bis zum After betroffen sein. Ein weiteres Unterscheidungsmerkmal gegenüber der Colitis ulcerosa ist der transmurale Befall. Das bedeutet, dass die Entzündungsherde bei Morbus Crohn nicht nur in der Mukosa vorhanden sind, sondern auch in tiefergelegene Schichten des Darms (Submukosa, Muskularis und Serosa) vordringen23.
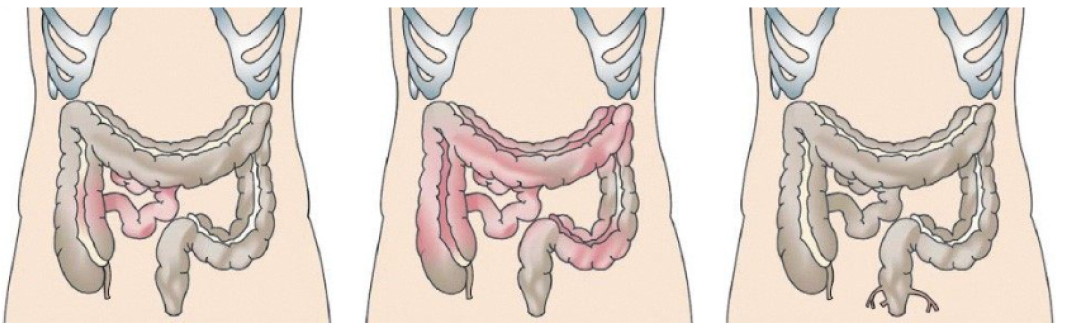
Je nach Lokalisation und Schweregrad kann sich Morbus Crohn sehr unterschiedlich präsentieren. Am häufigsten tritt die Entzündung am Übergang zwischen dem Dünn- und dem Dickdarm auf. Man unterscheidet folgende häufige Befallsmuster:
- Ein ausschließlicher Dünndarmbefall (meist Ileitis) oder ein ausschließlicher Dickdarmbefall (Kolitis) kommt jeweils bei ca. 25 % der Patient·innen vor 24.
- Ein Dünn- und Dickdarmbefall betrifft ca. 50 % der Patient·innen (z. B. Ileokolitis)24. Bei einem Dünndarmbefall ist meist das terminale Ileum betroffen (Ileitis terminalis)25.
- Ein Befall von Speiseröhre, Magen oder Duodenum tritt bei 4 % der Patient·innen auf – insbesondere bei Kindern und Jugendlichen26.
Abb. 6: Unterschiedliche Befallsmuster des Morbus Crohn. Links: Ileitis (Montreal-Klassifikation L1), Mitte: Ilekolitis (Montreal-Klassifikation L3), rechts: perianale Fistelbildung (Montreal-Klassifikation B3p)
Symptomatik
Regelmäßig wiederkehrende Bauchkrämpfe und Bauchschmerzen sowie heftige Durchfälle zählen zu den Leitsymptomen27 des Morbus Crohn.
Markante Bauchschmerzen liegen normalerweise bei einer Erkrankung des Dünndarms vor. Isolierte Kolonerkrankungen verursachen dagegen meist keine Schmerzen. Bei einer stenosierenden Erkrankung treten die Bauchschmerzen üblicherweise als kolikartige Krämpfe auf und führen tendenziell zu Übelkeit, Erbrechen und veränderten Verdauungsgewohnheiten. Blut im Stuhl ist bei Morbus Crohn seltener als bei Colitis ulcerosa und daher kein typisches Leitsymptom23.
Infolge einer unzureichenden Resorption von Nährstoffen im erkrankten Dünndarm kann es zu einem Gewichtsverlust kommen. Dazu können zusätzlich Appetitlosigkeit und eine reduzierte Nahrungsaufnahme aufgrund von Schmerzen (oder der Angst davor) beitragen. Darüber hinaus leiden manche Morbus-Crohn-Patient•innen an Anämie, Fieber, Müdigkeit und Vitaminmangelerscheinungen23.
Aufgrund der vielfältigen Symptome ist die Differentialdiagnose des Morbus Crohn häufig schwierig. Bei der Abgrenzung zur Colitis ulcerosa oder zu einem Reizdarmsyndrom können die Anamnese, körperliche Untersuchungen und Laborwerte oft nur Verdachtsmomente liefern. Sie müssen daher durch bildgebende Verfahren wie die Endoskopie, ggf. auch durch die Beurteilung von Krankheitsaktivität und Therapieansprechen, bestätigt werden28.
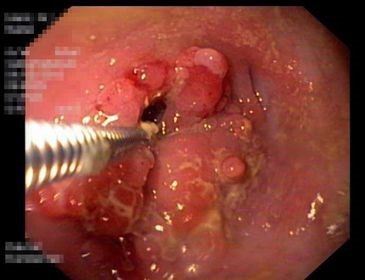
Abb. 7: Unterschiede und Gemeinsamkeiten von Morbus Crohn und Colitis ulcerosa. Aus: Baumgart DC. Diagnostik und Therapie von Morbus Crohn und Colitis ulcerosa. Dtsch Ärztebl Int 2009; 106: 123–133. Abdruck mit Genehmigung der Deutschen Ärzteverlag GmbH.
Anamnestisch sollten folgende Aspekte evaluiert werden28:
- bisher aufgetretene gastrointestinale Symptome und deren Verlauf
- das Allgemeinbefinden
- angewandte Medikamente
- chronisch-entzündliche Darmerkrankungen in der Familie
- extraintestinale Manifestationen, die möglicherweise schon einmal ohne Verdacht auf Morbus Crohn behandelt wurden
Im Rahmen einer körperlichen Untersuchung sollte man folgende Warnsignale abklären28:
- Hinweise auf ungewollten Gewichtsverlust
- Fieber
- perianale Beschwerden
- extraintestinale Manifestationen
- abdominelle Druckschmerzen, tastbare Darmschlingen
- okkultes Blut im Stuhl
Das Basislabor sollte folgende Parameter umfassen28:
- ein Blutbild mit besonderem Augenmerk auf Entzündungsparametern (Blutsenkungsgeschwindigkeit, C-reaktives Protein)
- den Entzündungsmarker fäkales Calprotectin
- eine Stuhluntersuchung auf pathogene Keime, um eine infektbedingte Darmentzündung ausschließen zu können
- einen Antikörpertest auf Saccharomyces cerevisiae
Zu den gängigen bildgebenden Verfahren, die bei Verdacht auf Morbus Crohn oder im Rahmen von Verlaufskontrollen zum Einsatz kommen, gehören die Endoskopie, die Sonografie, das CT und das MRT. Im Gegensatz zur Endoskopie lassen sich mit den übrigen drei Verfahren auch transmurale Veränderungen über die Mukosa hinaus beurteilen28.
Beurteilung der Krankheitsaktivität
Der Goldstandard zur Beurteilung der Krankheitsaktivität des Morbus Crohn bei Erwachsenen ist der Crohn’s Disease Activity Index (CDAI) nach Best29. Es gelten folgende Definitionen:
- aktive Erkrankung: CDAI > 150 Punkte (ab 220 Punkten: mittelschwere bis schwere Erkrankung)
- Remission: Reduktion des CDAI auf < 150 Punkte
- Ansprechen: Reduktion des CDAI um > 100 Punkte
- Rezidiv: Wiederauftreten von Symptomen und CDAI-Anstieg um > 70 Punkte sowie Gesamt-CDAI > 150 Punkte
Der im Vergleich zum CDAI einfacher aufgebaute Harvey-Bradshaw-Index (HBI) korreliert gut mit dem erstgenannten Score. In die Beurteilung der Krankheitsschwere fließen auch endoskopische Indizes (Crohn’s Disease Endoscopic Index of Severity – kurz CDEIS – oder Simple Endoscopic Score for Crohn´s Disease – kurz SES-CD) sowie die Lebensqualität ein. Die Lebensqualität kann mit verschiedenen Fragebogen wie dem (Short) Inflammatory Bowel Disease Questionnaire – kurz (S)IBDQ – oder dem EQ-5D-Fragebogen bewertet werden.
Zunehmend werden auch abseits von klinischen Studien sogenannte Patient-Reported Outcomes (PROs) bei der Therapieplanung berücksichtigt. Dazu zählen Parameter wie die Stuhlfrequenz oder Bauchschmerzen, die Aufschluss darüber geben, wie stark die Erkrankung die Patient•innen belastet. In klinischen Studien haben PROs mittlerweile den CDAI für die Bestimmung der klinischen Krankheitsaktivität abgelöst.
Das kurzfristige Therapieziel bei Morbus Crohn ist, möglichst rasch die steroidfreie Remission zu erreichen. Ein Langzeittherapieziel ist die Mukosaheilung. Diese ist in der Regel die Voraussetzung, um dauerhafte Schäden des Darms und Operationen zu vermeiden30, 31. Idealerweise sollten Therapieziele von Beginn an im gemeinsamen Dialog zwischen Behandler•in und Patient•in definiert werden.
Individuelle Therapiestrategien orientieren sich am Schweregrad der Erkrankung, dem Befallsmuster, den prognostischen Faktoren und dem Ansprechen auf Vortherapien. Bei der Behandlung des Morbus Crohn hat sich das sogenannte Treat-to-Target-Konzept in der Praxis bewährt30, 31. Man versteht darunter eine auf konkrete Ziele ausgelegte Therapie und engmaschige Verlaufskontrollen, die es bei Bedarf ermöglichen, Therapiestrategie kurzfristig anzupassen und zu optimieren. Auf diese Weise steigt die Chance, dass die ursprünglich gesetzten Therapieziele auch tatsächlich erreicht werden.
Die medikamentöse Behandlung des Morbus Crohn umfasst zwei Säulen – die Schubtherapie und die Erhaltungstherapie. Während die Schubtherapie dazu dient, akute Symptome zu lindern, soll die remissionserhaltende Therapie einen erneuten Krankheitsschub (Rezidiv) verhindern28. Heute steht ein breites Spektrum an Therapieoptionen zur Behandlung des Morbus Crohn zur Verfügung.
Medikamentöse Konzepte
5-Aminosalicylate wirken entzündungshemmend und werden – abhängig davon, wie weit die Entzündung im Dickdarm fortgeschritten ist – lokal oder systemisch bei leichten bis mittelschweren Erkrankungsverläufen eingesetzt.
Antibiotika werden vorwiegend zur Behandlung von perianalen Komplikationen wie Fisteln und Abszessen angewendet28.
Immunsuppressiva wirken entzündungshemmend und werden bei mittelschwerer bis schwerer Krankheitsaktivität eingesetzt. Da ihre vollständige Wirkung allerdings erst nach zwei bis sechs Monaten eintritt, ist es oft nötig, die Zeit bis zum Wirkeintritt zusätzlich mit anderen Medikamenten zu überbrücken28.
Integrinantagonisten sind gegen Adhäsionsmoleküle gerichtet, die eine Verbindung zwischen zwei Zellen ermöglichen. Mit dieser Wirkung unterbinden Integrinhemmer die Entzündungsaktivität, indem sie das α4β7-Integrin blockiert, das bei der Vermittlung von Entzündungsprozessen im Darm eine Rolle spielt.
IL-12 reguliert unter anderem die Differenzierung von Th1-Zellen und die Produktion von Zytokinen wie Interferon-γ und TNFα. IL-23 ist ebenfalls an der Th1-Regulation beteiligt, steuert aber auch maßgeblich die Differenzierung von Th17-Zellen, die bei beiden chronisch-entzündlichen Darmerkrankungen (Morbus Crohn und Colitis ulcerosa) eine wesentliche Rolle spielen32. Die medikamentöse Inhibition von IL-12 und/oder IL-23 bietet deshalb einen Ansatzpunkt, um die Entzündungskaskade bei Morbus Crohn zu blockieren. Dafür stehen ein dualer Antikörper, der sowohl an IL-23 als auch an IL-23 bindet, sowie ein selektiver, ausschließlich gegen IL-23 gerichteter Antikörper zur Verfügung.
Januskinasen (JAKs) sind Enzyme mit einer genregulatorischen Funktion. Sie steuern indirekt die Expression von Genen, die für verschiedene Entzündungsmediatoren (Zytokine und Chemokine) kodieren und bei der Pathogenese des Morbus Crohn eine Rolle spielen33. Die JAK-Inhibition ermöglicht es daher, mehrere proinflammatorische „downstream“-Signalwege abzuschwächen.
Wie Biologika können auch JAK-Inhibitoren unter anderem im Rahmen der Remissionserhaltung oder bei steroidabhängigen/refraktären Verläufen zum Einsatz kommen – zum Beispiel, wenn Patient•innen auf eine konventionelle Therapie nicht oder nur unzureichend ansprechen oder diese nicht vertragen.
Kortikosteroide haben eine starke entzündungshemmende Wirkung, die im Vergleich zu anderen Entzündungshemmern sehr rasch eintritt. Sie werden daher vor allem im akuten Entzündungsschub angewendet – sowohl bei geringer und mittlerer als auch bei schwerer Krankheitsaktivität. Kortikosteroide sollten jedoch nicht langfristig eingenommen werden34.
TNFα ist ein Entzündungsmediator, der unter anderem den proinflammatorischen NF-κB-Signalweg aktiviert und somit zur Sekretion von verschiedenen Zytokinen beiträgt35. TNF-Antagonisten kommen bei mittelschweren bis schweren Krankheitsverläufen zum Einsatz, wenn mit herkömmlichen Medikamenten einschließlich Kortikosteroiden und Immunsuppressiva keine Besserung erreicht wurde, eine Unverträglichkeit besteht oder diese Medikamente nicht angewendet werden dürfen. Wenn mit TNF-Antagonisten eine Symptomverbesserung erreicht wird, können diese Medikamente auch als Erhaltungstherapie weiter verabreicht werden. Ein Vertreter aus der Gruppe der TNF-Antagonisten kann auch für die Behandlung eines aktiven, fistulierenden Morbus Crohn eingesetzt werden.
Nichtmedikamentöse Konzepte
Laut einer Metaanalyse ist bei fast der Hälfte aller Morbus-Crohn-Patient•innen innerhalb von zehn Jahren nach Krankheitsbeginn eine Operation notwendig36 – zum Beispiel, weil Medikamente keine Wirkung mehr gegen die aktive Entzündung zeigen. Dabei werden stark befallene Darmabschnitte, Stenosen, Fisteln oder Abszesse chirurgisch entfernt.
Morbus Crohn ist häufig mit veränderten Ernährungsgewohnheiten und einer gestörten Resorption von lebenswichtigen Nahrungsbestandteilen über die Darmschleimhaut verbunden. Vor allem die Zufuhr von Folsäure, Vitamin C und E sowie Kalzium ist dadurch oft vermindert. In diesen Fällen müssen Defizite diätetisch durch geeignete Supplemente oder im Rahmen einer künstlichen Ernährung korrigiert werden. Dabei sollten ernährungsmedizinisch geschulte Mediziner•innen oder eine andere qualifizierte Fachkraft hinzugezogen werden. Bei Erwachsenen hat die Ernährungstherapie allerdings einen geringeren Stellenwert als bei Kindern und Jugendlichen mit Morbus Crohn.
Eine ausschließlich enterale Ernährung kann im akuten Schub als primäre Therapie zur Remissionsinduktion durchgeführt werden, wenn die Remission nach leitliniengerechter medikamentöser Therapie nicht erreicht werden kann, die leitliniengerechte medikamentöse Therapie wegen unerwünschter Wirkungen nicht oder schlecht vertragen wird oder der Patient bzw. die Patientin die leitliniengerechte medikamentöse Therapie ablehnt37. Wenn eine Ernährung über den Darm nicht mehr möglich ist, muss auf eine parenterale Ernährung ausgewichen werden.
- Ng SC et al. Lancet 2017; 390: 2769–2778.
- Preiß JC et al. Z Gastroenterol 2014; 52: 1431–1484.
- Buderus S. Monatsschrift Kinderheilkunde 2010; 158: 745–751.
- Boyapati R et al. F1000Prime Rep 2015; 7: 44.
- Nemeth ZH et al. Cureus 2017; 9: e1177.
- Jiang W et al. Inflamm Res 2014; 63: 943–950.
- Santos MPC et al. Ann Gastroenterol 2018; 31: 14–23.
- Dicksved J et al. Isme j 2008; 2: 716–727.
- Sidiq T et al. Front Immunol 2016; 7: 367.
- Antoni L et al. World J Gastroenterol 2014; 20: 1165–1179.
- Verstockt B et al. Clin Transl Immunology 2018; 7: e1001.
- Molodecky NA et al. Gastroenterol Hepatol (N Y) 2010; 6: 339–346.
- Shaffer VO et al. Langenbecks Arch Surg 2013; 398: 13–27.
- Marrero F et al. Med Clin North Am 2008; 92: 671–686.
- Levine JS et al. Gastroenterol Hepatol (N Y) 2011; 7: 235–241.
- Greuter T et al. Gut 2021; 70: 796–802.
- Orchard TR. Gastroenterol Hepatol (N Y) 2012; 8: 327–329.
- Vavricka SR et al. Inflamm Bowel Dis 2015; 21: 1982–1992.
- Rudwaleit M et al. Best Pract Res Clin Rheumatol 2006; 20: 451–471.
- Vlachos C et al. Psoriasis (Auckl) 2016; 6: 73–92.
- Chowaniec M et al. Reumatologia 2016; 54: 79–82.
- Troncoso LL et al. World J Gastroenterol 2017; 23: 5836–5848.
- Feuerstein JD et al. Mayo Clin Proc 2017; 92: 1088–1103.
- Gajendran M et al. Dis Mon 2018; 64: 20–57.
- Pimentel AM et al. World J Gastrointest Pharmacol Ther 2019; 10: 35–49.
- Langholz E. Therap Adv Gastroenterol 2010; 3: 77–86.
- Ha F et al. Therap Adv Gastroenterol 2015; 8: 352–359.
- Gomollón F et al. J Crohns Colitis 2017; 11: 3–25.
- Best WR et al. Gastroenterology 1976; 70: 439–444.
- Shi HY et al. J Gastroenterol 2018; 53: 989–998.
- Turner D et al. Gastroenterology 2021; 160: 1570–1583.
- Aggeletopoulou I et al. World J Gastroenterol 2018; 24: 4093–4103.
- Cohen NA et al. Curr Opin Gastroenterol 2021; 37: 357–363.
- Bruscoli S et al. Front Immunol 2021; 12: 691480.
- Billmeier U et al. World J Gastroenterol 2016; 22: 9300–9313.
- Frolkis AD et al. Gastroenterology 2013; 145: 996–1006.
- Sturm A et al. Z Gastroenterol 2022; 60: 332–418.
Was Sie sonst noch interessieren könnte:
Sorry, we couldn’t find any articles that match your chosen filters.
Reset filter to see all of our available articles.