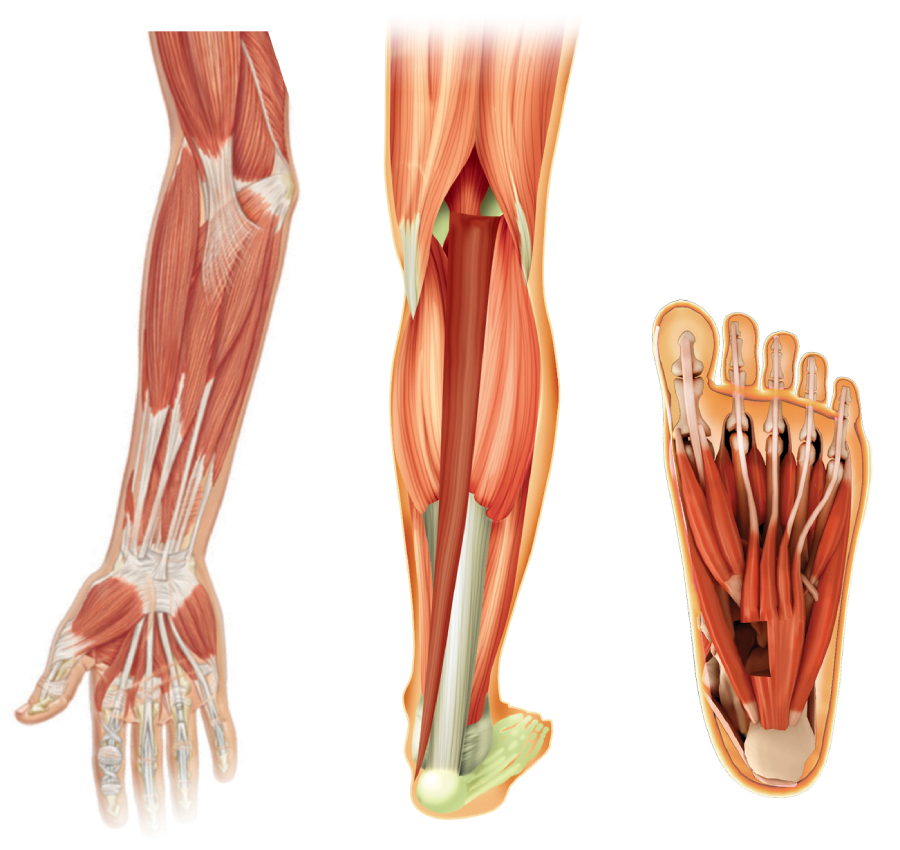
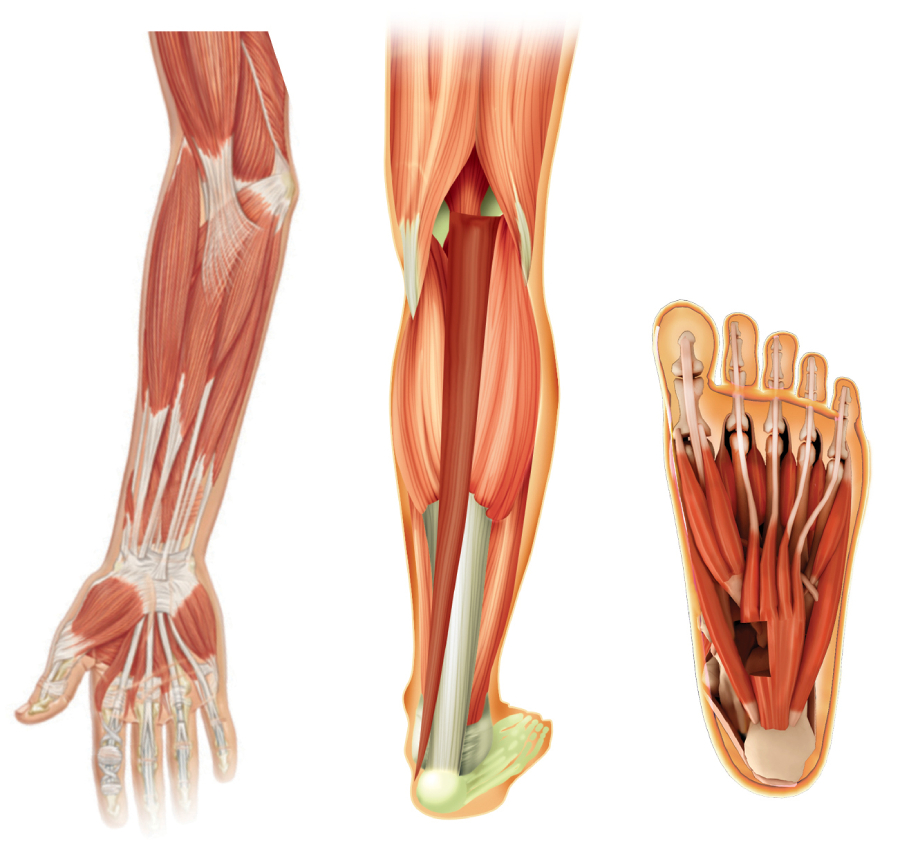
BOTOX är indicerat för symptomatisk behandling av:3
- Fokal spasticitet i handled och hand hos vuxna patienter efter stroke
- Fokal spasticitet i fotled och foten hos vuxna patienter efter stroke
Spasticitet är en fysisk och smärtsam sekundär störning som påverkar patientens extremiteter4
Världens befolkning lever allt längre. Med ökande incidens av stroke och stigande överlevnad, ökar också prevalensen av spasticitet efter stroke. I en studie med 301 patienter bedömdes 211 (70,1%) patienter för spasticitet efter 6 månader. Av dessa hade över 40 % utvecklat spasticitet inom 6 månader.4
Bedömd för spasticitet med hjälp av Modifierad Ashworth Skala (MAS) vid 6 månader efter stroke:
Klinisk effekt3
Vid ihållande muskelkramper i handled och hand hos patienter som har haft en stroke, kommer en förbättring vanligtvis att märkas inom de första 2 veckorna efter injektionen. Den maximala effekten märks vanligtvis ungefär 4 till 6 veckor efter behandlingen. De flesta patienter injiceras igen efter mellan 12 till 16 veckor. Behandling bör inte ges oftare än var 12:e vecka.
Vid ihållande muskelkramper i fotled och fot hos patienter som har haft en stroke. Om det bedöms lämpligt av den behandlande läkaren kan patienten övervägas för återinjektion när den kliniska effekten av den tidigare injektionen har minskat, men inte tidigare än 12 veckor efter föregående injektion.
Effekten och säkerheten vid behandling av spasticitet hos vuxna patienter efter stroke har utvärderats i flera randomiserade, multicenter, dubbelblinda, placebokontrollerade studier.
I en studie av spasticitet i övre extremiteterna hos 126 patienter (64 BOTOX, 62 placebo) visades en statistiskt signifikant minskning av muskeltonus vid vecka 6 för BOTOX 200-240 enheter jämfört med placebo (p<0,05).
I en studie av spasticitet i nedre extremiteterna inkluderades 468 patienter (233 BOTOX, 235 placebo) med ankelspasticitet. BOTOX 300 till 400 enheter eller placebo injicerades i flera muskler i benet. En statistiskt och kliniskt signifikant förbättring av ankel MAS-poäng och CGI (Clinical Goal Index) vid vecka 4 och 6 visades i BOTOX-gruppen jämfört med placebo (p<0,05).
I en annan studie av 120 patienter med spasticitet i nedre extremiteterna som påverkar fotleden, fick 58 patienter BOTOX (total dos 300 enheter) och 62 fick placebo. Här sågs en signifikant förbättring i BOTOX-gruppen jämfört med placebo för övergripande förändring från baslinje till vecka 12 i MAS ankelpoäng (p=0,006) och även för förändring av MAS-poäng från baslinje vid vecka 4, 6 och 8 (p<0,001).
Biverkningar3
I de kliniska studierna har biverkningar som ansetts relaterade till BOTOX rapporterats hos 16 procent med fokal spasticitet i övre extremitet i samband med stroke och 15 procent med fokal spasticitet i nedre extremiteten i samband med stroke. Lokal muskelsvaghet utgör den förväntade farmakologiska effekten av botulinumtoxin i muskulatur.
Fokal spasticitet i övre extremiteten i samband med stroke hos vuxna
Organsystem | Föredragen term | Frekvens |
| Magtarmkanalen | Illamående | Vanliga |
| Muskuloskeletala systemet och bindväv | Smärta i extremitet, muskelsvaghet | Vanliga |
| Allmänna symtom och/eller symtom vid administreringsstället | Trötthet, perifert ödem | Vanliga |
Fokal spasticitet i nedre extremiteten i samband med stroke hos vuxna
Klassificering av ogansystem | Rekommenderad term | Frekvens |
| Hud- och subkutana vävnadstörningar | Utslag | Vanliga |
| Muskuloskeletala systemet och bindväv | Artralgi, muskuloskeletal stelhet, muskelsvaghet | Vanliga |
| Allmänna symtom och/eller symtom vid administreringsstället | Perifert ödem | Vanliga |
| Skador och förgiftningar och behandlingskomplikationer | Fall | Vanliga |
Tabell från BOTOX SPC. Frekvensen av alla biverkningar som anges i tabellerna ovan är vanliga (förekommer hos 1-10 av 100 patienter)
Film om optimerad behandling med botulinumtoxin typ A för muskelöveraktivitet efter stroke3
Bo Biering-Sørensen Neurolog, klinisk lektor och överläkare vid Rigshospitalet, Glostrup i Danmark har tillsammans med AbbVie gjort en film där han delar med sig av sin stora erfarenhet av att behandla muskelöveraktivitet efter en stroke.
Filmen ger en översikt över allt som är värt att veta om behandling och omhändertagandet av patienter som lider av spasticitet efter en stroke.
Syftet med filmen är:
- Att hjälpa nya injektörer få viktig kunskap inom området så att de kan komma igång med behandling av muskelöveraktivitet efter stroke.
- Att ge erfarna inspektörer som till exempel har deltagit i Skandyspas-utbildningar möjlighet att uppdatera och utveckla sina kunskaper.
Filmen berör olika viktiga ämnen i relation till muskelöveraktivitet:
- Hur stort är problemet med muskelöveraktivitet.
- Vilka patienter som riskerar att utveckla muskelöveraktivitet.
- Vem ska behandlas, det vill säga hur Du hittar rätt patient.
- Definition av försvagande muskelöveraktivitet och lokalisering hos den enskilda patienten.
- Hur man sätter upp SMARTa mål tillsammans med patienten och hur man bäst följer upp dessa mål
Filmen är uppdelad i flera delar. Det är möjligt att klicka på de enskilda avsnitten efter intresse. Vi hoppas att innehållet är intressant och att det kan vara till stöd inför behandlingen av patienter med muskelöveraktivitet efter en stroke..
Behandling med BOTOX - Fokal spasticitet efter stroke3
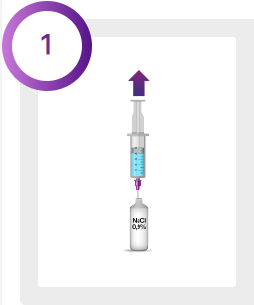
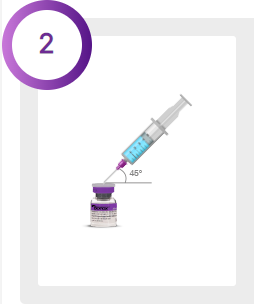
Spädningstabell för injektionsflaska med 100 respektive 200 Allerganenheter.
BOTOX får enbart lösas i steril, fysiologisk natriumkloridlösning utan konserveringsmedel (natriumklorid 0,9 % injektionsvätska).
*Steril fysiologisk natriumkloridlösning utan konserveringsmedel (natriumklorid 0,9 % injektionsvätska)
BOTOX kan förvaras i upp till 5 dagar vid 2°C-8°C efter beredning. Ur ett mikrobiologiskt perspektiv bör det användas omedelbart. Om den inte används omedelbart ska den beredda lösningen därför normalt inte förvaras i mer än 24 timmar vid 2°C-8°C, undantaget om beredningen har ägt rum under kontrollerade och validerade aseptiska förhållanden.
*Steril fysiologisk natriumkloridlösning utan konserveringsmedel (natriumklorid 0,9 % injektionsvätska)
Steril 25, 27 eller 30 gauge nål. Nålens längd bör bestämmas baserat på muskelns plats och djup.
Elektromyografisk vägledning, nervstimulerings- eller ultraljudstekniker kan användas för att lokalisera de berörda musklerna. Injektion på flera ställen kan göra att BOTOX får en bättre kontakt med muskelns innervationsområden och är särskilt användbart för större muskler.
Exakt dosering och antal injektionsställen anpassas till individen med hänsyn till:
- De berörda musklernas storlek
- Antal muskler
- Musklernas lokalisation
- Spasticitetens svårighetsgrad
- Förekomst av lokal muskelsvaghet
- Patientens svar på tidigare behandling
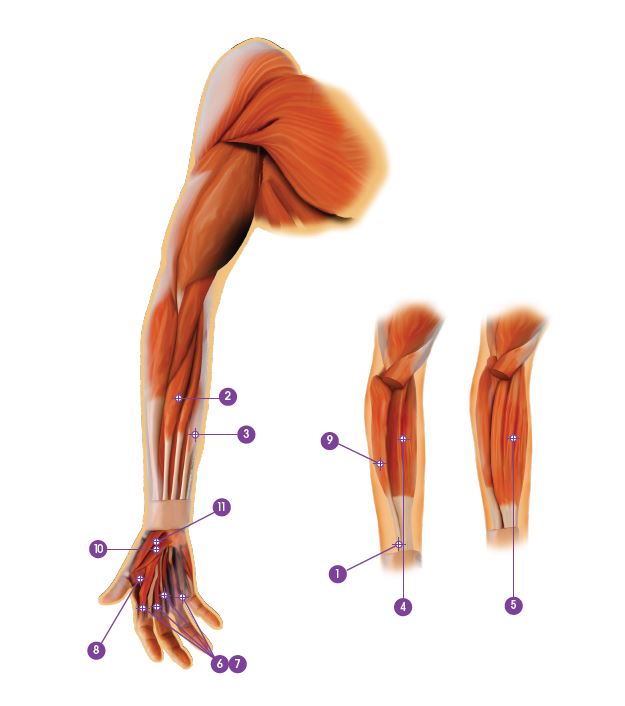
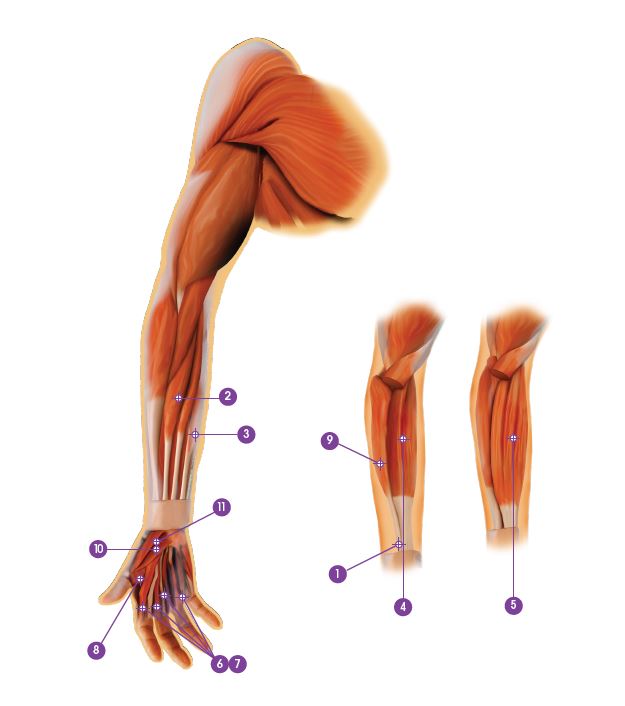
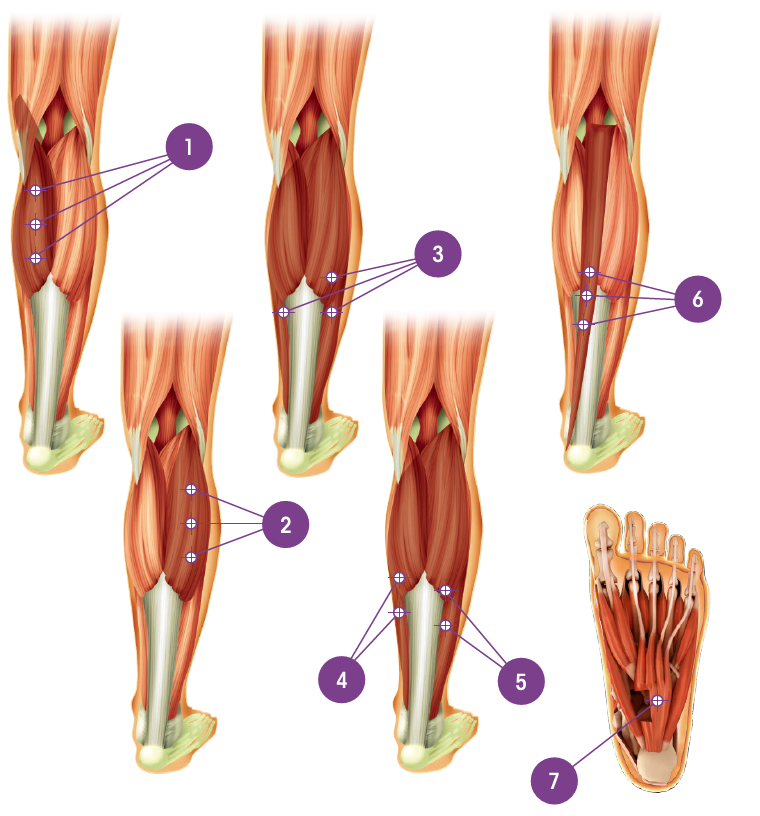
| Muskel | Total dosering; antal injektionsställen |
Gastrocnemius | 75 enheter; 3 ställen |
| 3. Soleus | 75 enheter; 3 ställen |
| 4. Flexor digitorum longus | 50 enheter; 2 ställen |
| 5. Flexor hallucis longus | 50 enheter; 2 ställen |
| 6. Tibialis posterior | 75 enheter; 3 ställen |
| 7. Flexor digitorum brevis | 25 enheter; 1 ställe |
Den rekommenderade dosen för behandling av spasticitet i övre extremiteten är upp till 240 enheter fördelade på de drabbade musklerna. Den maximala dosen under ett behandlingstillfälle är 240 enheter.
Den rekommenderade dosen för behandling av spasticitet i nedre extremiteten är 300–400 enheter fördelade på upp till 6 muskler. tabell. Den högsta rekommenderade dosen under ett behandlingstillfälle är 400 enheter.
Om det bedöms lämpligt av den behandlande läkaren kan kan ytterligare doser tillföras när effekten av en tidigare injektion har minskat, dock tidigast 12 veckor efter den föregående injektionen.
Efter BOTOX-behandling6
BOTOX botar inte spasticiteten men underlättar fortsatt träning under ledning av fysioterapeut och/eller arbetsterapeut. En mer intensiv träning med bland annat muskeltöjningar direkt efter BOTOX-injektionerna kan förstärka och förlänga effekten.
Läs mer om ämnet i dessa relaterade nyheter
Vad kan 300 brittiska fysioterapeuter lära oss om injektioner av botulinumtoxin?
Endast en minoritet av strokepatienter relevanta för behandling med botulinumtoxin mot utvecklad spasticitet får tillgång till den. Flertalet kliniker i Norge, Sverige och Danmark vittnar om brist på injektörer som den främsta utmaningen. Kan fysioterapeuter vara en del av lösningen?
Bättre effekt med tidig BOTOX-behandling hos patienter med spasticitet efter stroke
Är tidpunkten för behandling med BOTOX viktig för utfallet? En ny studie genomförd av Patel, Ward och Jost et al visar på effekten av tidig insättning av BOTOX hos vuxna patienter med fokal spasticitet efter stroke.
Prenumerera på BOTOX News
BOTOX News är ett nyhetsbrev från det skandinaviska BOTOX-teamet på AbbVie. Målet är att hålla dig som arbetar med BOTOX informerad och uppdaterad om det senaste inom området. Du får nyheter inom terapiområdet och tips och råd som kan hjälpa dig i behandlingen av dina patienter.
Referenser/BOTOX minimitext SmPC
- Feigin VL, Abate MD, Abate YH, et al. Global, regional, and national burden of stroke and its risk factors, 1990–2021: a systematic analysis for the Global Burden of Disease Study 2021. The Lancet Neurology. 2024 Oct;23(10):973–1003. https://www.thelancet.com/journals/laneur/article/PIIS1474-4422(24)00369-7/fulltext
- Wissel J, Ward AB, Erztgaard P, et al. European consensus table on the use of botulinum toxin type A in adult spasticity. J Rehabil Med. 2009 Jan;41(1):13-25
- BOTOX Summary of Product Characteristics
- Urban PP, Wolf T, Uebele M et al. Occurence and clinical predictors of spasticity after ischemic stroke, Stroke 2010; 41: 2016—2020
- Dressler D, Saberi FA, Botulinum toxin: mechanisms of action. Eur Neurol. 2005;53(1):3-9
- Mills P B, Finlayson H, Sudol M, et al. Systematic review of adjunct therapies to improve outcomes following botulinum toxin injection for treatment of limb spasticity. Clinical rehabilitation. 2016 Jun;30(6):537-48
15. Mars 2025. SE-BTX-250004