BOTOX för att behandla kronisk migrän
PREEMPT injektionsparadigm utformades specifikt för behandling av kronisk migrän, på basis av den befintliga kunskapen av patofysiologin.2, 3 31-39 intramuskulära, dosfixerade injektioner att administrera på fixerade punkter i huvud och nacke var 12e vecka.1
Film: AMI Injection Model Tutorial Video - Chronic Migraine
AMI Injection Model Tutorial Video
-
How to use models to support BOTOX (butolinum toxin type A) injection training for: Chronic Migraine
00:00:00 -
Introducing the Camille model for injection training
00:00:20 -
Localising head and neck muscles for the PREEMPT injection paradigm
00:02:00 -
Injection technique for the PREEMPT paradigm
00:04:55 -
Injection technique for the follow-the-pain procedure
00:12:00 -
Post-injection guidance and summary
00:13:40
SE-BTX-220014
BOTOX-injektioner, injektionsparadigm1-3
BOTOX PREEMPT injektionsparadigm vid behandling av kronisk migrän
Rekommenderad dos: 155 enheter till 195 enheter administrerat intramuskulärt i form av injektioner om 0,1 mL (5 enheter) i 31 eller upp till 39 injektionsställen.
Här presenteras en översikt av injektionspunkterna för PREEMPT:
Huvud/nackområde | Total dosering (antal injektionsställena) |
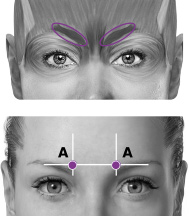
| A. Korrugatorb | 10 enheter (2 ställen) |
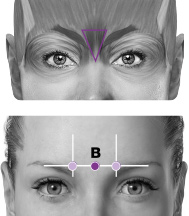
| B. Procerus | 5 enheter (1 ställe) |
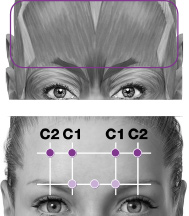
| C. Frontalisb | 20 enheter (4 ställen) |
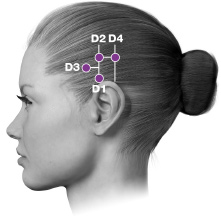
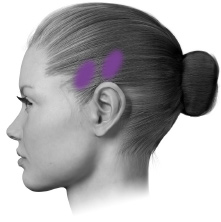
| D. Temporalisb | 40 enheter (8 ställen) upp till 50 enheter (upp till 10 ställen) |
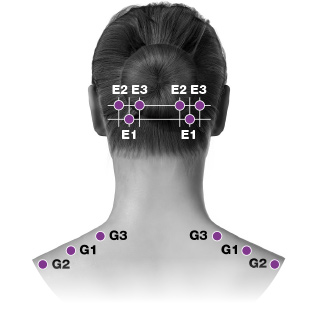
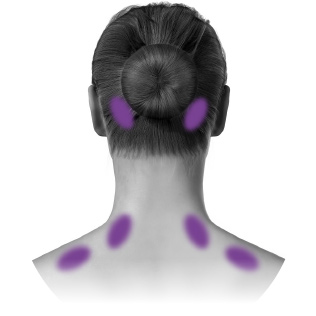
| E. Occipitalisb | 30 enheter (6 ställen) upp till 40 enheter (upp till 8 ställen) |
| F. Nackens paraspinala musklerb | 20 enheter (4 ställen) |
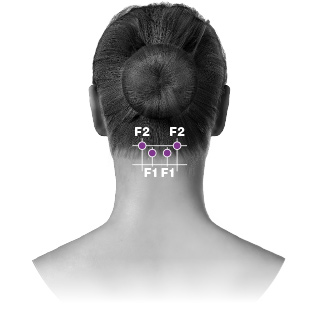
| G. Trapeziusb | 30 enheter (6 ställen) upp till 50 enheter (upp till 10 ställen) |
| Totalt doseringsintervall: | 155 enheter till 195 enheter 31 till 39 injektionsställen |
Tabellen har sammanställts av Abbvie baserat på BOTOX SPC avsnitt 4.2
a1 i.m. injektionsställe = 0,1 mL = 5 enheter BOTOX
bDosen distribueras bilateralt
PREEMPT-paradigmet riktar in sig på 7 muskelområden
31 injektionsställen är bestämda och ska injiceras med en specifikt 5 enheter på varje ställe (kallat “fixed-site, fixed dose”). Utöver dessa finns ytterligare 8 potentiella injektionsställen, enligt principen “följ smärtan” (kallat “follow the pain”). Det totala antalet enheter är därför 155-195.
G TRAPEZIUS
30 enheter
(6 injektionsställen)
Injektion: ytligt
TRAPEZIUS*
Upp till ytterligare 20 enheter
(4 injektionsställen)
Injektion: ytligt
*Follow The Pain
BOTOX kan förvaras i upp till 5 dagar vid 2°C-8°C efter beredning. Ur ett mikrobiologiskt perspektiv bör det användas omedelbart. Om den inte används omedelbart ska den beredda lösningen därför normalt inte förvaras i mer än 24 timmar vid 2°C-8°C, undantaget om beredningen har ägt rum under kontrollerade och validerade aseptiska förhållanden.1
*Steril fysiologisk natriumkloridlösning utan konserveringsmedel (natriumklorid 0,9 % injektionsvätska)
BOTOX kan förvaras i upp till 5 dagar vid 2°C-8°C efter beredning. Ur ett mikrobiologiskt perspektiv bör det användas omedelbart. Om den inte används omedelbart ska den beredda lösningen därför normalt inte förvaras i mer än 24 timmar vid 2°C-8°C, undantaget om beredningen har ägt rum under kontrollerade och validerade aseptiska förhållanden.1
Biverkningar av BOTOX-behandling
I kliniska prövningar för kronisk migrän var andelen patienter som rapporterade någon form av biverkan 26 procent vid den första behandlingen, vilket minskade till 11 procent vid den andra behandlingen. Lokal muskelsvaghet utgör den förväntade farmakologiska effekten av botulinumtoxin i muskulatur.1 Läs mer här
Prenumerera på BOTOX News
BOTOX News är ett nyhetsbrev från det skandinaviska BOTOX-teamet på AbbVie. Målet är att hålla dig som arbetar med BOTOX informerad och uppdaterad om det senaste inom området. Du får nyheter inom terapiområdet och tips och råd som kan hjälpa dig i behandlingen av dina patienter.
Referenser/BOTOX minimitext SmPC
- BOTOX Summary of Product Characteristics
- Blumenfeld AM, Silberstein SD, Dodick DW et al. Method of injection of OnabotulinumtoxinA for chronic migraine: A safe, well-tolerated, and effective treatment paradigm based on the PREEMPT clinical program. Headache 2010; 50: 1406–1418
- Blumenfeld AM, Silberstein SD, Dodick DW et al. Insights into the functional anatomy behin the PREEMPT injecting paradigm: Guidance on achieving optimal outcomes. Headache 2017;57(5):766-777
15. Mars 2025, SE-BCM-250014