BOTOX är indicerat för behandling av1
- Ständiga besvär av svår primär hyperhidros i axillerna, som försvårar dagliga aktiviteter, och som är resistent mot lokal behandling
Klinisk effekt och säkerhet
Majoriteten svarar på behandlingen1,3
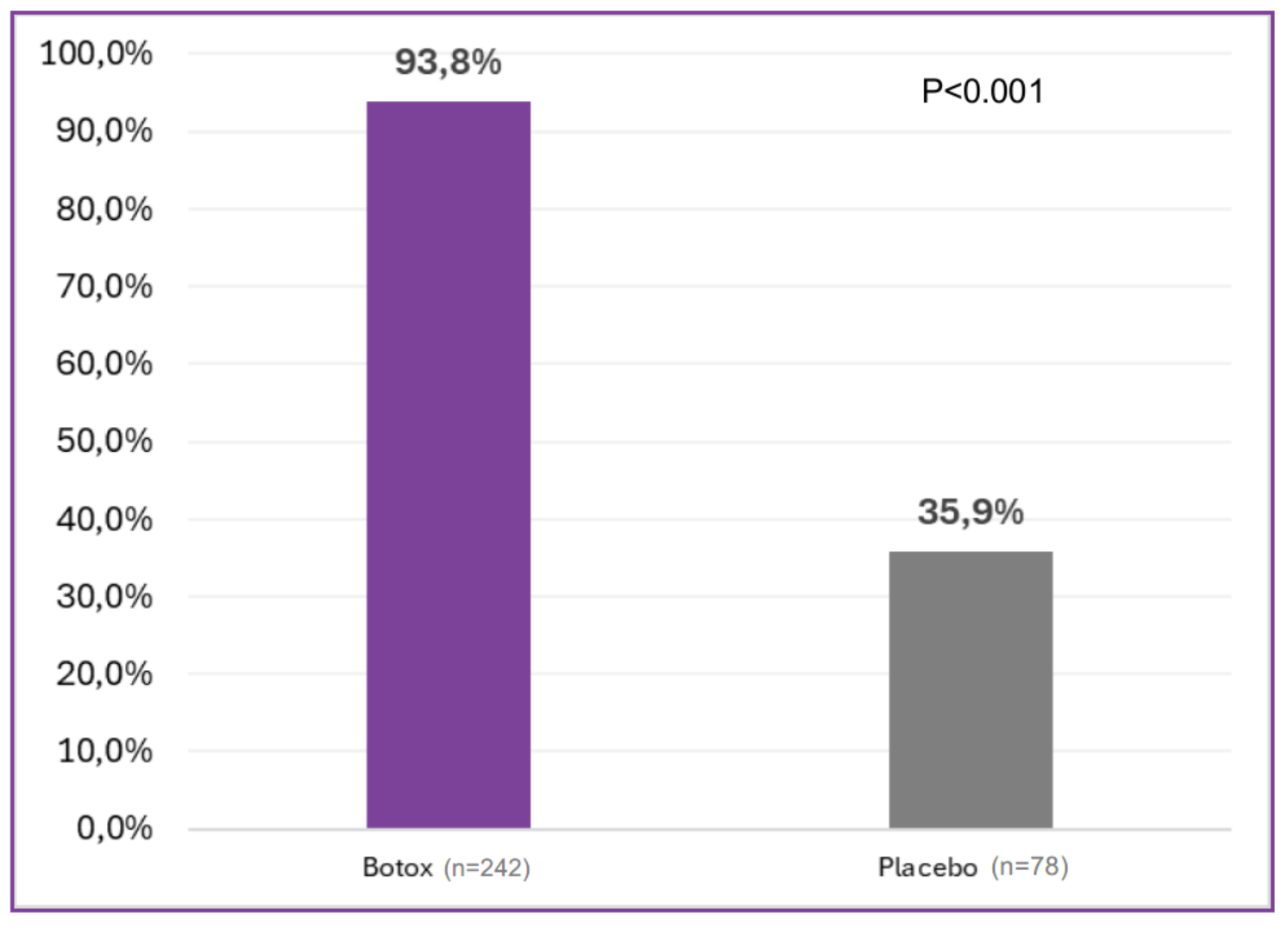
En dubbelblind, multicenter klinisk studie på patienter med ihållande bilateral primär axillär hyperhidros genomfördes med 320 patienter som randomiserades till att få antingen 50 enheter BOTOX (n=242) eller placebo (n=78).1
I den kliniska studie som låg till grund för godkännandet definierades kliniskt relevant respons som minst en halvering av svettningarna. Vid utvärderingen efter fyra veckor var responsfrekvensen i BOTOX-gruppen 93,8 procent jämfört med 35,9 procent i placebogruppen (p < 0,001). Incidensen höll i sig vid alla undersökningstillfällen upp till 16 veckor efter behandlingsstart.1
307 patienter fullföljde studien: 234 patienter i BOTOX-gruppen och 73 patienter i placebogruppen.3
Adapterad av AbbVie (baserat på SPC)
Behandling med BOTOX - Axillär hyperhidros1
Rekommenderad spädning
Den rekommenderade dosen BOTOX är 50 enheter per axill.1 För totalt 20 injektioner per axill rekommenderas därför spädning om 100 enheter BOTOX i 4 ml spädningsvätska, resulterande i 2,5 enheter per 0,1 ml färdig spädning.4
Steril 30 gauge nål.
Det hyperhidrotiska området kan fastställas med hjälp av vanlig färgningsteknik, t.ex. Minors jod-stärkelseprov.
Andra doser än 50 enheter per axill kan inte rekommenderas. Injektioner skall inte upprepas med kortare intervall än 16 veckor.
Prenumerera på BOTOX News
BOTOX News är ett nyhetsbrev från det skandinaviska BOTOX-teamet på AbbVie. Målet är att hålla dig som arbetar med BOTOX informerad och uppdaterad om det senaste inom området. Du får nyheter inom terapiområdet och tips och råd som kan hjälpa dig i behandlingen av dina patienter.
Referenser/BOTOX minimitext SmPC
- BOTOX Summary of Product Characteristics
- Läkartidningen nr 47 2011 volym 108, artikel: Hyperhidros – det >tysta< handikappet
- Naumann M, Lowe NJ. Botulinum toxin type A in treatment of bilateral primary axillary hyperhidrosis: a randomised, paralell group, double blind, placebo controlled trial. BMJ 2001;323:1-4
- Naumann M, Lowe NJ, Kumar CR et al. Botulinum toxin type a is a safe and effective treatment for axillary hyperhidrosis over 16 months: a prospective study. Arch Dermatol. 2003 Jun;139(6):731-6
15. Mars 2025. SE-BTX-250004