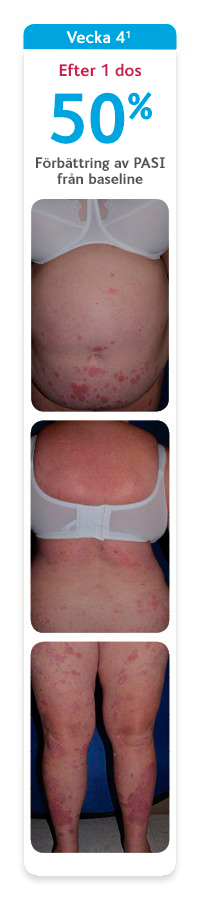
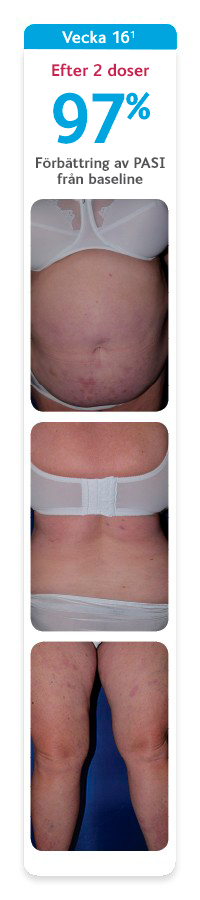
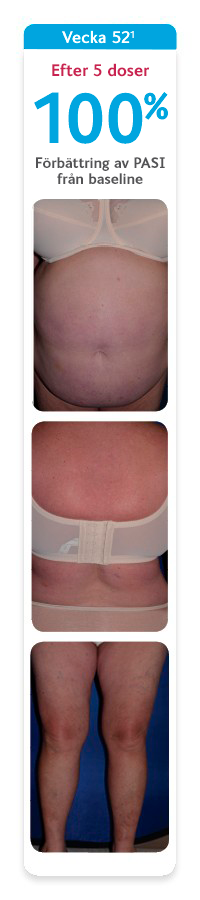
SKYRIZI ger din vuxna patient möjlighet att leva ett liv utan att begränsas av plackpsoriasis1
Effekt som består – vid behandling av plackpsoriasis, PsO
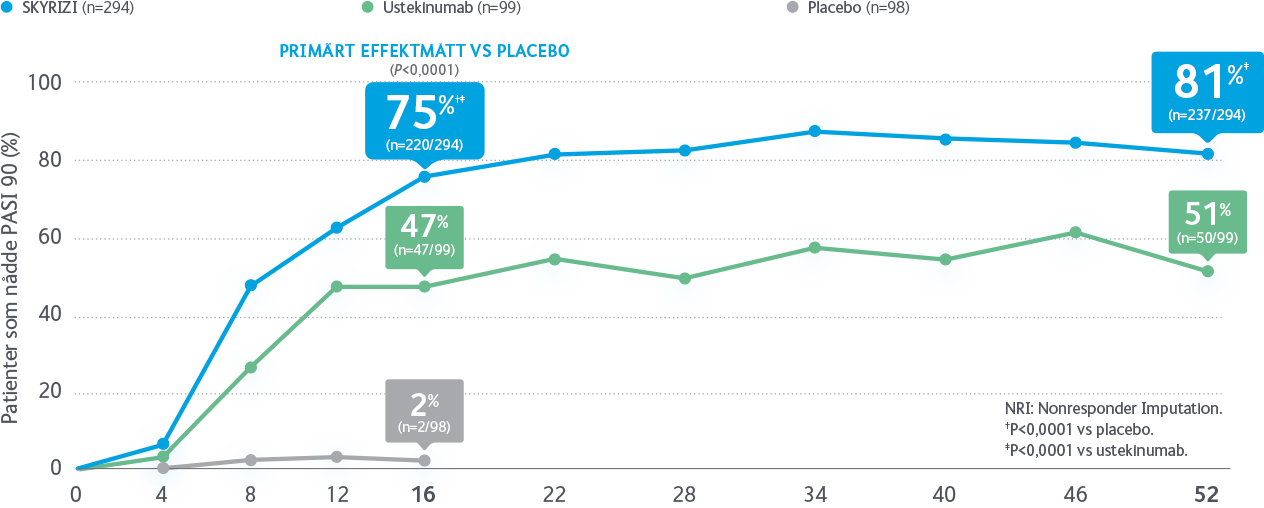
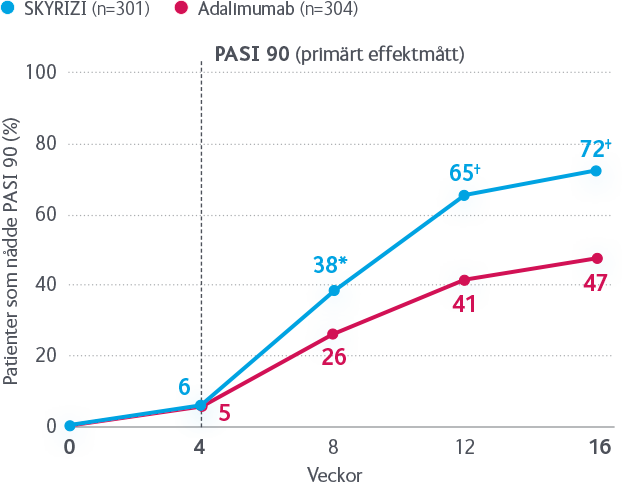
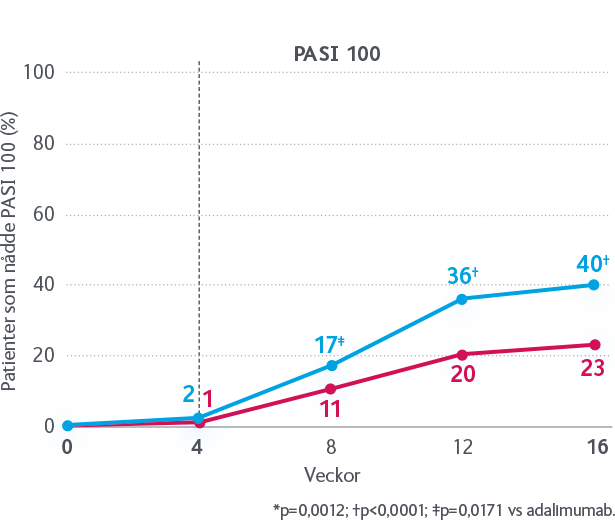
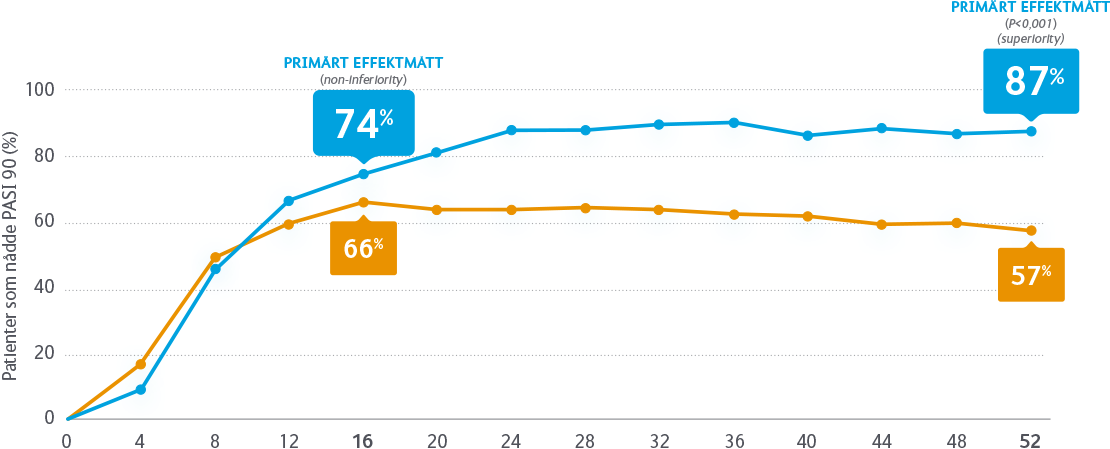
Godkännandet av SKYRIZI för behandling av vuxna med måttlig till svår plackpsoriasis, grundas på resultaten från fyra pivotala fas 3-studier som visat att signifikant fler patienter når PASI 90/100 vid behandling med SKYRIZI, än med TNF-hämmaren adalimumab respektive IL-12/23-hämmaren ustekinumab1,2*. Det finns även data från en direkt jämförande studie mellan SKYRIZI och IL-17-hämmaren sekukinumab. Resultatet visar att signifikant fler patienter nådde PASI 90 vecka 52 med SKYRIZI än med sekukinumab (87 % vs 57 %, p<0,001)3.
Stora möjligheter till bestående hudutläkning1–4
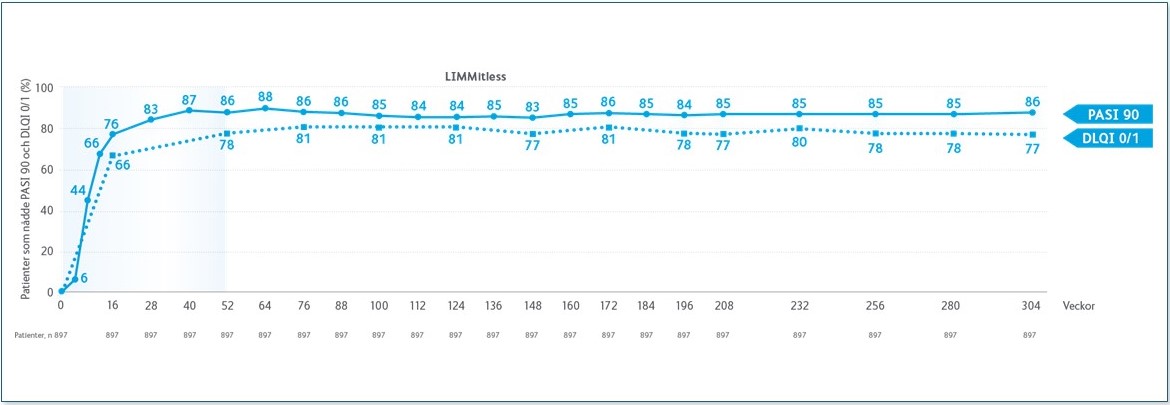
LIMMitless är en öppen förlängningsstudie av fem fas 2- och 3-studier där patienterna behandlas kontinuerligt med SKYRIZI 150 mg var 12:e vecka.4† Resultaten visar att effekten av SKYRIZI är bestående vid 304 veckors uppföljning, det vill säga efter ca 5,5 år, och ligger i linje med vad som tidigare visats för PASI 90 och 100, utan att den kvartalsvisa doseringen justerats.1,2,4
Resultaten i LIMMitless visar även att den förbättring av patienternas livskvalitet som sågs vid vecka 52, då 78 % av patienterna inte upplevde någon påverkan på sin livskvalitet (DLQI 0/1), kvarstår vecka 304.4
Effekten med SKYRIZI består över tid*
~ 6 års uppföljning
*Data anges i formatet non-responder imputation (NRI). Analysen inkluderar integrerade data från UltIMMa-1,UltIMMa-2, IMMvent samt SustalMM, NCT03255382
Referens
Papp K, et al. Long-term Safety and Effcacy of Risankizumab for the treatment of Moderate-to-Severe Plaque Psoriasis: Interim Analysis of Results From the LIMMitless Open-label Extension Trial for up to 6 Years of Follow-up. Poster 2428 presenterad på EADV 2023, 11–14 oktober 2023, Berlin, Tyskland.
*SKYRIZI vs ustekinumab, PASI 90/100 vecka 52: 81/59 % vs 50/30 %, p<0,0011. SKYRIZI vs adalimumab, PASI 90/100 vecka 16: 72/47 % vs 40/23 %, p<0,0012.
†150 mg administreras via subkutan injektion vecka 0, vecka 4 och därefter var 12:e vecka.
Referenser
- Gordon et al. Lancet 2018;392:650–61.
- Reich et al. Lancet 2019;394:576–86.
- Warren et al. Br J Dermatol 2021;184(1):50-9.
- Papp et al. AAD 2023; Poster 43928; Long-term Safety and Efficacy of Risankizumab for the Treatment of Moderate-to-Severe Plaque Psoriasis: Interim Analysis of Results From the LIMMitless Open-label Extension Trial Beyond 5.5 Years of Follow-up
SKYRIZI vs ustekinumab
I UltIMMa-2 studerades effekt och säkerhet vid behandling med SKYRIZI jämfört med placebo eller ustekinumab under 52-veckor.
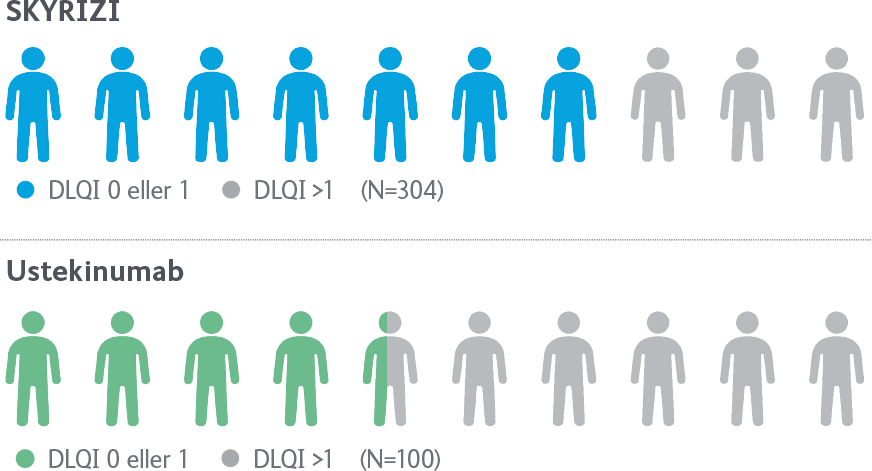
Fler än 7 av 10 patienter som behandlades med SKYRIZI uppgav att psoriasis inte påverkade deras livskvalitet vid vecka 52*
p<0,001 SKYRIZI vs ustekinumab
*Bilden illustrerar data från UltIMMa-2 där 71 % av patienterna som behandlades med SKYRIZI jämfört med 44 % av patienterna som behandlades med ustekinumab uppgav DLQI 0 eller 1 vecka 52. DLQI 0 eller 1 definieras som “Ingen påverkan på hälsorelaterad livskvalitet.”
Referens
Gordon KB, et al. Lancet 2018;392:650–61.
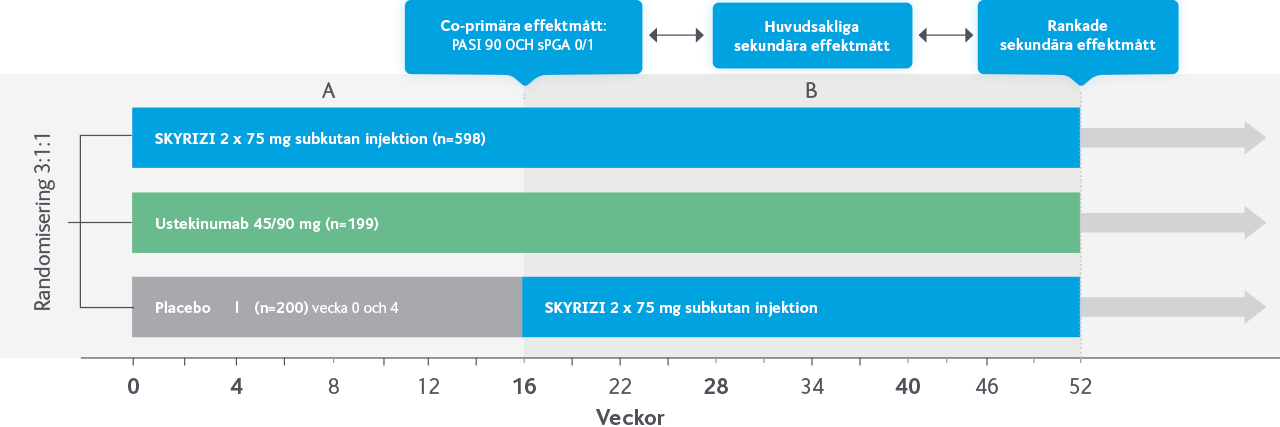
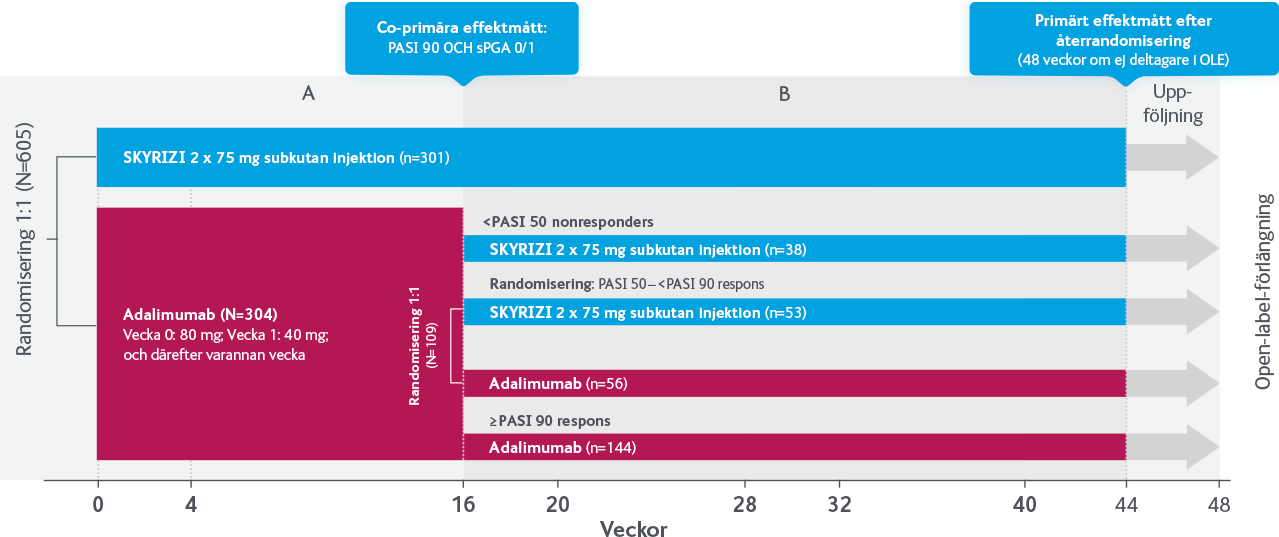
SKYRIZI vs adalimumab
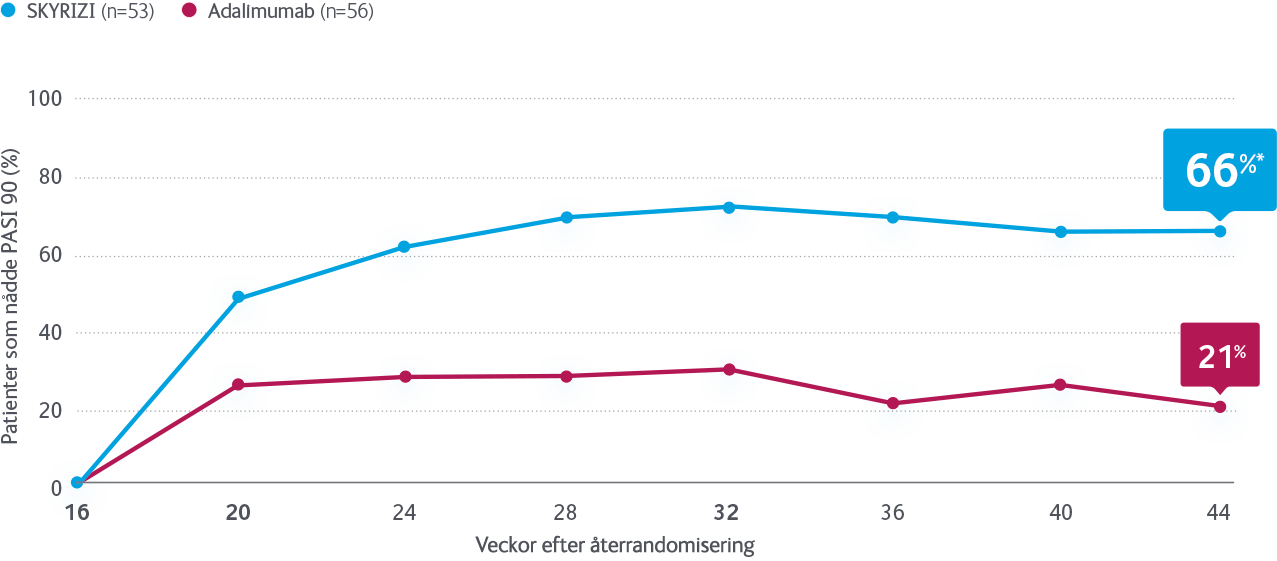
I IMMvent jämfördes SKYRIZI med adalimumab hos patienter med måttlig till svår kronisk plackpsoriasis. Studien bestod av två delar, A och B. I del A randomiserades patienter till behandling med SKYRIZI eller adalimumab under 16 veckor. I del B återrandomiserades de patienter som fått adalimumab och nått partiell respons (PASI >50 till <90) under vecka 0–16, till fortsatt behandling med adalimumab eller byte till SKYRIZI under vecka 16–44.
B: Nästan 7 av 10 patienter som bytte från TNF till SKYRIZI nådde PASI 90 vecka 44
NRI: Nonresponder Imputation. *P<0,001 vs adalimumab.
Gäller adalimumab-behandlade patienter vecka 0–16, som var partiella responders (PASI 50–<PASI 90). Randomiserades 1:1 vecka 16 till SKYRIZI eller fortsatt adalimumab, (N=109/304=36%).
Referens
Reich K, et al. Lancet 2019;394:576–86.
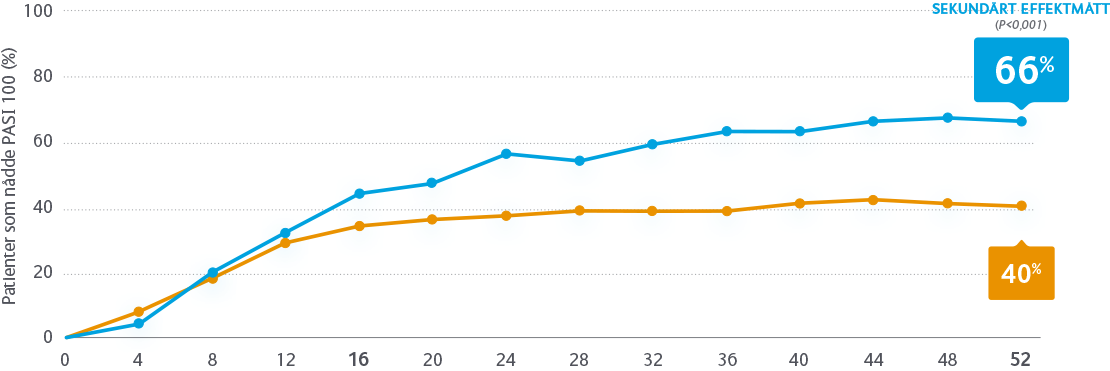
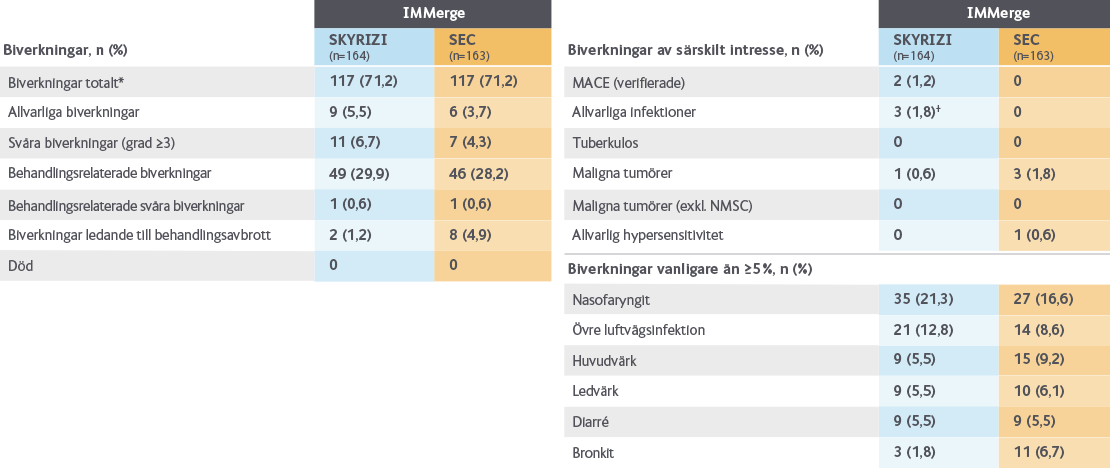
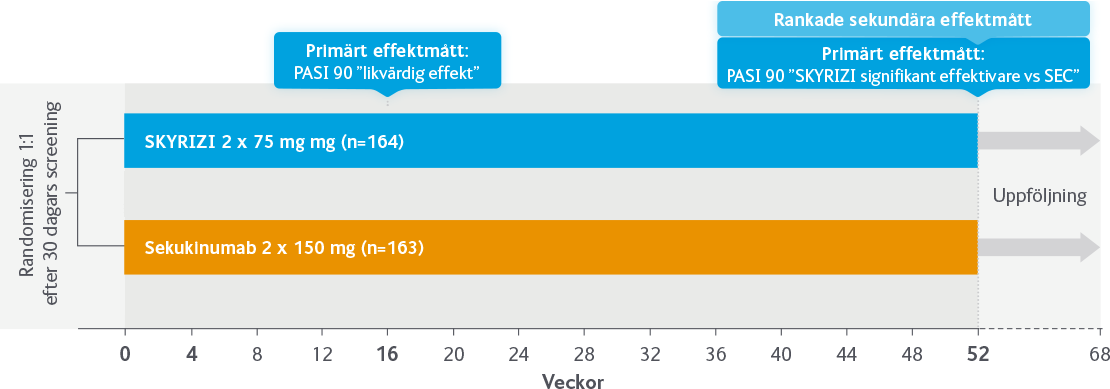
SKYRIZI vs sekukinumab
I studien IMMerge studerades effekt och säkerhet vid behandling med SKYRIZI jämfört med sekukinumab under 52 veckor.
Studiedesign: IMMerge
Global, multicenter, randomiserad, fas 3b-studie, som jämfört SKYRIZI med sekukinumab (SEC) hos vuxna patienter med måttlig till svår kronisk plackpsoriasis.
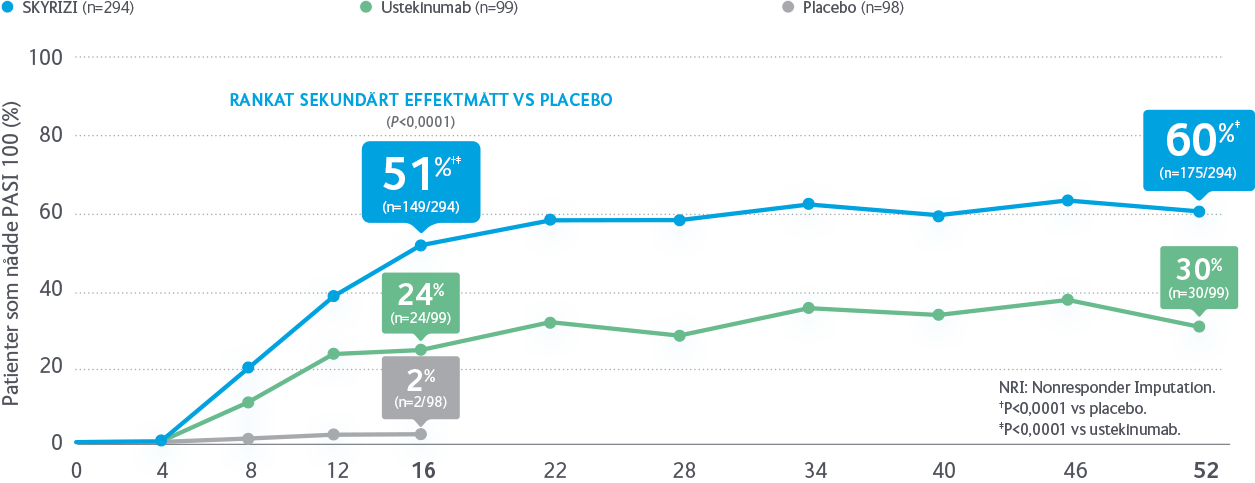
Rankade sekundära effektmått: PASI 100, sPGA 0/1 och PASI 75 vecka 52.
Referens
Warren RB, et al. Br J Dermatol 2021Jan;184(1):50-59. doi: 10.1111/bjd.19341. Epub 2020 Sep 6.
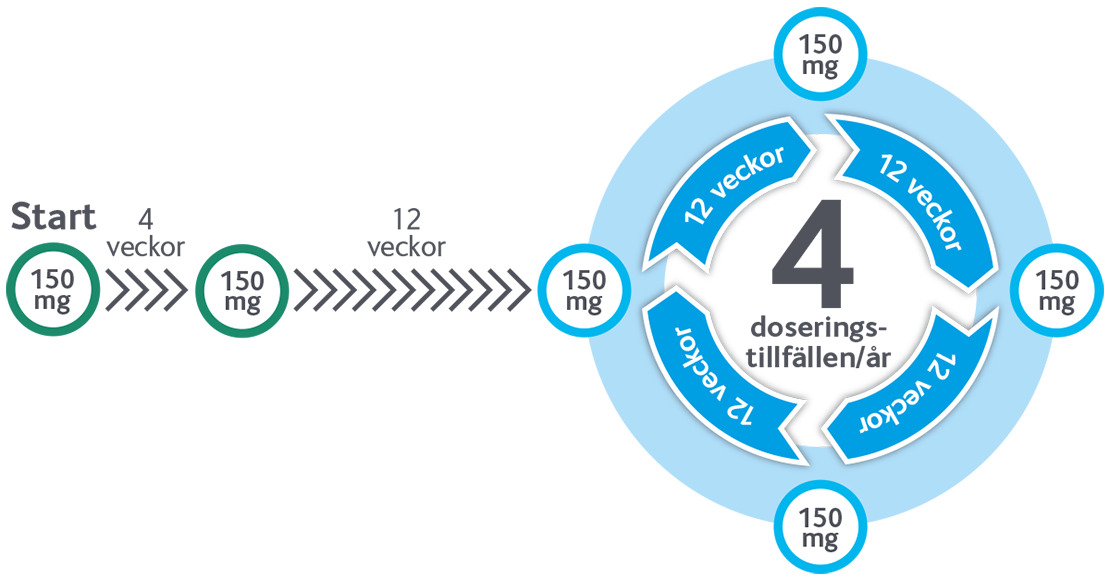
SKYRIZI doseras 150 mg vecka 0, vecka 4, och därefter var 12:e vecka.
- Endast 4 injektioner per år
- Möjlighet att välja mellan förfylld penna eller förfylld spruta,150 mg/1 ml
- Samma dosering vid behandling av psoriasis och psoriasisartrit1
Enkelhet ger nöjda patienter
Resultaten av en enkät där patienterna fick bedöma sin upplevelse av den förfyllda pennan (Self-Injection Assessment Questionnaire, SIAQ), visade att*:
98% (n=81/83)
var nöjda eller mycket nöjda
98% (n=81/83)
tyckte att pennan var väldigt eller mycket lätt att använda
98% (n=81/83)
ansåg att pennan var bekväm eller mycket bekväm att använda
Patienternas tillfredsställelse med injektionerna uppmättes vid vecka 28 (totalt 4 injektioner) hos patienter som använde SKYRIZI i förfylld penna med hjälp av frågeformuläret SIAQ, ett validerat instrument för att mäta patientens känslor och upplevelser vid självinjektion.
*Data on File, AbbVie Inc
Referens
- Strober B, et al. JEADV 2020;34:2830–8.
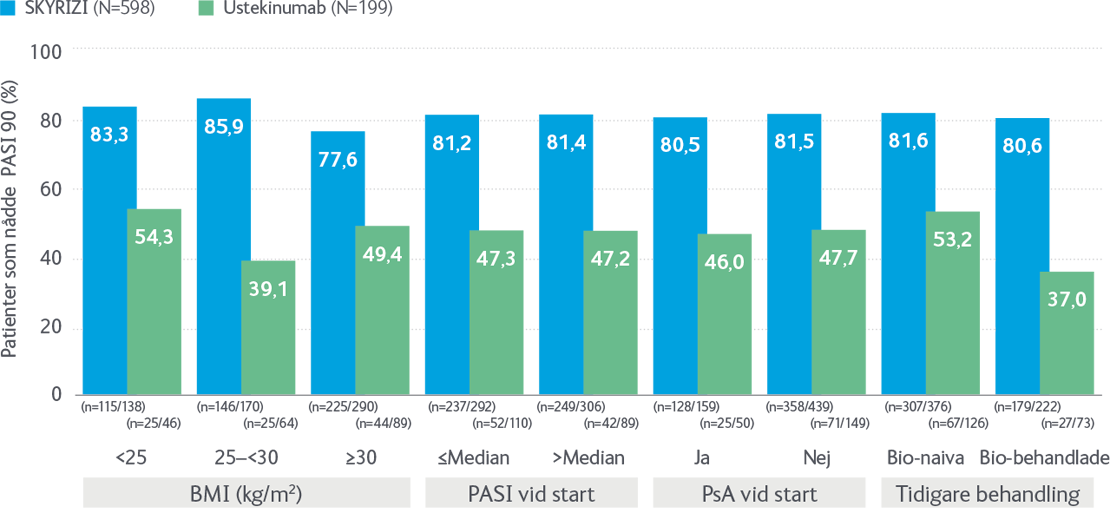
Samma dos för alla patientkategorier1
Effekten oberoende av BMI, PASI, PsA och tidigare biologisk behandling
NRI: Nonresponder Imputation. P-värden för skillnader mellan grupperna (BMI, PASI, tidigare behandling var inte signifikanta. Median PASI vid start var 18.
BMI: Body Mass Index; PsA: psoriasisartrit.
Referens
- Strober B, et al. JEADV 2020;34:2830–8.
Säkerhetsuppföljning upp till 9,1 år1
Upp till 9.1 år (median 3.3 år) uppföljning av 3 849 patienter behandlade med SKYRIZI, fördelat på 13 805 patientår.
Behandlingen tolereras väl och förekomsten av biverkningar ökar inte över tid.1†
† Biverkningar av särskilt intresse, händelser/100 patientår, vid långtidsuppföljning,13 805 patientår : Allvarliga infektioner 1,1; Maligna tumörer (exkl NMSC) 0,6; NMSC 0,6; MACE (verifierade) 0,6 Allvarlig överkänslighet <0,1
För fullständig sammanfattning av säkerhetsprofilen för SKYRIZI, se Fass.se.
Referens
- Gordon K, et al. Risankizumab Long-Term Safety in Patients With Psoriatic Disease: Integrated Analyses of Data From Psoriasis and Psoriatic Arthritis Clinical Trials.; Poster 2616. Presenterad vid EADV 11-14 oktober 2023, Berlin, Tyskland
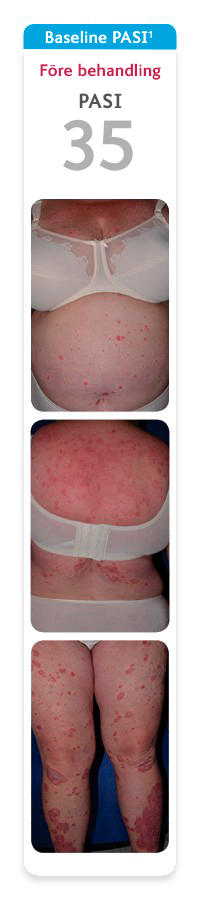
Bilderna visar en av de patienter som deltog den indikationsgrundande studien UltIMMa-2 där 60 % av patienterna som behandlades med SKYRIZI nådde PASI 100 vecka 52. Den genomsnittliga förbättringen av PASI i UltIMMa-1 och -2 var 95 %, vilket gör att de patienter som får behandling med SKYRIZI i praktiken kan förvänta sig möjlighet till utläkt eller nästan utläkt hud.1
Referens
- Gordon KB, et al. Lancet 2018;392:650–61.
SKYRIZI® (risankizumab) 150 mg injektionsvätska, lösning i förfylld spruta eller förfylld penna (F), 600 mg koncentrat till infusionsvätska, lösning i injektionsflaska (EF), 360 mg injektionsvätska, lösning i cylinderampull, 1 självhäftande injektor (F), 180 mg injektionsvätska, lösning i cylinderampull, 1 självhäftande injektor (EF), Rx, L04AC18 (interleukinhämmare).
Indikationer: Behandling av måttlig till svår plackpsoriasis hos vuxna som behöver systemisk behandling. Behandling, som monoterapi eller i kombination med metotrexat (MTX), av aktiv psoriasisartrit hos vuxna med otillräckligt behandlingssvar på eller intolerans mot ett eller flera sjukdomsmodifierande antireumatiska läkemedel (DMARDs). Behandling av vuxna med måttlig till svår aktiv Crohns sjukdom eller ulcerös kolit med otillräckligt behandlingssvar på, förlorat behandlingssvar eller intolerans mot konventionell behandling eller en biologisk behandling.
Kontraindikationer: Överkänslighet mot den aktiva substansen eller mot något hjälpämne; Kliniskt betydelsefulla aktiva infektioner (t ex aktiv tuberkulos).
Varningar och försiktighet: Risankizumab kan öka risken för infektion. Anafylaktiska reaktioner har rapporterats vid behandling med risankizumab. Avbryt omedelbart behandling och påbörja lämplig behandling om en allvarlig överkänslighetsreaktion inträffar. Fertilitet, graviditet och amning: Fertila kvinnor ska använda effektiv preventivmetod under pågående behandling och i minst 21 veckor efter avslutad behandling. Risankizumab bör undvikas under graviditet. Det är okänt om risankizumab utsöndras i bröstmjölken, risk-nyttabalansen för modern och barnet måste därför värderas. För ytterligare information samt priser se www.fass.se.
Datum för översyn av produktresumé: 14 oktober 2025.
För information: kontakta AbbVie AB, 08 684 44 600.
Begränsning av läkemedelsförmån: SKYRIZI 150 mg subventioneras endast vid plackpsoriasis och psoriasisartrit när behandling med TNF-hämmare gett otillräcklig effekt eller inte är lämplig. SKYRIZI 360 mg subventioneras för patienter som har behandlats med TNF-hämmare eller där detta inte är lämpligt. SKYRIZI 600 mg för intravenös infusion tillhandahålls som rekvisitionsläkemedel. SKYRIZI 180 mg, för patienter med ulcerös kolit, tillhandahålls som rekvisitionsläkemedel.
SE-SKZD-260002
SE-SKZD-210069_v6. Senast uppdaterad 2025-04-09