SKYRIZI ger din vuxna patient möjlighet att leva ett liv utan att begränsas av plackpsoriasis – och samtidigt få lindring av eventuella symtom på psoriasisartrit1–6
Effekt som består – vid behandling av aktiv psoriasisartrit, PsA
I oktober 2021 godkände EU-kommissionen SKYRIZI för behandling av aktiv psoriasisartrit hos vuxna med otillräckligt behandlingssvar på, eller intolerans mot, ett eller flera sjukdomsmodifierande antireumatiska läkemedel, DMARD:s, som monoterapi eller i kombination med metotrexat. Sedan tidigare är SKYRIZI godkänt för behandling av måttlig till svår plackpsoriasis hos vuxna som behöver systemisk behandling.
Detta innebär att du nu kan erbjuda dina vuxna patienter, med måttlig till svår plackpsoriasis, behandling med SKYRIZI för effektiv och varaktig hudutläkning, med god säkerhet över lång tid**1-3 – och dessutom varaktig lindring av eventuella symptom på psoriasisartrit1,4,5.
Data visar att behandling med SKYRIZI ger möjlighet till varaktig förbättring av såväl symtom som fysisk funktion, mätt med ACR20Ŧ samt varaktig utläkning av såväl entesiter som daktyliter1,4,5.
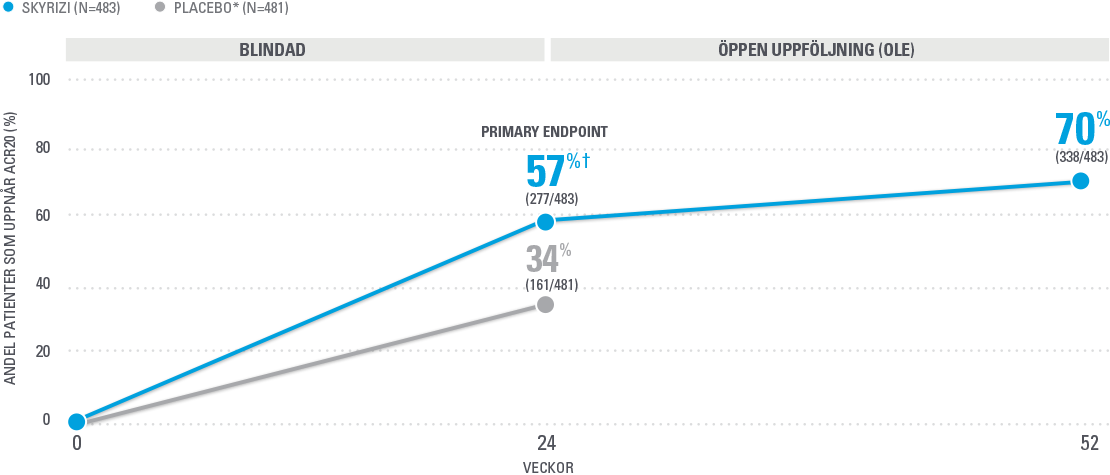
~7 av 10 patienter nådde ACR20 vid vecka 52 (NRI-C)4
Data från KEEPsAKE-1 (alla patienter hade tidigare svarat otillräckligt på, eller uppvisat intolerans mot, icke-biologisk DMARD-behandling. Alla var naiva för biologisk behandling). Analys baserad på fullt data set där NRI-C (Covid anpassad non-responder Imputation) användes för saknad data.
* Från vecka 28 fick alla patienter i studien SKYRIZI var 12e vecka. 76% av patienterna i KEEPsAKE-1 fick samtidig behandling med metotrexat (MTX) eller annan icke-biologisk DMARD.
† P≤0.001
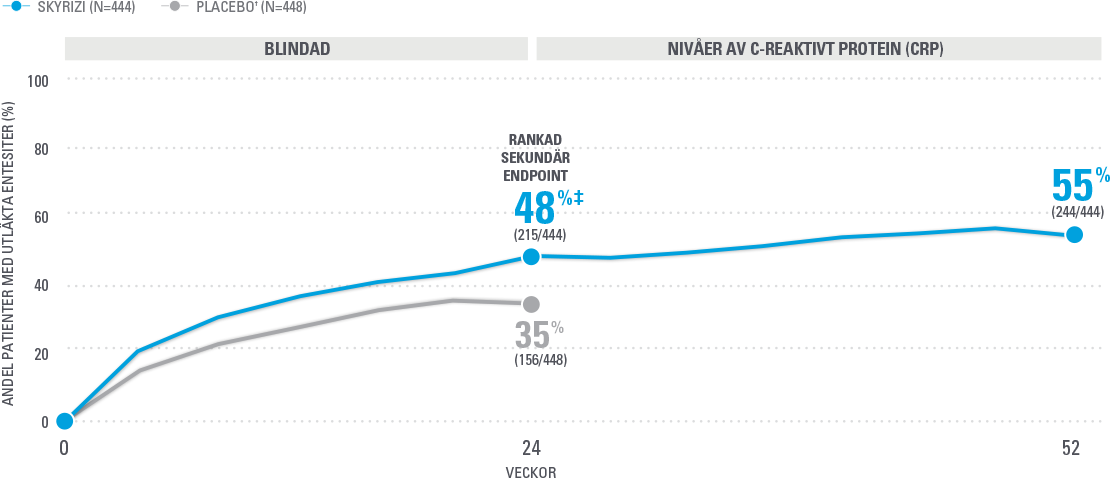
Bibehållen utläkning av entesiter vid vecka 52 (NRI-C)4
Analys baserad på fullt data-set där NRI-C (Covid-anpassad npn-responder imputation) användes för saknad data.
Sammanslagna data från KEEPSAKE1 och KEEPSAKE2. 63 % av patienterna hade entesit vid studiestart. Utläkning definierat som LEI=0 bland patienter med LEI >0 vid baseline.
† Från vecka 28 fick alla patienter i studien SKYRIZI var 12e vecka.
‡ P≤0.001
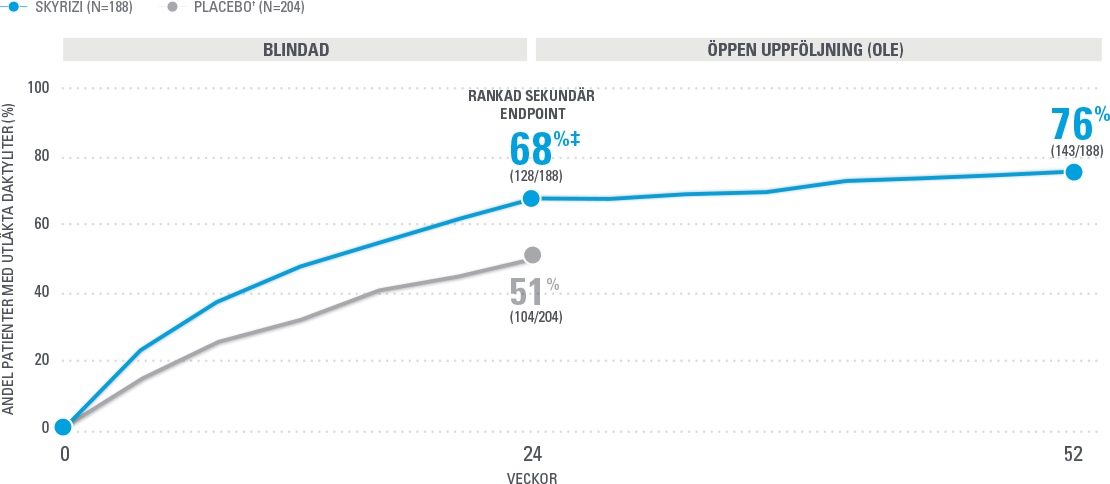
Bibehållen utläkning av daktyliter vid vecka 52 (NRI-C)4
Analys baserad på fullt data-set där NRI-C (Covid-anpassad non-responder imputation) användes för saknad data.
Sammanslagna data från KEEPSAKE1 och KEEPSAKE2. 28 % av patienterna hade daktylit vid studiestart. Utläkning definierat som LDI=0 bland patienter med LDI >0 vid baseline.
† Från vecka 28 fick alla patienter i studien SKYRIZI var 12e vecka.
‡ P≤0.001
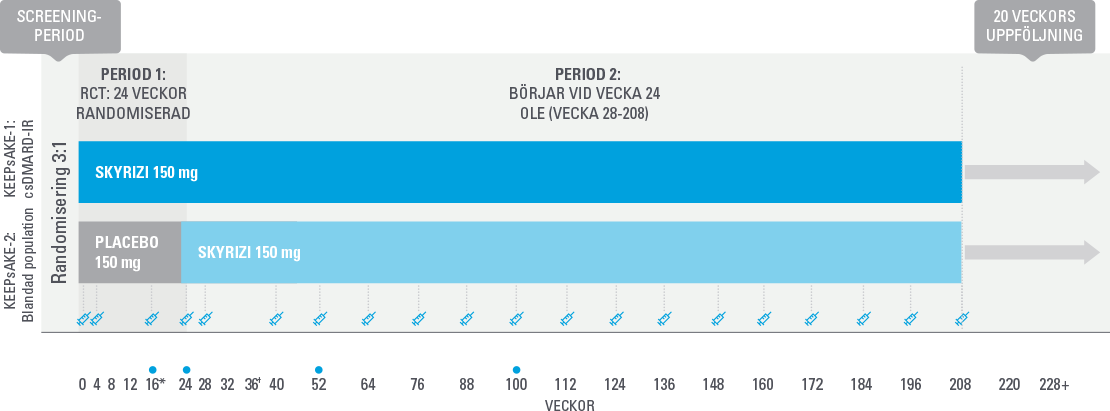
Studiedesign KEEPsAKE 1 och 2
I KEEPSAKE1 hade alla patienter tidigare svarat otillräckligt på, eller uppvisat intolerans mot, icke-biologisk DMARD-behandling och var naiva för biologisk behandling.
I KEEPSAKE2 hade 54 % av patienterna svarat otillräckligt på, eller uppvisat intolerans mot, tidigare icke-biologisk DMARD-behandling och 46 % patienterna hade tidigare svarat otillräckligt på, eller uppvisat intolerans mot, biologisk behandling.
I båda studierna fick 60 % av patienterna samtidig behandling med metotrexat, 12 % fick samtidig behandling med en annan icke-biologisk DMARD och 29 % fick risankizumab som monoterapi.
Primärt effektmått i båda studierna: Andelen patienter som uppnådde ACR20 vid vecka 24. Sekundära effektmått: ACR20 vecka 16; utläkning av entesiter vecka 24 (poolade data); utläkning av daktyliter vecka 24 (poolade data); minimal sjukdomsaktivitet (MDA) vecka 24.
* Vid vecka 16 kunde patienter som klassificerades som non-responders (<20 % förbättring vs baseline avseende antal svullna och/eller ömma leder både vecka 12 och 16) välja att lägga till eller modifiera samtidig rescue medicinering.
† Från vecka 36, avslutades studiemedicineringen för patienter som klassificerades som non-responders.
**SKYRIZI vs ustekinumab, PASI 90 vecka 16: 75 % vs 48 %; vecka 52: 81 % vs 51 %, p<0,001. SKYRIZI vs placebo, PASI 90 vecka 16: 75 % vs 2 %, p<0,001. De vanligaste biverkningarna var övre luftvägsinfektioner, trötthet, huvudvärk, reaktioner vid injektionsstället samt tineainfektioner. En öppen förlängningsstudie av fem fas 2- och 3-studier visar att effekten av SKYRIZI är bestående vid 232 veckors uppföljning och ligger i linje med vad som tidigare visats för PASI 90 och 100 (PASI 90/100 vecka 52: 86%/58%, vecka 232, 85%/52%)2. Säkerhetsuppföljning i upp till 6,9 år (median 3,7 år) omfattande 9983 patientårs behandling med SKYRIZI, visar att behandlingen fortsatt tolereras väl, och att förekomsten av biverkningar inte ökar över tid hos vuxna patienter med måttlig till svår plackpsorias3.
Ŧ ACR20 respons definieras som minst 20 % förbättring av både antalet ömma leder och antalet svullna leder samt minst 20 % förbättring av 3 av följande 5 parametrar: Nivåer av C-reaktivt protein (CRP), Läkarens bedömning av sjukdomsaktivitet, patientens bedömning av sjukdomsaktivitet, skattning av smärtnivå respektive fysisk funktion.
Referenser
- SKYRIZI produktresumé, www.fass.se.
- Papp K, et al. (virtual) EADV 2021, poster 1354.
- Gordon LB, et al. (virtual) EADV 2021, poster 1389.
- Kristensen LE, et al. IFPA's 6th WPPAC 2021, poster 36390.
- Kristensen LE, et al. presentation at the Fall Clin Derm Conf, Oct 2021, Las Vegas.
SKYRIZI® (risankizumab) 150 mg injektionsvätska, lösning i förfylld spruta eller förfylld penna (F), 600 mg koncentrat till infusionsvätska, lösning i injektionsflaska (EF), 360 mg injektionsvätska, lösning i cylinderampull, 1 självhäftande injektor (F), 180 mg injektionsvätska, lösning i cylinderampull, 1 självhäftande injektor (EF), Rx, L04AC18 (interleukinhämmare). Indikationer: Behandling av måttlig till svår plackpsoriasis hos vuxna som behöver systemisk behandling. Behandling, som monoterapi eller i kombination med metotrexat (MTX), av aktiv psoriasisartrit hos vuxna med otillräckligt behandlingssvar på eller intolerans mot ett eller flera sjukdomsmodifierande antireumatiska läkemedel (DMARDs). Behandling av vuxna med måttlig till svår aktiv Crohns sjukdom eller ulcerös kolit med otillräckligt behandlingssvar på, förlorat behandlingssvar eller intolerans mot konventionell behandling eller en biologisk behandling. Kontraindikationer: Överkänslighet mot den aktiva substansen eller mot något hjälpämne; Kliniskt betydelsefulla aktiva infektioner (t ex aktiv tuberkulos). Varningar och försiktighet: Risankizumab kan öka risken för infektion. Anafylaktiska reaktioner har rapporterats vid behandling med risankizumab. Avbryt omedelbart behandling och påbörja lämplig behandling om en allvarlig överkänslighetsreaktion inträffar. Fertilitet, graviditet och amning: Fertila kvinnor ska använda effektiv preventivmetod under pågående behandling och i minst 21 veckor efter avslutad behandling. Risankizumab bör undvikas under graviditet. Det är okänt om risankizumab utsöndras i bröstmjölken, risk-nyttabalansen för modern och barnet måste därför värderas. För ytterligare information samt priser se www.fass.se. Datum för översyn av produktresumé: 29 januari 2025. För information: kontakta AbbVie AB, 08 684 44 600. Begränsning av läkemedelsförmån: SKYRIZI 150 mg subventioneras endast vid plackpsoriasis och psoriasisartrit när behandling med TNF-hämmare gett otillräcklig effekt eller inte är lämplig. SKYRIZI 360 mg subventioneras för patienter som har behandlats med TNF-hämmare eller där detta inte är lämpligt. SKYRIZI 600 mg för intravenös infusion tillhandahålls som rekvisitionsläkemedel. Skyrizi 180 mg, för patienter med ulcerös kolit, ingår ännu inte i läkemedelsförmånen. Tills beslut om subvention är Skyrizi 180 mg tillgängligt via rekvisition.
SE-SKZD-210069_v6. Senast uppdaterad 2025-04-09