Dosering vid psoriasis och psoriasiartrit
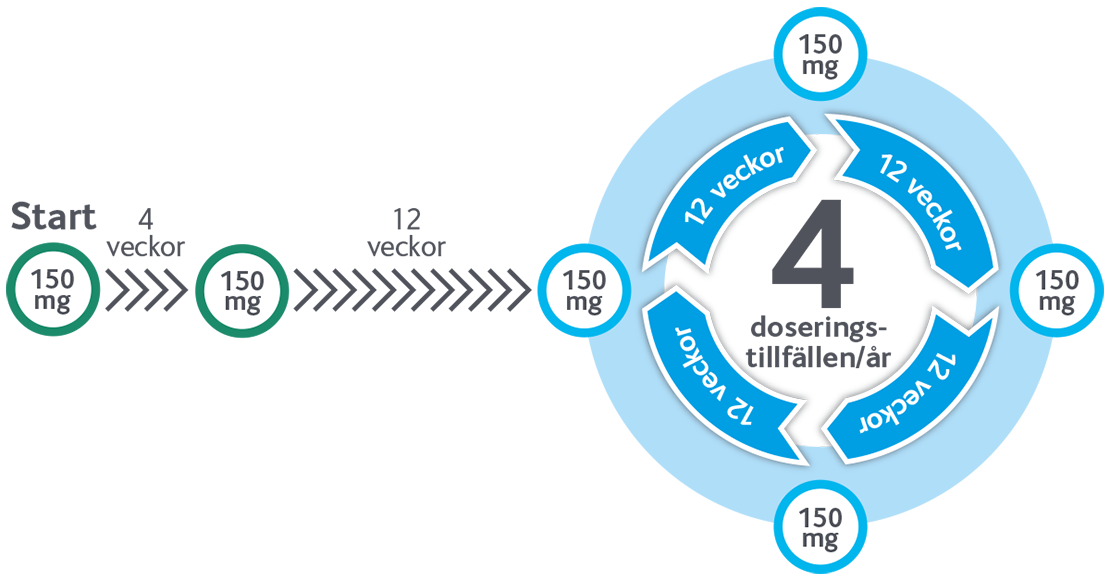
Underhållsbehandling med endast 4 injektioner per år*
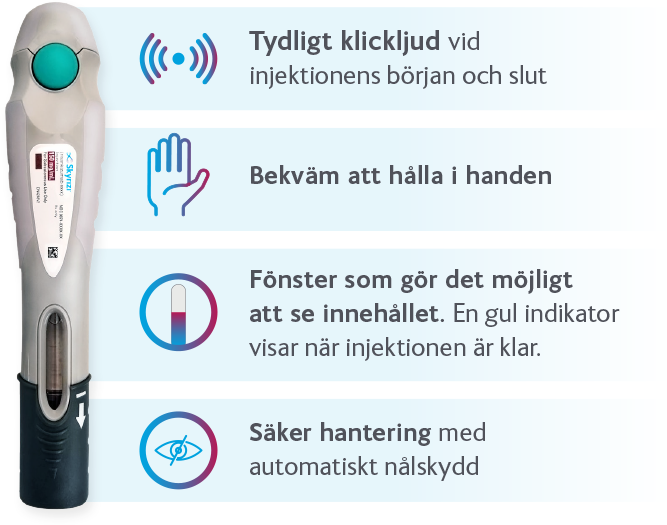
Patienten kan välja mellan att ta SKYRIZI i förfylld spruta eller förfylld penna – med endast en injektion per doseringstillfälle* (150 mg). Patienten behöver därmed bara ta 4 injektioner per år (efter de initiala doserna vecka 0 och 4).
*Den rekommenderade dosen för SKYRIZI är 150 mg som administreras via en subkutan injektion (förfylld penna eller spruta, 150 mg/1 ml) vecka 0, vecka 4 och därefter var 12:e vecka
Enkelhet ger nöjda patienter
Resultaten av en enkät där patienterna fick bedöma sin upplevelse av den förfyllda pennan (Self-Injection Assessment Questionnaire, SIAQ), visade att*:
98% (n=81/83)
var nöjda eller mycket nöjda
98% (n=81/83)
tyckte att pennan var väldigt eller mycket lätt att använda
98% (n=81/83)
ansåg att pennan var bekväm eller mycket bekväm att använda
Patienternas tillfredsställelse med injektionerna uppmättes vid vecka 28 (totalt 4 injektioner) hos patienter som använde SKYRIZI i förfylld penna med hjälp av frågeformuläret SIAQ, ett validerat instrument för att mäta patientens känslor och upplevelser vid självinjektion.
*Data on File, AbbVie Inc.
SKYRIZI doseras 150 mg vecka 0, vecka 4, och därefter var 12:e vecka.
- Endast 4 injektioner per år
- Möjlighet att välja mellan förfylld penna eller förfylld spruta, 150 mg/1 ml
- Samma dos oberoende av patientdemografi och sjukdomskarakteristika samt för psoriasisartrit 1
Referens
- Strober B, et al. JEADV 2020;34:2830–8.
Bra att veta vid insättning av SKYRIZI hos vuxna patienter med psoriasis och psoriasisartrit1.
Den rekommenderade dosen, vid psoriasis och psoriasisartrit, är 150 mg som administreras via subkutan injektion vid vecka 0, vecka 4 och därefter var 12:e vecka.
Bipacksedel på många olika språk återfinns på www.skyrizi.eu
Inga kända interaktioner med andra läkemedel*. SKYRIZI förväntas inte heller påverkas av nedsatt lever- eller njurfunktion.
Behandling med SKYRIZI bör inte påbörjas hos patienter med kliniskt betydelsefulla aktiva infektioner, tex aktiv tuberkulos. Screena med blodprov mot tuberkulos** (tex Quantiferontest), Hepatit B och C samt HIV2.
Kontrollera att vaccination med levande vaccin (tex BCG, gula febern eller vattkoppor) inte skett under de senaste 4 veckorna. Avdödat vaccin är OK.
Som en försiktighetsåtgärd bör man undvika användning av SKYRIZI under graviditet då det inte finns någon eller en begränsad mängd data (färre än 300 graviditeter) från användning av SKYRIZI hos gravida kvinnor. Djurstudier visar dock inga direkta eller indirekta reproduktionstoxikologiska effekter.
Vid byte från annat biologiskt läkemedel kan behandling med SKYRIZI starta när tidigare utsatt läkemedel skulle ha givits (om bytet sker pga otillräcklig effekt)3.
*Säkerhet och effekt i kombination med immunsuppressiva läkemedel, inklusive biologiska läkemedel eller ljusbehandling, har inte utvärderats.
**Vid positivt utfall är fortsatt utredning lämplig och kan innefatta riktad anamnes, PPD-test, lungröntgen och/eller remiss till infektionsklinik2.
Referenser
- SKYRIZI Produktresumé, www.fass.se
- Smith CH, et al. BAD guidelines. Br J Dermatol 2020 Mar 18. doi: 10.1111/bjd.19039.
- Mrowietz U, et al. J Eur Acad Dermatol Venereol 2014;28(4):438–53.
Förpackning och förvaring
SKYRIZI är en klar och färglös till lätt gulaktig vätska i en förfylld penna eller förfylld spruta. Varje förpackning innehåller en förfylld penna eller en förfylld spruta à 150 mg/1 ml.
Detaljerad och uppdaterad information om denna produkt finns tillgänglig genom att scanna QR-koden i ytterförpackningen med en smartphone. Samma information finns även på www.skyrizi.eu
SKYRIZI ska förvaras i kylskåp (2 °C–8 °C) i sin ytterförpackning. SKYRIZI får ej frysas och är känsligt för ljus.
SKYRIZI kan förvaras utanför kylskåp (högst 25 °C) i upp till sammanlagt 24 timmar, i sin ytterförpackning för att skydda mot ljus.
SKYRIZI ska inte användas om lösningen är grumlig, innehåller flagor eller stora partiklar.
SKYRIZI® (risankizumab) 150 mg injektionsvätska, lösning i förfylld spruta eller förfylld penna (F), 600 mg koncentrat till infusionsvätska, lösning i injektionsflaska (EF), 360 mg injektionsvätska, lösning i cylinderampull, 1 självhäftande injektor (F), 180 mg injektionsvätska, lösning i cylinderampull, 1 självhäftande injektor (EF), Rx, L04AC18 (interleukinhämmare).
Indikationer: Behandling av måttlig till svår plackpsoriasis hos vuxna som behöver systemisk behandling. Behandling, som monoterapi eller i kombination med metotrexat (MTX), av aktiv psoriasisartrit hos vuxna med otillräckligt behandlingssvar på eller intolerans mot ett eller flera sjukdomsmodifierande antireumatiska läkemedel (DMARDs). Behandling av vuxna med måttlig till svår aktiv Crohns sjukdom eller ulcerös kolit med otillräckligt behandlingssvar på, förlorat behandlingssvar eller intolerans mot konventionell behandling eller en biologisk behandling.
Kontraindikationer: Överkänslighet mot den aktiva substansen eller mot något hjälpämne; Kliniskt betydelsefulla aktiva infektioner (t ex aktiv tuberkulos).
Varningar och försiktighet: Risankizumab kan öka risken för infektion. Anafylaktiska reaktioner har rapporterats vid behandling med risankizumab. Avbryt omedelbart behandling och påbörja lämplig behandling om en allvarlig överkänslighetsreaktion inträffar. Fertilitet, graviditet och amning: Fertila kvinnor ska använda effektiv preventivmetod under pågående behandling och i minst 21 veckor efter avslutad behandling. Risankizumab bör undvikas under graviditet. Det är okänt om risankizumab utsöndras i bröstmjölken, risk-nyttabalansen för modern och barnet måste därför värderas. För ytterligare information samt priser se www.fass.se.
Datum för översyn av produktresumé: 14 oktober 2025.
För information: kontakta AbbVie AB, 08 684 44 600.
Begränsning av läkemedelsförmån: SKYRIZI 150 mg subventioneras endast vid plackpsoriasis och psoriasisartrit när behandling med TNF-hämmare gett otillräcklig effekt eller inte är lämplig. SKYRIZI 360 mg subventioneras för patienter som har behandlats med TNF-hämmare eller där detta inte är lämpligt. SKYRIZI 600 mg för intravenös infusion tillhandahålls som rekvisitionsläkemedel. SKYRIZI 180 mg, för patienter med ulcerös kolit, tillhandahålls som rekvisitionsläkemedel.
SE-SKZD-260002
SE-SKZD-210069_v6. Senast uppdaterad 2025-04-09