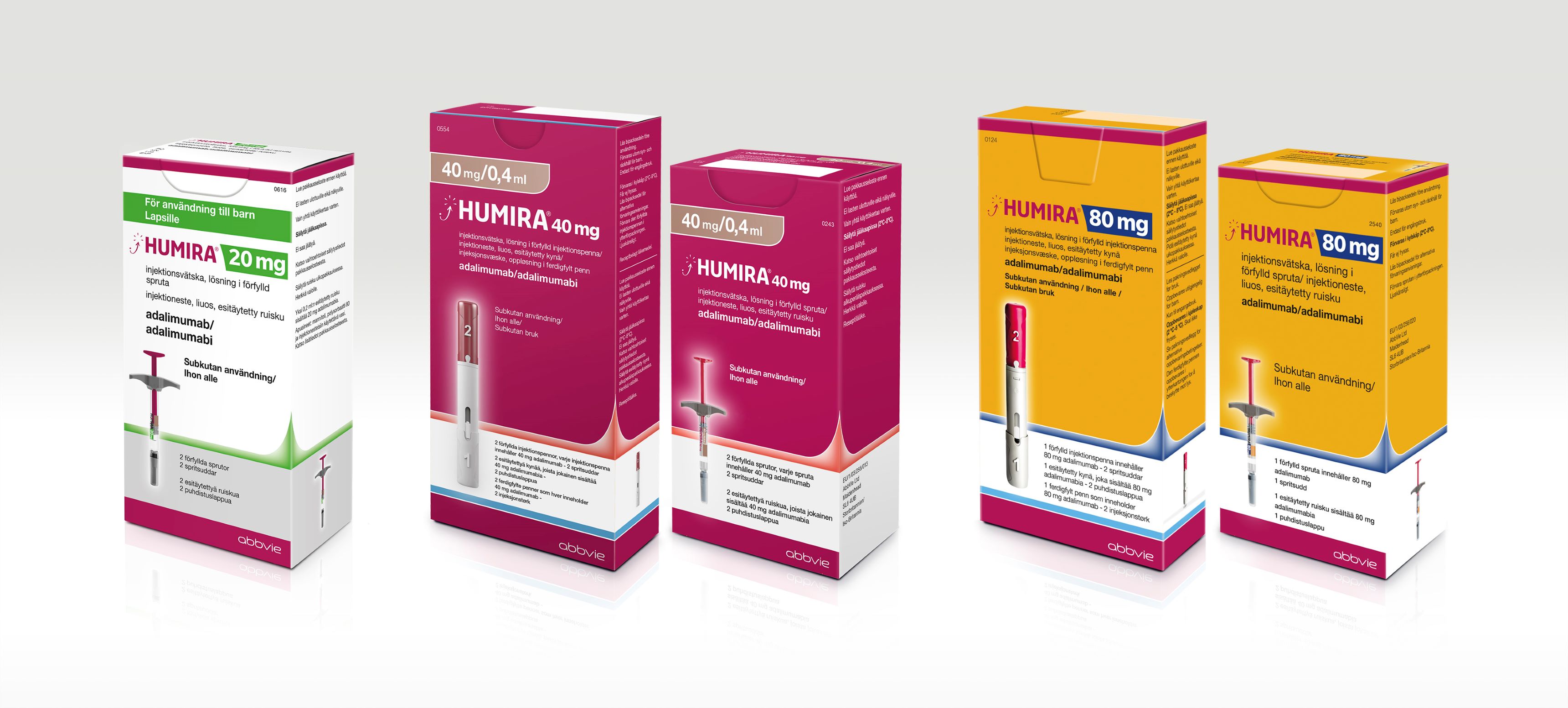
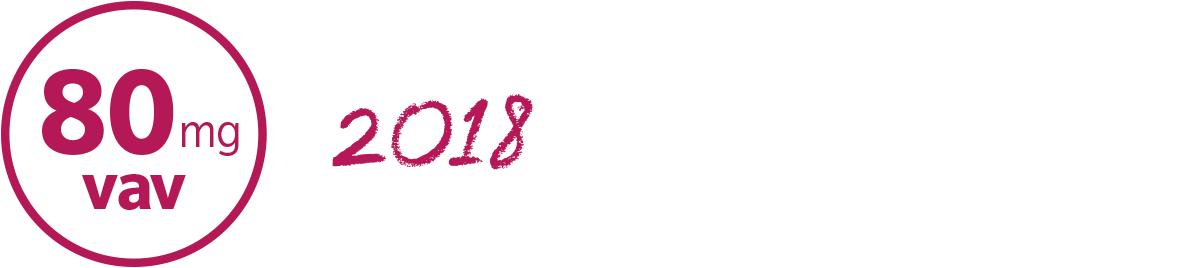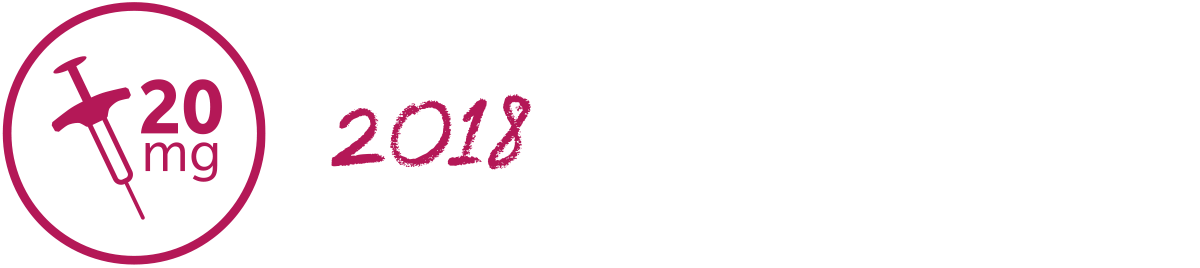HUMIRA® (adalimumab) – human citratfri TNF-hämmare med tre olika styrkor
År 2003 blev det biologiska läkemedlet HUMIRA den första helt humana TNF-hämmaren som registrerades i Sverige. Sedan dess har AbbVie drivit ett kontinuerligt utvecklingsarbete i syfte att förbättra behandlingen för människor som lever med inflammatoriska sjukdomar. Idag är HUMIRA godkänt för behandling av 16 olika indikationer och finns i tre olika styrkor (20 mg/0,2 ml, 40 mg/0,4 ml, 80 mg/0,8 ml).
Kontinuerligt utvecklingsarbete
Under åren har vi presenterat en rad olika åtgärder för att förbättra patientens upplevelse av sin behandling.
HUMIRA godkänns och blir den första helt humana TNF-hämmaren i förfylld spruta
När HUMIRA godkänns för sin första indikation, reumatoid artrit (RA), är det i en förfylld spruta.
Injektionspennan lanseras
För att ytterligare förenkla injektionen för patienten kommer HUMIRA som injektionspenna.
Tunnare nål, latexfri spruta/penna och två veckors förvaring i rumstemperatur
Nästa steg i utvecklingen är att både sprutor och pennor blir helt fria från latex, att nålen görs om och blir tunnare, 29 G. Det blir också möjligt att förvara HUMIRA två veckor i rumstemperatur (högst 25°C).
HUMIRA 40 mg/0,4 ml – citratfri formulering och halverad injektionsvolym
Hösten 2016 kom HUMIRA i en citratfri formulering. Formuleringen innehåller samma mängd verksam substans som den gamla. Skillnaden består i att en rad hjälpämnen, däribland citrat, kunnat uteslutas vilket gjort det möjligt att halvera lösningsvolymen.
Tidigare formulering HUMIRA 40 mg/0,8 ml:
• Adalimumab
• Mannitol
• Polysorbat 80
• Vatten för injektionsvätskor
• Citronsyramonohydrat
• Natriumcitrat
• Natriumdivätefosfatdihydrat
• Dinatriumfosfatdihydrat
• Natriumklorid
• Natriumhydroxid
Nuvarande formulering HUMIRA 40 mg/0,4 ml:
• Adalimumab
• Mannitol
• Polysorbat 80
• Vatten för injektionsvätskor
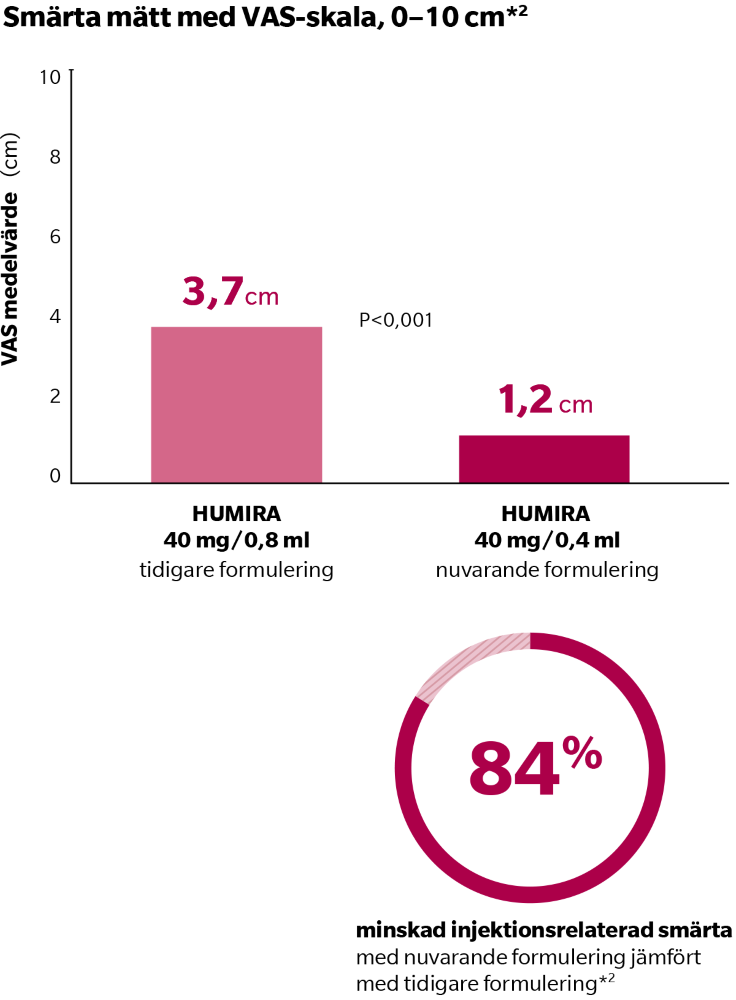
En poolad analys av två studier med vardera drygt 60 patienter över 18 år med reumatoid artrit, visade en statistiskt signifikant skillnad för smärta vid injektionsstället direkt efter dosering mellan den tidigare formuleringen HUMIRA 40 mg/0,8 ml och den nuvarande citratfria formuleringen HUMIRA 40 mg/0,4 ml.1,2
Patienterna i studierna var antingen bionaiva eller användare av den tidigare formuleringen HUMIRA 40 mg/0,8 ml. Den senare gruppen av patienter hade betygsatt sin genomsnittliga smärta vid injektionsstället under den senaste månaden som 3 eller mer på en visuell analog smärtskala (VAS-skala 0–10 cm). Patienterna hade fått sex eller fler på varandra följande doser av HUMIRA före screening. Den tidigare formuleringen injicerades via en förfylld spruta med en 27-gauge nål och den nuvarande injicerades via en förfylld spruta med en 29-gauge nål, som har ett latexfritt nålskydd och en belagd kolv för att minimera urlakning. Studierna visade ett genomsnittligt VAS på 3,7 cm med den tidigare formuleringen jämfört med 1,2 cm med den nuvarande formuleringen, på en skala av 0–10 cm, P <0,001. Detta representerar ett medianvärde på 84% minskning av smärta vid injektionsstället.1,2
*Hos vuxna patienter i två poolade RA-studier mätt omedelbart efter injektion, HUMIRA 40 mg/0,4 ml jämfört med HUMIRA 40 mg/0,8 ml. Patienterna i studierna var antingen bionaiva eller användare av den tidigare formuleringen HUMIRA 40 mg/0,8 ml. Den senare gruppen av patienter hade betygsatt sin genomsnittliga smärta vid injektionsstället under den senaste månaden som 3 eller mer på en visuell analog smärtskala (VAS-skala 0–10 cm). Patienterna hade fått sex eller fler på varandra följande doser av HUMIRA före screening. Den tidigare formuleringen injicerades via en förfylld spruta med en 27-gauge nål och den nuvarande injicerades via en förfylld spruta med en 29-gauge nål, som har ett latexfritt nålskydd och en belagd kolv för att minimera urlakning.
HUMIRA 80 mg/0,8 ml – halverar antalet injektioner vid induktionsbehandling
Hösten 2017 kom HUMIRA injektionspenna och förfylld spruta i styrkan 80 mg/0,8 ml med samma citratfria formulering som HUMIRA 40 ml/0,4 ml. HUMIRA 80 mg/0,8 ml gör det möjligt att halvera antalet injektioner vid induktionsbehandling.
HUMIRA 80 mg varannan vecka – alternativ underhållsdosering
Med HUMIRA 80 mg blir det möjligt att minska antalet injektionstillfällen för patienten. För patienter som behöver gå upp i dos från HUMIRA 40 mg varannan vecka till 40 mg varje vecka, innebär HUMIRA 80 mg dessutom en möjlighet att behålla nuvarande doseringsintervall.
HUMIRA 20 mg/0,2 ml – förfylld spruta för mindre barn*
Våren 2018 blev HUMIRA 20 mg/0,2 ml förfylld spruta tillgänglig för förskrivning. Sprutan innehåller samma citratfria formulering som övriga styrkor. Det innebär att även mindre barn* kan erbjudas en citratfri formulering.
* Barn med följande kroppsvikt: pJIA 10–<30 kg; ERA och ped PS 15–<30 kg; ped UV <30 kg; ped CD <40 kg.
20 års erfarenhet från kliniska studier, väldokumenterad säkerhetsprofil
Publicerad säkerhetsanalys baserad på 78 kliniska studier med över 29 000 patienter
HUMIRA har en välkänd och väldokumenterad säkerhetsprofil, med en säkerhetsanalys baserad på 78 kliniska studier med över 29 000 patienter och 36 000 patientår inom nio indikationer. I säkerhetsanalysen fann man inga oväntade eller nya säkerhetssignaler och ingen högre incidens av icke-melanom hudcancer, lymfom, andra cancerformer eller allvarliga infektioner som krävde sjukhusvård.3
I en interimanalys efter 7 år av ESPRIT-registret (n=6051), där patienter på godkänd dosering med HUMIRA följs i tio år, var incidensen av allvarliga biverkningar, allvarliga infektioner och maligniteter 4,4, 1,0 respektive 1,0 händelser per 100 patientår. Detta är i linje med tidigare rapporterad data från kliniska studier.4
Biverkningar
Precis som alla läkemedel kan HUMIRA ge biverkningar. De vanligaste är ofarliga och övergående, men allvarliga biverkningar kan förekomma. I början av behandlingen kan huden bli lite röd och svullen på injektionsstället. Det är normalt och ingenting farligt. Vanligtvis går svullnaden över inom ett par dagar. Under behandlingen kan en förkylning lättare uppstå och vid en allvarlig infektion ska inte HUMIRA tas.
Graviditet och amning
Under den kontinuerliga utvecklingen av HUMIRA står säkerheten och användarvänligheten alltid i fokus. Det senaste steget i detta arbete är en uppdaterad FASS-text för användning av HUMIRA hos kvinnor i fertil ålder samt under graviditet och amning.
För patienterna innebär det att HUMIRA nu kan användas under graviditet om det finns ett uttalat behov, samt att HUMIRA kan användas under amning*.
*Administrering av levande vaccin (t ex BCG-vaccin och rotavirusvaccin) till nyfödda som har exponerats för HUMIRA i livmodern, rekommenderas inte under 5 månader efter moderns sista HUMIRA-injektion under sin graviditet.
15 godkända indikationer
HUMIRA har 15 godkända indikationer inom reumatologi, gastroenterologi, dermatologi samt oftalmologi, varav 6 pediatriska1.
De olika indikationerna har olika doseringar. För mer information se fass.se
Referenser
1. HUMIRA produktresumé, www.fass.se.
2. Nash P, et al. Rheumatol Ther 2016;3:257–270.
3. Burmester GR, et al. Abstract OP0233 presenterad på Annual European Congress of
Rheumatology, 13-16 juni, 2018, Amsterdam, Holland.
4. Menter A et al. Dermatol Ther 2017;7:365-81.
HUMIRA®, (adalimumab), Rx, F, L04AB04 (TNF-alfa-hämmare), SPC 2024-07-11. Indikationsområden: Måttlig till svår (inkl. svår progredierande), aktiv reumatoid artrit hos vuxna som har svarat otillräckligt på sjukdomsmodifierande antireumatiska läkemedel (DMARDs). Aktiv polyartikulär juvenil idiopatisk artrit hos patienter från 2 års ålder, som har svarat otillräckligt på en eller flera sjukdomsmodifierande antireumatiska läkemedel (DMARDs). Aktiv entesitrelaterad artrit hos patienter, 6 år och äldre, som har svarat otillräckligt på eller som inte tolererar konventionell terapi. Svår, aktiv ankyloserande spondylit (AS) hos vuxna som inte svarat tillfredsställande på konventionell behandling. Behandling av vuxna med allvarlig axial spondylartrit utan radiografiska tecken på AS men med tydliga tecken på inflammation via förhöjt CRP och/eller MR, som inte har svarat tillräckligt på icke-steroida antiinflammatoriska läkemedel. Aktiv och progredierande psoriasisartrit hos vuxna när andra sjukdomsmodifierande antireumatiska läkemedel inte haft tillräcklig effekt. Måttlig till svår, kronisk plackpsoriasis hos vuxna patienter som är aktuella för systemisk behandling. Svår, kronisk plackpsoriasis hos barn och ungdomar från 4 års ålder som inte har svarat på eller som är olämpliga för topikal behandling och ljusbehandling. Måttlig till svår, aktiv hidradenitis suppurativa (HS, acne inversa) hos vuxna patienter och ungdomar från 12 år som inte har svarat på konventionell systemisk HS-behandling. Måttlig till svår, aktiv Crohns sjukdom hos vuxna patienter som inte svarat trots fullständig och adekvat konventionell behandling. Måttlig till svår, aktiv Crohns sjukdom hos pediatriska patienter, från 6 års ålder, som inte har svarat på konventionell terapi inklusive primär nutritionsterapi och en kortikosteroid och/eller en immunomodulerare. Måttlig till svår, aktiv ulcerös kolit hos vuxna patienter som svarat otillfredsställande på konventionell behandling. Måttlig till svår aktiv ulcerös kolit hos pediatriska patienter, från 6 års ålder, som svarat otillfredsställande på konventionell behandling. Icke-infektiös intermediär, bakre och panuveit hos vuxna patienter som svarat otillräckligt på kortikosteroider, hos patienter som behöver kortikosteroidsparande behandling eller hos patienter där kortikosteroidbehandling inte är lämpligt. Pediatrisk icke-infektiös kronisk främre uveit hos patienter från 2 års ålder som inte har svarat tillräckligt eller som inte tolererar konventionell behandling eller där konventionell behandling inte är lämpligt. Fertilitet och graviditet: Kvinnor i fertil ålder ska överväga att använda adekvat preventivmetod för att undvika graviditet och fortsätta använda detta i minst fem månader efter den sista behandlingen med HUMIRA. Beroende på sin hämning av TNFa, kan HUMIRA som administreras under graviditet påverka normalt immunsvar hos den nyfödda. HUMIRA ska endast användas under graviditet om det finns ett uttalat behov. HUMIRA finns som förfylld injektionsspruta 20 mg, förfylld injektionspenna/-spruta 40 mg och förfylld injektionspenna 80 mg. För fullständig information om indikationer, kontraindikationer, varningar och försiktighet, biverkningar, pris och dosering, se Fass.se.
SE-HUM-230001 v 3.0 Senast uppdaterad 2024-10-01