Ρευματοειδής αρθρίτιδα
Το RINVOQ ενδείκνυται για τη θεραπεία της μέτριας έως σοβαρής ενεργού ρευματοειδούς αρθρίτιδας σε ενήλικες ασθενείς, οι οποίοι έχουν ανταποκριθεί ανεπαρκώς σε, ή οι οποίοι εμφανίζουν δυσανεξία σε ένα ή περισσότερα τροποποιητικά της νόσου αντιρευματικά φάρμακα (DMARDs). Το RINVOQ μπορεί να χρησιμοποιηθεί ως μονοθεραπεία ή σε συνδυασμό με μεθοτρεξάτη.
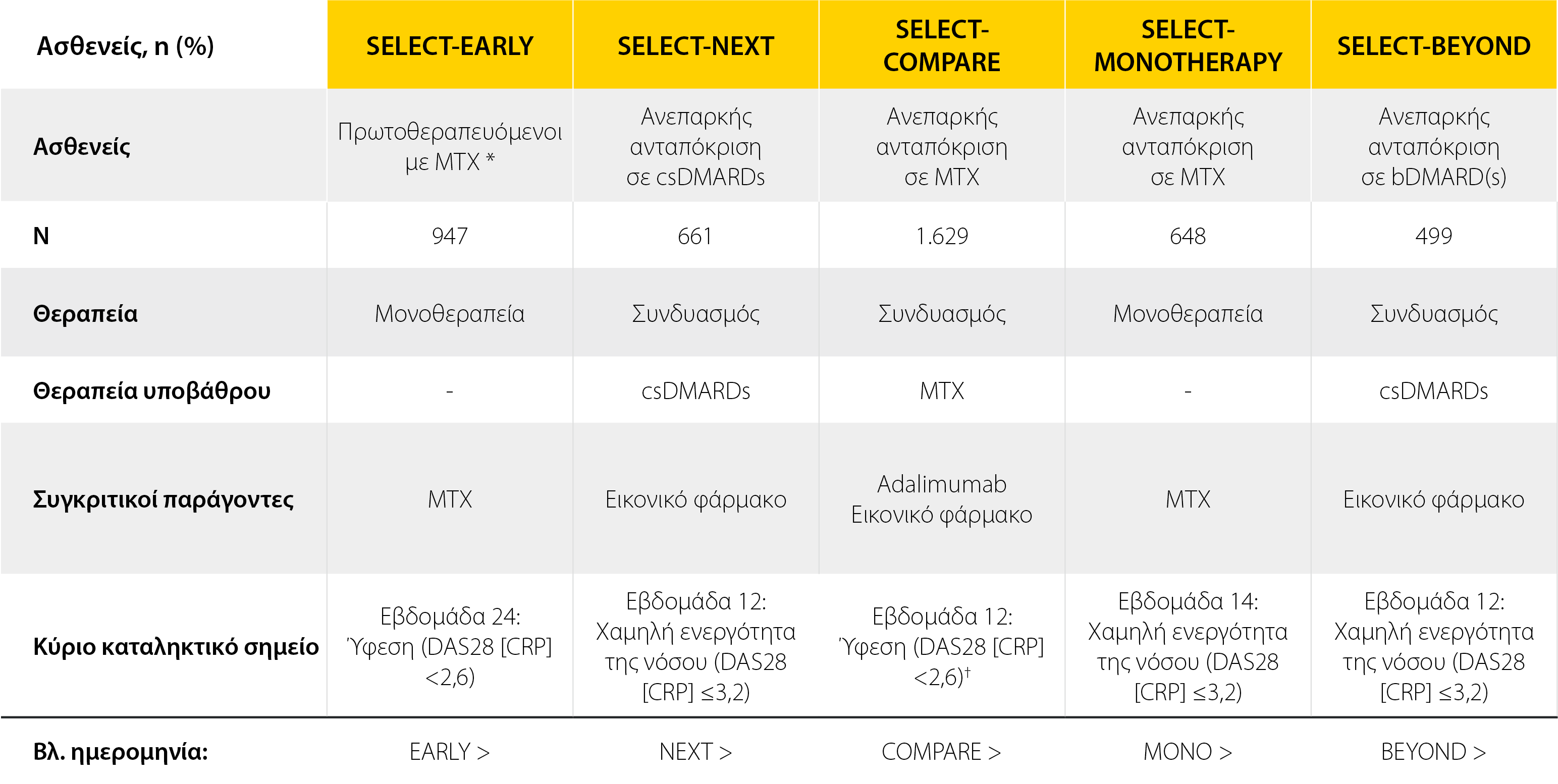
Το κλινικό πρόγραμμα του RINVOQ®1
Το RINVOQ® επέδειξε συνεπή ποσοστά κλινικής ύφεσης μεταξύ των πληθυσμών ασθενών που μελετήθηκαν1
*Το RINVOQ® δεν ενδείκνυται για τους πρωτοθεραπευόμενους με MTX ασθενείς.
†Κύριο καταληκτικό σημείο: κλινική ύφεση (DAS28 [CRP]<2,6) συγκριτικά με το εικονικό φάρμακο.
bDMARD: βιολογικό τροποποιητικό της νόσου αντιρευματικό φάρμακο, csDMARD-IR: ανεπαρκώς ανταποκριθείς σε συμβατικό συνθετικό τροποποιητικό της νόσου αντιρευματικό φάρμακο, DAS28 (CRP): Βαθμολογία Ενεργότητας της Νόσου σε 28 αρθρώσεις, (C-αντιδρώσα πρωτεΐνη), DMARD: τροποποιητικό της νόσου αντιρευματικό φάρμακο, MTX: μεθοτρεξάτη.
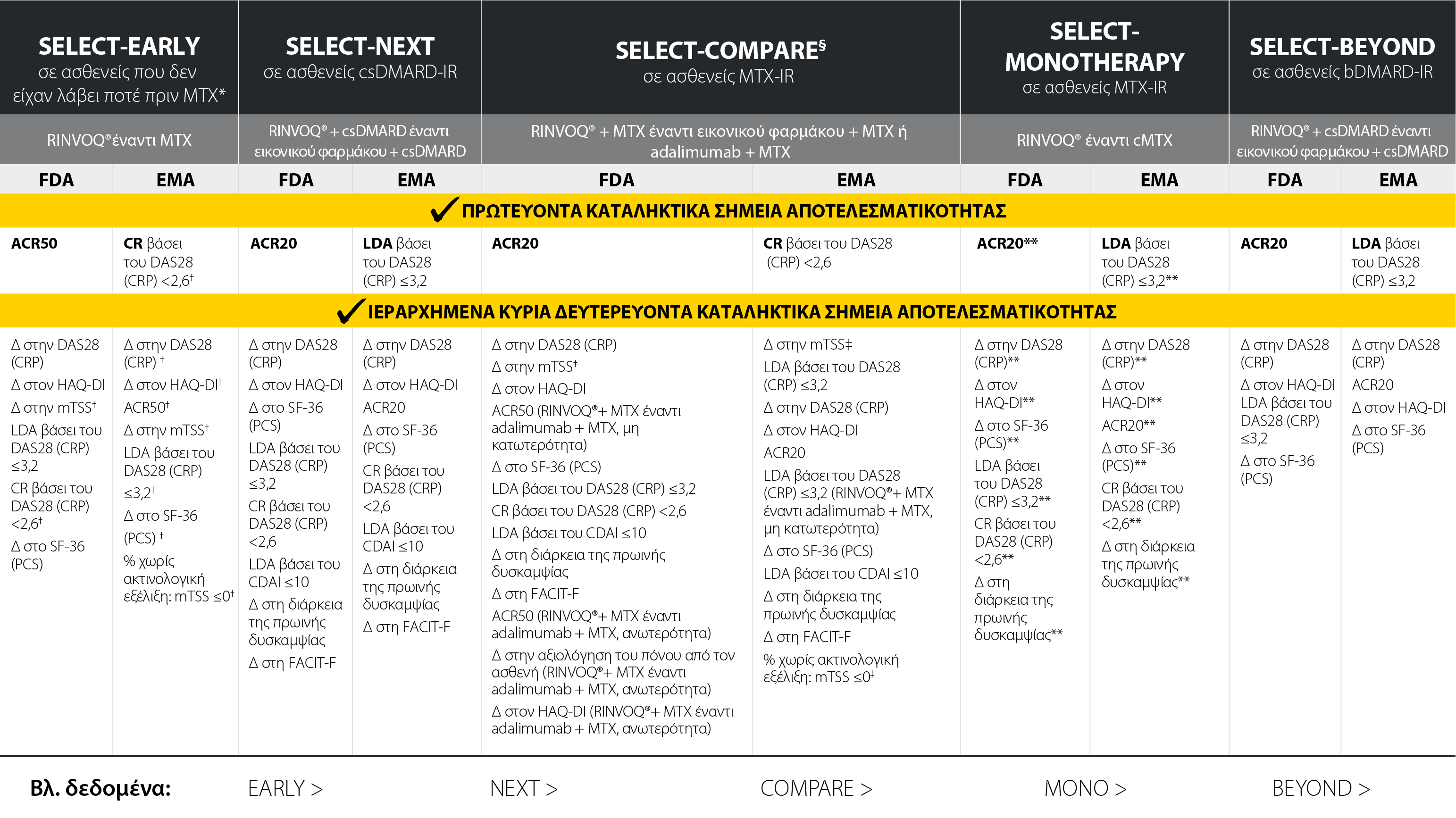
Το RINVOQ® πέτυχε κάθε κύριο και δευτερεύον ιεραρχημένο καταληκτικό σημείο στις φάσεις III εγκριτικές μελέτες του1-6
Καταληκτικά σημεία όλων των μελετών
Το RINVOQ® δεν ενδείκνυται για πρωτοθεραπευόμενους με MTX ασθενείς. Όλα τα κύρια και τα ιεραρχημένα δευτερεύοντα καταληκτικά σημεία υποβλήθηκαν σε έλεγχο πολλαπλότητας και πληρούσαν τη στατιστική σημασία την οποία υποδηλώνει η τιμή P-≤0,05. Όλα τα καταληκτικά σημεία εκτιμήθηκαν την εβδομάδα 12, εκτός εάν αναφέρεται διαφορετικά:
*Εκτίμηση την εβδομάδα 14.
†Εκτίμηση την εβδομάδα 24.
‡Εκτίμηση την εβδομάδα 26.
§Στη μελέτη SELECT-COMPARE, όλες οι συγκρίσεις αφορούσαν το σχήμα RINVOQ® + MTX συγκριτικά με το εικονικό φάρμακο + MTX, εκτός εάν αναφέρεται διαφορετικά.
ACR20/50: Αμερικανικό Κολλέγιο Ρευματολογίας ≥20% ή ≥50% βελτίωση, CDAI: Δείκτης Κλινικής Ενεργότητας της Νόσου, CR: κλινική ύφεση, CRP: C-αντιδρώσα πρωτεΐνη, csDMARD: συμβατικό συνθετικό τροποποιητικό της νόσου αντιρευματικό φάρμακο, DAS28 (CRP): Βαθμολογία Ενεργότητας της Νόσου σε 28 αρθρώσεις, (C-αντιδρώσα πρωτεΐνη), EMA: Ευρωπαϊκός Οργανισμός Φαρμάκων, FACIT-F: Βαθμολογία του ερωτηματολογίου ΛειτουργικήςΑξιολόγησης της Θεραπείας της Χρόνιας Νόσου – κοπώσεως, FDA: Αμερικανικός Οργανισμός Τροφίμων και Φαρμάκων, HAQ-DI: Ερωτηματολόγιο Εκτίμησης Υγείας - Δείκτης Αναπηρίας, LDA: χαμηλή ενεργότητα της νόσου, mTSS: τροποποιημένη Συνολική Βαθμολογία Sharp, MTX: μεθοτρεξάτη, PCS: Βαθμολογία Σωματικής Συνιστώσας, SF-36: Σύντομο Έντυπο (36 Στοιχείων) Έρευνας Υγείας.
References
- RINVOQ® Περίληψη Χαρακτηριστικών Προϊόντος, 12-2023
- Fleischmann R, Pangan AL, Song IH, et al. Upadacitinib versus placebo or adalimumab in patients with rheumatoid arthritis and an inadequate response to methotrexate: results of a phase 3, double-blind, randomized controlled trial [published online July 9, 2019]. Arthritis Rheumatol. doi:10.1002/art.41032
- Smolen JS, Pangan AL, Emery P, et al. Upadacitinib as monotherapy in patients with active rheumatoid arthritis and inadequate response to methotrexate (SELECT-MONOTHERAPY): a randomised, placebo-controlled, double-blind phase 3 study. Lancet. 2019;393(10188):2303-2311. doi:10.1016/S0140-6736(19)30419-2
- Van Vollenhoven, R, Takeuchi, T, Pangan, A.L, et al. Efficacy and safety of Upadacitinib monotherapy in methotrexate-naive patients with moderatelyto-severely active rheumatoid arthritis (SELECT-EARLY): a multicenter, multiCountry, randomized, double-blind, active comparator-controlled trial. Arthritis Rheumatol. 72:1607-1620. doi:10.1002/art.41384.
- Burmester GR, Kremer JM, Van den Bosch F, et al. Safety and efficacy of upadacitinib in patients with rheumatoid arthritis and inadequate response to conventional synthetic disease-modifying anti-rheumatic drugs (SELECT-NEXT): a randomised, double-blind, placebo-controlled phase 3 trial. Lancet. 2018;391(10139):2503-2512. doi:10.1016/S0140-6736(18)31115-2
- Genovese MC, Fleischmann R, Combe B, et al. Safety and efficacy of upadacitinib in patients with active rheumatoid arthritis refractory to biologic disease-modifying anti-rheumatic drugs (SELECT-BEYOND): a double-blind, randomised controlled phase 3 trial. Lancet. 2018;391(10139):2513-2524. doi:10.1016/S0140- 6736(18)31116-4