Ρευματοειδής αρθρίτιδα
Το RINVOQ ενδείκνυται για τη θεραπεία της μέτριας έως σοβαρής ενεργού ρευματοειδούς αρθρίτιδας σε ενήλικες ασθενείς, οι οποίοι έχουν ανταποκριθεί ανεπαρκώς σε, ή οι οποίοι εμφανίζουν δυσανεξία σε ένα ή περισσότερα τροποποιητικά της νόσου αντιρευματικά φάρμακα (DMARDs). Το RINVOQ μπορεί να χρησιμοποιηθεί ως μονοθεραπεία ή σε συνδυασμό με μεθοτρεξάτη.
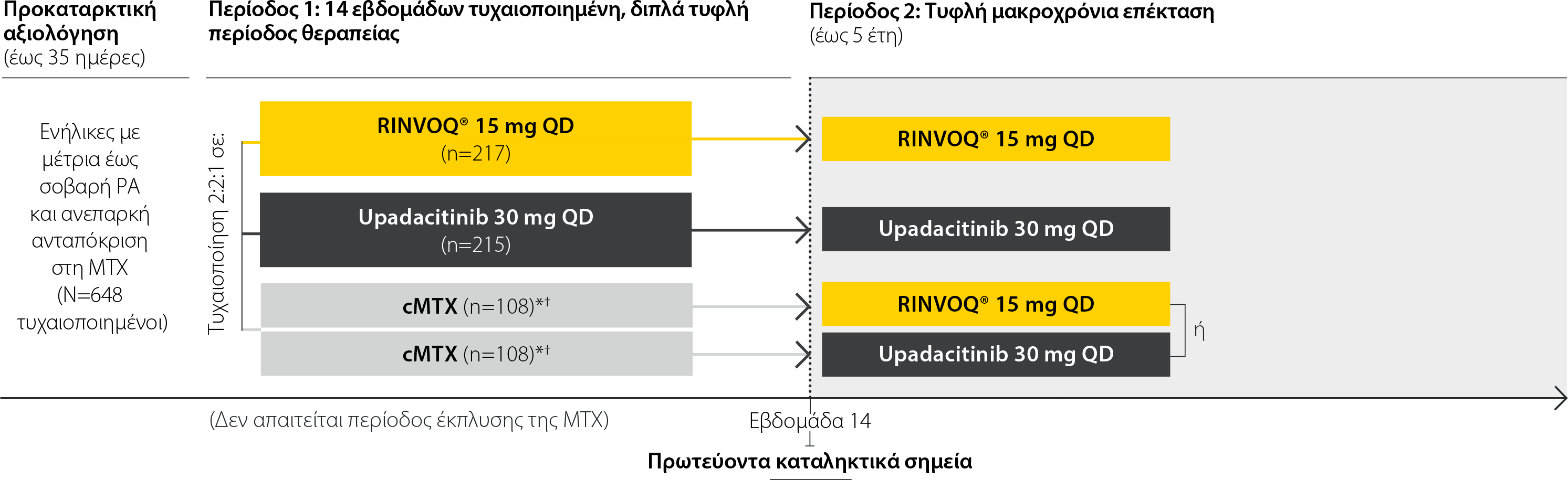
SELECT-MONOTHERAPY: Σχεδιασμός μελέτης
Μια μελέτη φάσης 3 για τη διερεύνηση της αποτελεσματικότητας και της ασφάλειας της μονοθεραπείας με RINVOQ® μετά τη μετάβαση από θεραπεία με ΜΤΧ σε σύγκριση με cMTX για την αντιμετώπιση της μέτριας έως σοβαρής ΡΑ σε ασθενείς με ανεπαρκή ανταπόκριση στη ΜΤΧ 2
*Για την κύρια ανάλυση την εβδομάδα 14, πραγματοποιήθηκαν συγκρίσεις της δόσης του RINVOQ® 15 mg και του upadacitinib 30 mg έναντι της cMTX, συνδυάζοντας δεδομένα από τις δύο ομάδες της cMTX.
†Από την εβδομάδα 14, οι ασθενείς που αρχικά τυχαιοποιήθηκαν σε cMTX κατά την έναρξη, μεταπήδησαν σε θεραπεία με RINVOQ® 15 mg ή upadacitinib 30 mg σύμφωνα με την προκαθορισμένη αντιστοίχιση της τυχαιοποίησης.
Κύρια
RINVOQ® 15 mg και upadacitinib 30 mg έναντι cMTX την εβδομάδα 14 για DAS28 (CRP) <3,2 (EMA) ή ACR20 (FDA)
Ασφάλεια
Ανεπιθύμητες ενέργειες, σοβαρές ανεπιθύμητες ενέργειες, ανεπιθύμητες ενέργειες ειδικού ενδιαφέροντος (π.χ., σοβαρές λοιμώξεις, ευκαιριακές λοιμώξεις, MACE, VTE, κακοήθειες)
- Ασθενείς ηλικίας ≥18 ετών μπορούσαν να συμμετέχουν.
- Διάγνωση ΡΑ ≥3 μηνών σύμφωνα με τα κριτήρια ταξινόμησης των ACR/EULAR 2010 για τη ΡΑ με ενεργό νόσο (τουλάχιστον 6 διογκωμένες αρθρώσεις από τις 66, τουλάχιστον 6 ευαίσθητες αρθρώσεις από τις 68, και hsCRP πάνω από 3 mg/L).
- Οι ασθενείς έπρεπε να είχαν ανεπαρκή ανταπόκριση στη ΜΤΧ.
- Χωρίς προηγούμενη έκθεση σε αναστολέα JAK ή bDMARD.
Η εγκεκριμένη δόση του RINVOQ είναι 15 mg μία φορά την ημέρα. Το upadacitinib 30 mg QD δεν αποτελεί εγκεκριμένη δόση.
ACR: Αμερικανικό Κολλέγιο Ρευματολογίας, ACR20: βελτίωση τουλάχιστον 20% στα βασικά κριτήρια του Αμερικανικού Κολλεγίου Ρευματολογίας, bDMARD: βιολογικό τροποποιητικό της νόσου αντιρευματικό φάρμακο, cMTX: συνεχής θεραπεία με μεθοτρεξάτη, DAS28 (CRP): Βαθμολογία Ενεργότητας της Νόσου σε 28 αρθρώσεις (C-αντιδρώσα πρωτεΐνη), EMA: Ευρωπαϊκός Οργανισμός Φαρμάκων, EULAR: Ευρωπαϊκή Εταιρεία κατά του Ρευματισμού, FDA: Αμερικανικός Οργανισμός Τροφίμων και Φαρμάκων, hsCRP: υψηλής ευαισθησίας C-αντιδρώσα πρωτεΐνη, JAK: κινάση Janus, MACE: Μείζον ανεπιθύμητο καρδιαγγειακό συμβάν, MTX: μεθοτρεξάτη, QD: άπαξ ημερησίως, VTE: φλεβική θρομβοεμβολή.
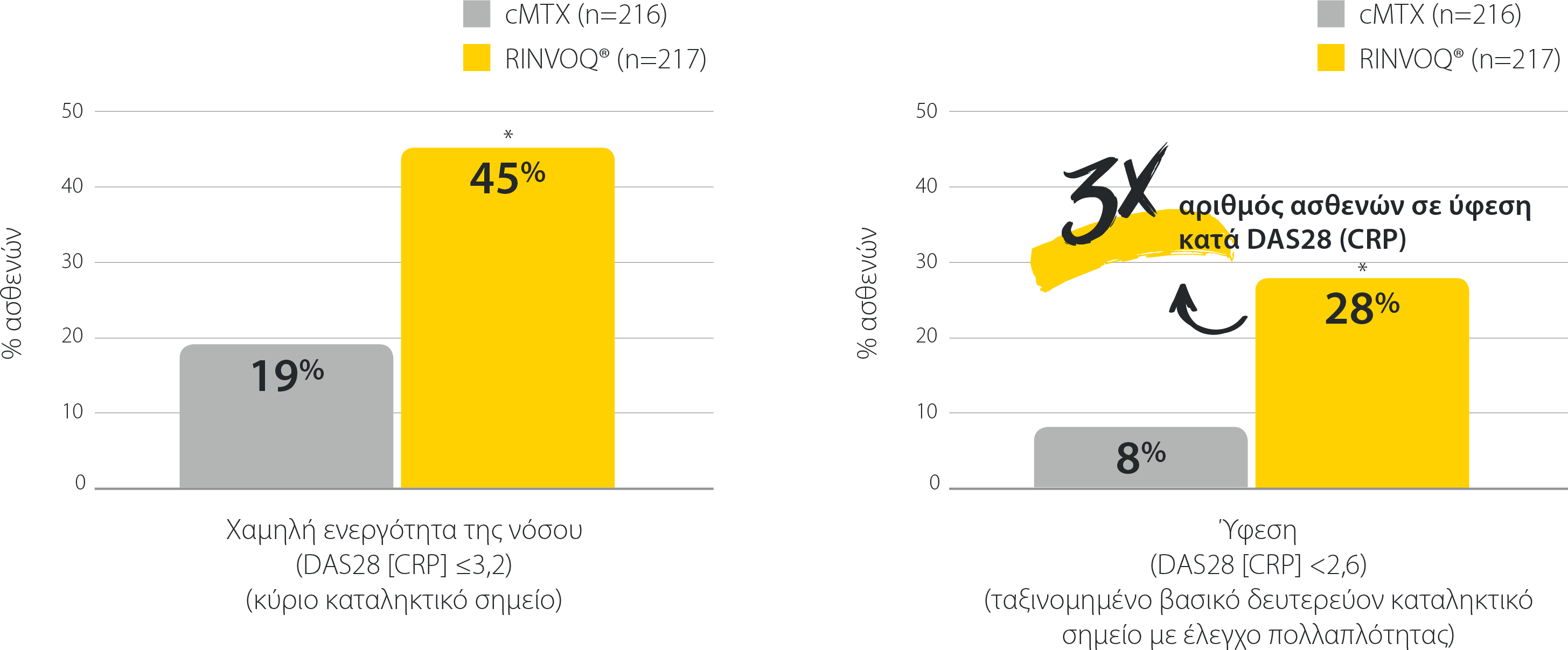
Μονοθεραπεία RINVOQ®: Αποτελεσματικότητα σε όλα τα καταληκτικά σημεία
SELECT-MONOTHERAPY: Χαμηλή ενεργότητα της νόσου και ύφεση την εβδομάδα 14 (NRI)1,2
*P≤0,0001 έναντι cMTX
cMTX: συνεχής θεραπεία με μεθοτρεξάτη, DAS28 (CRP): Βαθμολογία Ενεργότητας της Νόσου σε 28 αρθρώσεις (C-αντιδρώσα πρωτεΐνη), NRI: καταλογισμός μη ανταποκριθέντων.
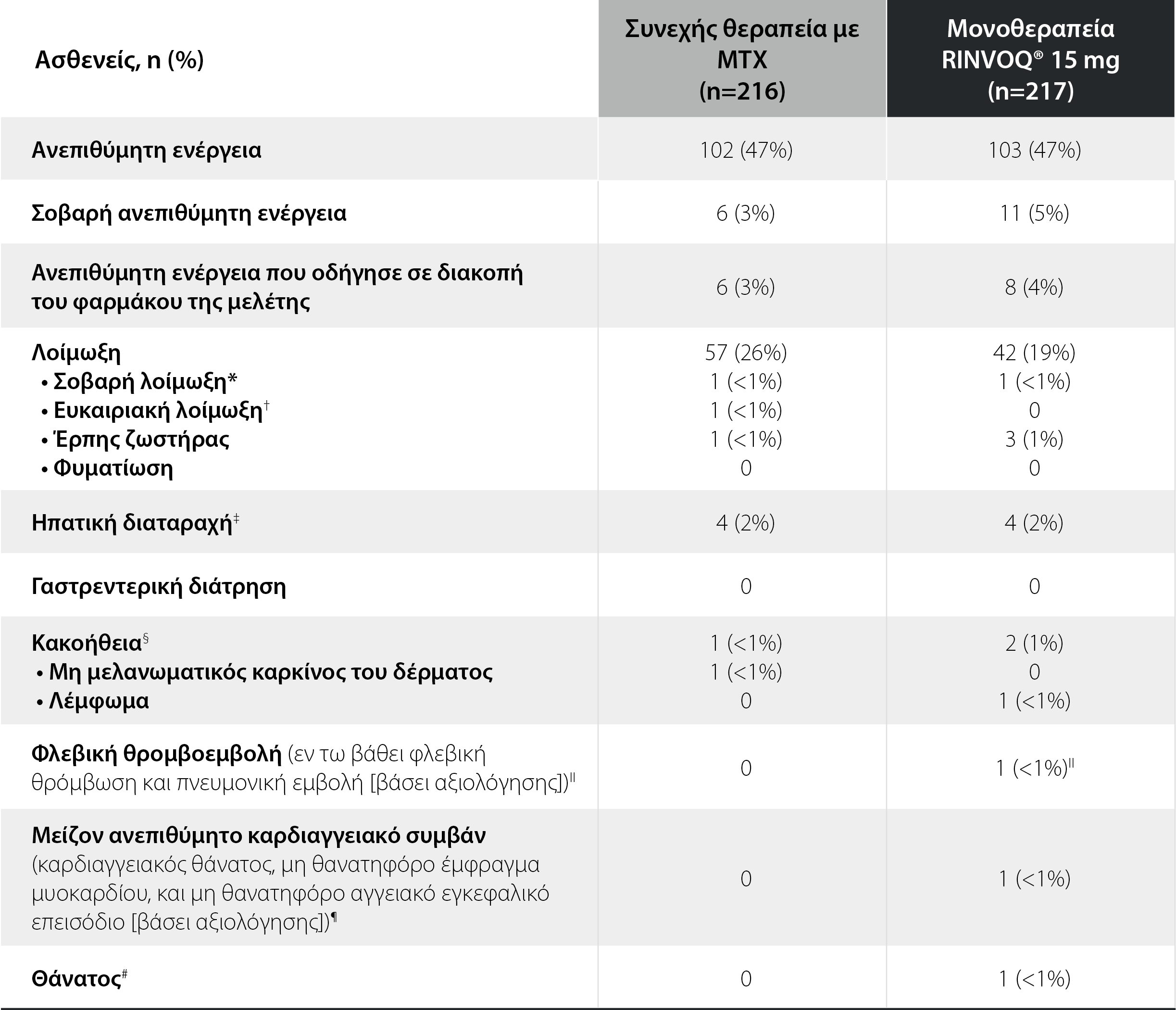
SELECT-MONOTHERAPY: Ανεπιθύμητες ενέργειες σε διάστημα 14 εβδομάδων θεραπείας2
*Σοβαρή λοίμωξη: Στην ομάδα της μεθοτρεξάτης υπήρξε 1 συμβάν ουροσήψης. Στην ομάδα του RINVOQ® 15 mg, παρατηρήθηκε 1 απόστημα άκρου.
†Ευκαιριακή λοίμωξη: Στην ομάδα της μεθοτρεξάτης, παρατηρήθηκε 1 συμβάν μυκητιασικής οισοφαγίτιδας.
‡Ηπατική διαταραχή: Στην ομάδα της μεθοτρεξάτης, υπήρξαν 4 περιπτώσεις αύξησης των επιπέδων των ηπατικών ενζύμων. Στην ομάδα του RINVOQ® 15 mg, παρατηρήθηκαν 3 περιπτώσεις αύξησης των επιπέδων των ηπατικών ενζύμων και 1 ήπια ηπατική κύστη.
§Κακοήθειες: Στην ομάδα της μεθοτρεξάτης, παρατηρήθηκε 1 καρκίνωμα βασικών κυττάρων. Στην ομάδα του RINVOQ® 15 mg, υπήρξε 1 μη Hodgkin λέμφωμα και 1 καρκίνος του μαστού.
IIΦλεβική θρομβοεμβολή: Στην ομάδα του RINVOQ® 15 mg, παρατηρήθηκε 1 πνευμονική εμβολή σε ασθενή υπό ορμονική θεραπεία με οιστρογόνα με δείκτη μάζας σώματος 44,9. Από τον ερευνητή κρίθηκε ως μη συνδεόμενη με το φάρμακο της μελέτης.
¶Μείζον ανεπιθύμητο καρδιαγγειακό συμβάν (βάσει αξιολόγησης): Στην ομάδα του RINVOQ® 15 mg, υπήρξε 1 αιμορραγικό αγγειακό εγκεφαλικό επεισόδιο λόγω ρήξης ανευρύσματος (θανατηφόρο).Από τον ερευνητή κρίθηκε ως μη συνδεόμενο με το φάρμακο της μελέτης.
#Θάνατος: Στην ομάδα του RINVOQ® 15 mg, υπήρξε ένα αιμορραγικό αγγειακό εγκεφαλικό επεισόδιο λόγω ρήξης ανευρύσματος.
References
- RINVOQ® Περίληψη Χαρακτηριστικών Προϊόντος, 12-2023.
- Smolen JS, Pangan AL, Emery P, et al. Upadacitinib as monotherapy in patients with active rheumatoid arthritis and inadequate response to methotrexate (SELECT- MONOTHERAPY): a randomised, placebo-controlled, double-blind phase 3 study. Lancet. 2019;393(10188):2303-2311. doi:10.1016/S0140-6736(19)30419-2