Ρευματοειδής αρθρίτιδα
Το RINVOQ ενδείκνυται για τη θεραπεία της μέτριας έως σοβαρής ενεργού ρευματοειδούς αρθρίτιδας σε ενήλικες ασθενείς, οι οποίοι έχουν ανταποκριθεί ανεπαρκώς σε, ή οι οποίοι εμφανίζουν δυσανεξία σε ένα ή περισσότερα τροποποιητικά της νόσου αντιρευματικά φάρμακα (DMARDs). Το RINVOQ μπορεί να χρησιμοποιηθεί ως μονοθεραπεία ή σε συνδυασμό με μεθοτρεξάτη.
Το RINVOQ® δεν έχει εγκριθεί για τη θεραπεία ασθενών πρωτοθεραπευόμενων με ΜΤΧ
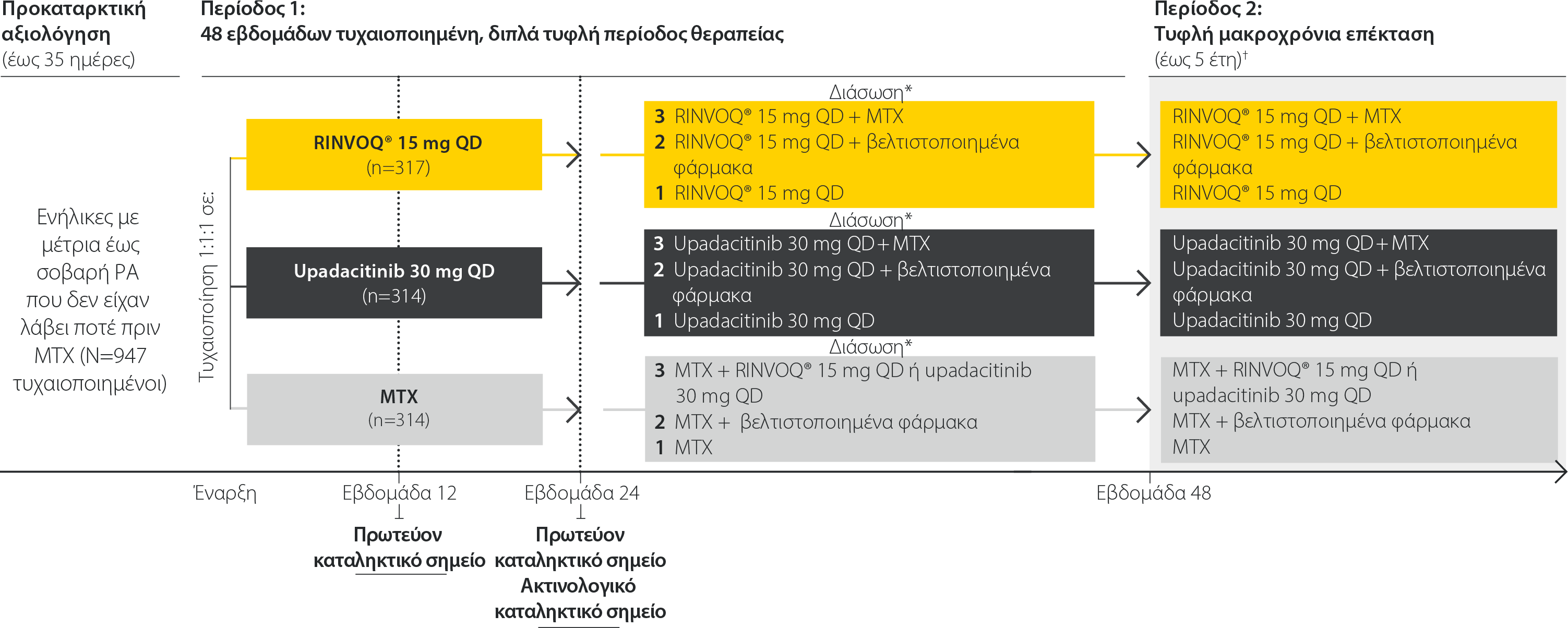
SELECT-EARLY: Σχεδιασμός μελέτης
Μια μελέτη φάσης 3 για τη διερεύνηση της αποτελεσματικότητας και της ασφάλειας της μονοθεραπείας RINVOQ® σε σύγκριση με ΜΤΧ σε πρωτοθεραπευόμενους με ΜΤΧ ασθενείς με μέτρια έως σοβαρή ΡΑ1
Θεραπεία διάσωσης από την εβδομάδα 12 έως την εβδομάδα 24: Στους ασθενείς με βελτίωση <20% στις τιμές TJC και SJC σε 2 διαδοχικές επισκέψεις, οι θεραπείες υποβάθρου βελτιστοποιήθηκαν.
*Πρωτόκολλο διάσωσης από την εβδομάδα 26: ομάδα 1, εάν CDAI ≤2,8, οι ασθενείς συνέχισαν το φάρμακο της μελέτης που τους χορηγήθηκε αρχικά˙ ομάδα 2, για βελτίωση >20% από την αρχική εκτίμηση στον αριθμό των ευαίσθητων αρθρώσεων (TJC), και τον αριθμό των διογκωμένων αρθρώσεων (SJC), αλλά για CDAI >2,8, οι θεραπείες υποβάθρου βελτιστοποιήθηκαν˙ ομάδα 3, για βελτίωση <20%από την αρχική εκτίμηση στις τιμές TJC και SJC, και CDAI >2,8, προστέθηκε η χορήγηση RINVOQ® 15 mg ή upadacitinib 30 mg με εκ νέου τυχαιοποίηση σε αναλογία 1:1 για τους ασθενείς που αρχικά τυχαιοποιήθηκαν να λάβουν MTX, και η χορήγηση MTX προστέθηκε για τους ασθενείς που αρχικά τυχαιοποιήθηκαν να λάβουν RINVOQ® 15 mg ή upadacitinib 30 mg.
†Η αντιστοίχιση φαρμάκων της μελέτης παρέμεινε η ίδια στην τυφλοποιημένη επέκταση, ενώ υπήρχε δυνατότητα έναρξης, ή αλλαγής, στη (στις) φαρμακευτική(ές) αγωγή(ές) υποβάθρου για τη ΡΑ σύμφωνα με την τοπική ετικέτα.
Κύρια
RINVOQ® 15 mg και upadacitinib 30 mg έναντι ΜΤΧ για DAS28 (CRP) <2,6 την εβδομάδα 24 (EMA) ή ACR50 την εβδομάδα 12 (FDA)
Ασφάλεια
Ανεπιθύμητες ενέργειες, σοβαρές ανεπιθύμητες ενέργειες, ανεπιθύμητες ενέργειες ειδικού ενδιαφέροντος (π.χ. σοβαρές λοιμώξεις, ευκαιριακές λοιμώξεις, MACE, VTE, κακοήθειες)
- Ασθενείς ηλικίας ≥18 ετών ήταν επιλέξιμοι για ένταξη.
- Διάγνωση ΡΑ ≥6εβδομάδων σύμφωνα με τα κριτήρια ταξινόμησης των ACR/EULAR 2010 για τη ΡΑ με ενεργό νόσο (τουλάχιστον 6 διογκωμένες αρθρώσεις από τις 66, τουλάχιστον 6 ευαίσθητες αρθρώσεις από τις 68, και τιμή hsCRP ≥5 mg/L) και ≥1 διάβρωση με ακτινογραφία Ή θετικό αποτέλεσμα για RF και ACCP.
- Οι ασθενείς ήταν πρωτοθεραπευόμενοι με ΜΤΧ ή δεν είχαν λάβει περισσότερες από 3 εβδομαδιαίες δόσεις ΜΤΧ και είχαν ολοκληρώσει περίοδο έκπλυσης της ΜΤΧ 4 εβδομάδων.
- Χωρίς προηγούμενη δυσανεξία στη ΜΤΧ, ή χωρίς προηγούμενη έκθεση σε αναστολέα JAK ή bDMARD.
Η εγκεκριμένη δόση του RINVOQ® είναι 15 mg μία φορά την ημέρα. Το upadacitinib 30 mg QD δεν αποτελεί εγκεκριμένη δόση.
ACCP: αντικυκλική κιτρουλινική πρωτεΐνη, ACR: Αμερικανικό Κολλέγιο Ρευματολογίας, ACR50: βελτίωση τουλάχιστον 50% στα βασικά κριτήρια του Αμερικανικού Κολλεγίου Ρευματολογίας, bDMARD: βιολογικό τροποποιητικό της νόσου αντιρευματικό φάρμακο, CDAI: Δείκτης Κλινικής Ενεργότητας της Νόσου, DAS28 (CRP): Βαθμολογία Ενεργότητας της Νόσου σε 28 αρθρώσεις (C-αντιδρώσα πρωτεΐνη), EMA: Ευρωπαϊκός Οργανισμός Φαρμάκων, EULAR: Ευρωπαϊκή Εταιρεία κατά του Ρευματισμού, FDA: Αμερικανικός Οργανισμός Τροφίμων και Φαρμάκων, hsCRP: υψηλής ευαισθησίας C-αντιδρώσα πρωτεΐνη, JAK: κινάση Janus, MACE: Μείζον ανεπιθύμητο καρδιαγγειακό συμβάν, MTX: μεθοτρεξάτη, QD: άπαξ ημερησίως, RF: ρευματοειδής παράγοντας, SJC: αριθμός διογκωμένων αρθρώσεων, TJC: αριθμός ευαίσθητων αρθρώσεων, VTE: φλεβική θρομβοεμβολή.
Δεδομένα της μονοθεραπείας με RINVOQ®
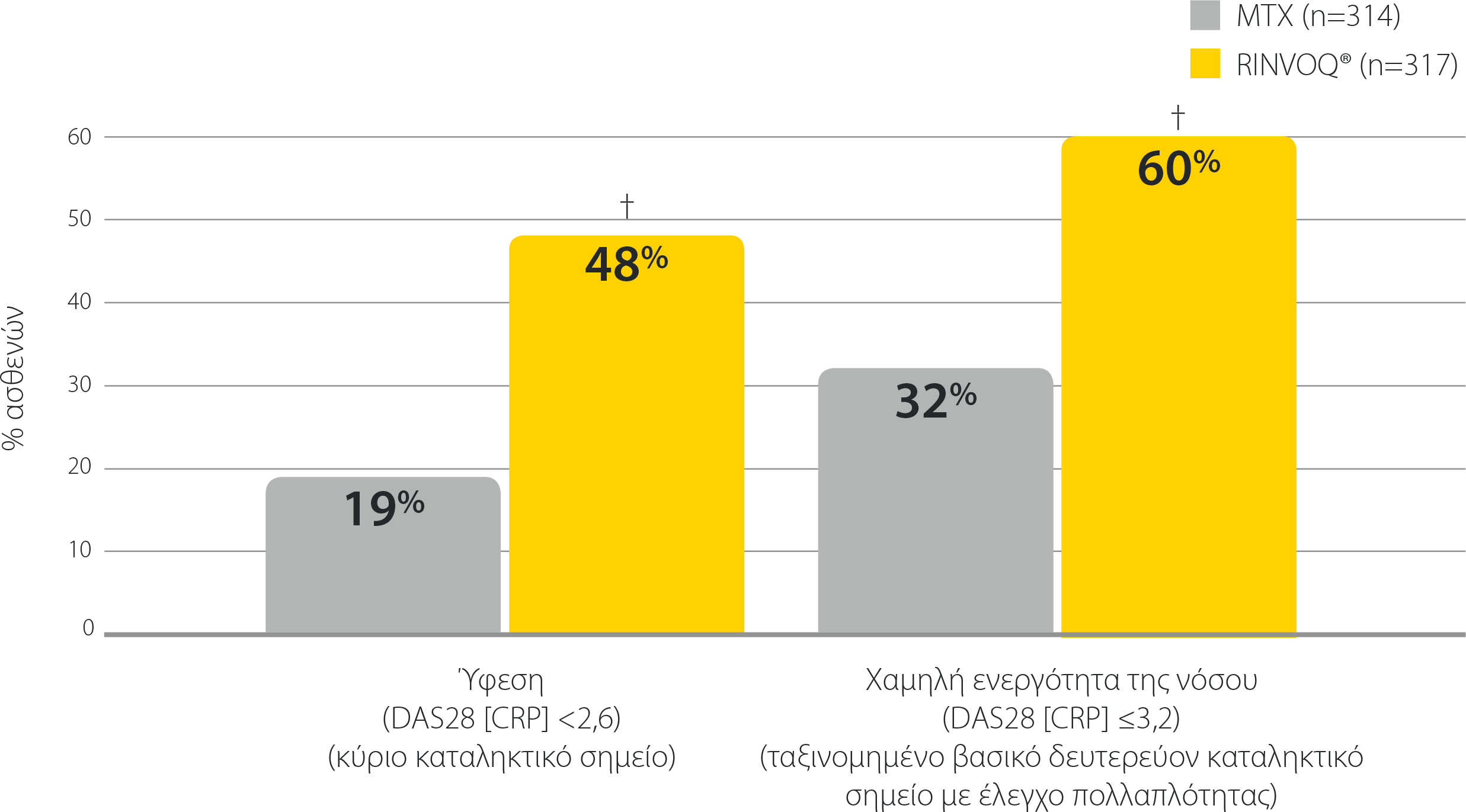
SELECT-EARLY: Ύφεση (κύριο καταληκτικό σημείο) και Χαμηλή ενεργότητα της νόσου την εβδομάδα 24 σε ασθενείς πρωτοθεραπευόμενους με MTX1,3*
*Το RINVOQ® δεν ενδείκνυται για ασθενείς πρωτοθεραπευόμενους με ΜΤΧ..
† P<0,001 έναντι MTX
DAS28 (CRP): Βαθμολογία Ενεργότητας της Νόσου σε 28 αρθρώσεις (C-αντιδρώσα πρωτεΐνη, MTX: μεθοτρεξάτη.
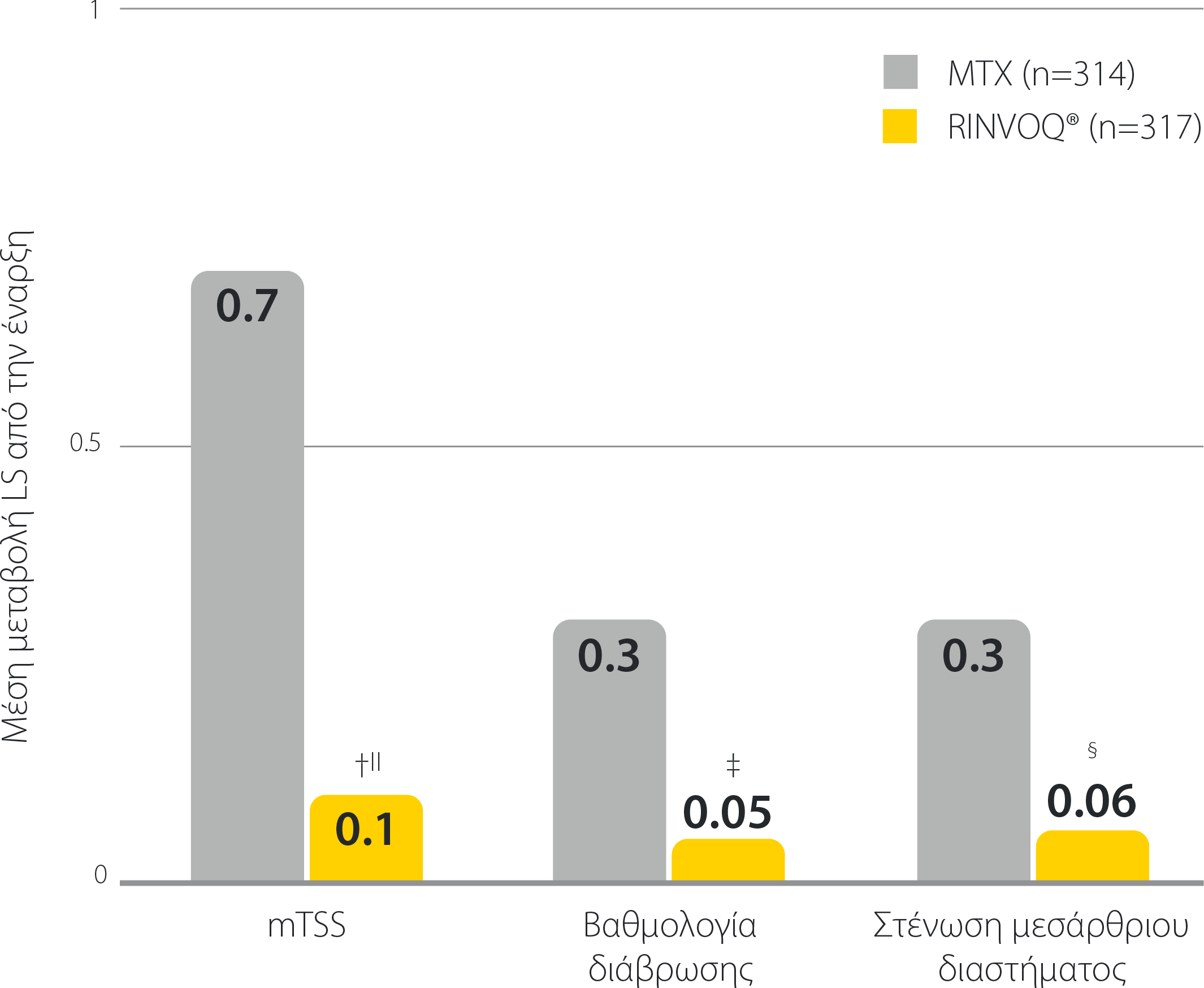
Προστασία των αρθρώσεων με τη μονοθεραπεία RINVOQ®
SELECT-EARLY: Αναστολή της εξέλιξης της δομικής βλάβης των αρθρώσεων ως μονοθεραπεία σε ασθενείς πρωτοθεραπευόμενους με ΜΤΧ* την εβδομάδα 241,2
Η μεταβολή στην mTSS για το RINVOQ® έναντι της MTX την εβδομάδα 24 ήταν ταξινομημένο δευτερεύον καταληκτικό σημείο με έλεγχο πολλαπλότητας. Όλα τα υπόλοιπα δεδομένα που παρουσιάζονται για το RINVOQ® συγκριτικά με τη MTX ήταν προκαθορισμένα μη ταξινομημένα καταληκτικά σημεία χωρίς έλεγχο πολλαπλότητας˙ παρέχονται οι τιμές P.
*To RINVOQ® δεν ενδείκνυται για ασθενείς πρωτοθεραπευόμενους με ΜΤΧ.
† P≤0,01 έναντιMTX
‡ P≤0,001 έναντι MTX
§ P≤0,05 έναντι MTX
||Υποδηλώνει σύγκριση του RINVOQ® έναντι της MTX με έλεγχο πολλαπλότητας.
LS: leελάχιστα τετράγωνα, mTSS: τροποποιημένη συνολική βαθμολογία Sharp, MTX: μεθοτρεξάτη.
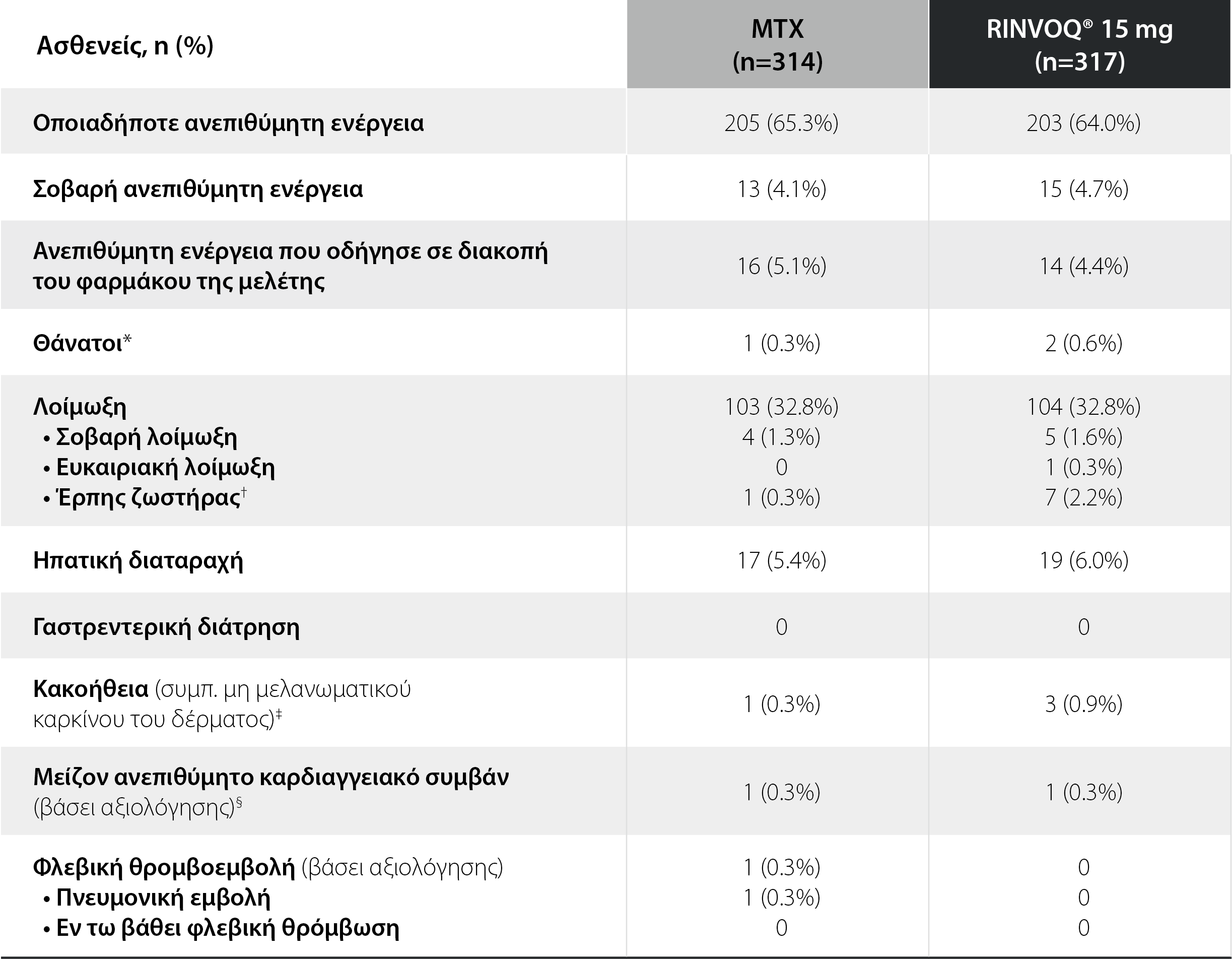
SELECT-EARLY: Ανεπιθύμητες ενέργειες σε διάστημα 24 εβδομάδων θεραπείας1
*Θάνατοι: Στην ομάδα της μεθοτρεξάτης, υπήρξε 1 αιφνίδιος καρδιαγγειακός θάνατος. Στην ομάδα του RINVOQ® 15 mg, σημειώθηκε 1 καρδιαγγειακός θάνατος, 1 θάνατος λόγω μεταστατικού κακοήθους μελανώματος.
†Έρπης ζωστήρας: Όλα τα συμβάντα ήταν μη σοβαρά, 12 αφορούσαν προσβολή ενός δερμοτομίου.
‡Κακοήθειες: Στην ομάδα της μεθοτρεξάτης, υπήρξε 1 κρούσμα καρκίνου των ωοθηκών. Στην ομάδα του RINVOQ® 15 mg υπήρξε 1 μεταστατικό κακοήθες μελάνωμα, 1 καρκίνος του πνεύμονα εκ πλακωδών κυττάρων, 1 καρκίνος της μήτρας in situ.
§Μείζονα ανεπιθύμητα καρδιαγγειακά συμβάντα (βάσει αξιολόγησης): Στην ομάδα της μεθοτρεξάτης, υπήρξε 1 καρδιαγγειακός θάνατος. Στην ομάδα του RINVOQ® 15 mg, σημειώθηκε 1 μη θανατηφόρο έμφραγμα μυοκαρδίου και 1 καρδιαγγειακός θάνατος λόγω άλλων καρδιαγγειακών αιτιών.
References
- Van Vollenhoven, R, Takeuchi, T, Pangan, A.L, et al. Efficacy and safety of Upadacitinibmonotherapy in methotrexate-naive patients with moderatelyto-severely active rheumatoid arthritis (SELECT-EARLY): a multicenter, multiCountry, randomized, double-blind, active comparator-controlled trial. Arthritis Rheumatol. 72:1607-1620. doi:10.1002/art.41384. .
- RINVOQ® Περίληψη Χαρακτηριστικών Προϊόντος, 12-2023.