Ρευματοειδής αρθρίτιδα
Το RINVOQ ενδείκνυται για τη θεραπεία της μέτριας έως σοβαρής ενεργού ρευματοειδούς αρθρίτιδας σε ενήλικες ασθενείς, οι οποίοι έχουν ανταποκριθεί ανεπαρκώς σε, ή οι οποίοι εμφανίζουν δυσανεξία σε ένα ή περισσότερα τροποποιητικά της νόσου αντιρευματικά φάρμακα (DMARDs). Το RINVOQ μπορεί να χρησιμοποιηθεί ως μονοθεραπεία ή σε συνδυασμό με μεθοτρεξάτη.
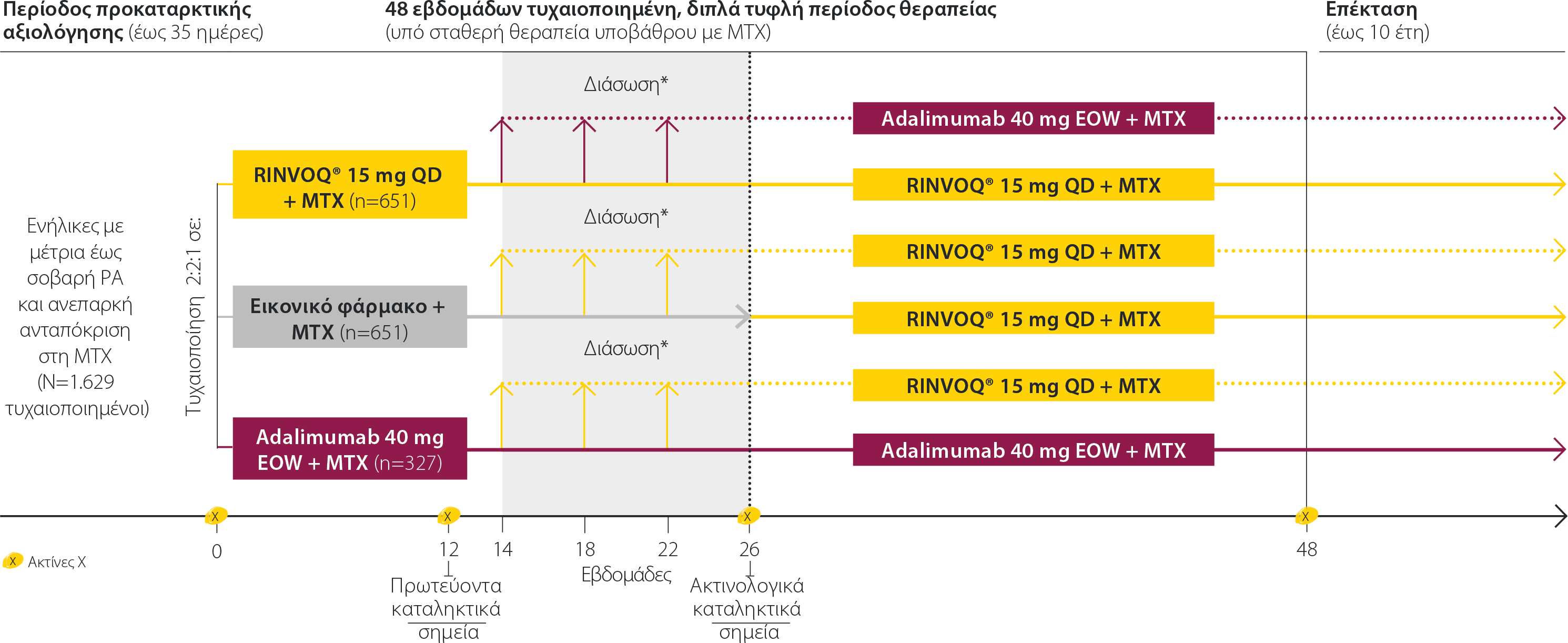
SELECT-COMPARE: Σχεδιασμός μελέτης
Μια μελέτη φάσης III για τη διερεύνηση της αποτελεσματικότητας και της ασφάλειας του σχήματος RINVOQ® + ΜΤΧ σε σύγκριση με εικονικό φάρμακο + ΜΤΧ και adalimumab + MTX για τη θεραπεία της μέτριας έως σοβαρής ΡΑ σε ασθενείς με ανεπαρκή ανταπόκριση στη MTX2
*Κριτήρια διάσωσης: Τις εβδομάδες 14,18, και 22, οι ασθενείς που έλαβαν adalimumab ή εικονικό φάρμακο μεταπήδησαν σε αγωγή με RINVOQ® και οι ασθενείς που λάμβαναν RINVOQ® μεταπήδησαν σε adalimumab εάν παρουσίαζαν βελτίωση <20% στον αριθμό των ευαίσθητων αρθρώσεων και τον αριθμό των διογκωμένων αρθρώσεων συγκριτικά με την αρχική εκτίμηση. Την εβδομάδα 26, όλοι οι υπόλοιποι ασθενείς που λάμβαναν εικονικό φάρμακο, οι οποίοι δεν έλαβαν θεραπεία διάσωσης, μεταπήδησαν στο RINVOQ®, και οι ασθενείς που λάμβαναν RINVOQ® ή adalimumab μεταπήδησαν σε adalimumab και RINVOQ®, αντίστοιχα, εάν ο δείκτης CDAI ήταν >10.
Κύρια
RINVOQ® 15 mg + MTX έναντι εικονικού φαρμάκου + MTX την εβδομάδα 12 για DAS28 (CRP) <2,6 (EMA) ή ACR20 (FDA)
Ασφάλεια
Ανεπιθύμητες ενέργειες, σοβαρές ανεπιθύμητες ενέργειες, ανεπιθύμητες ενέργειες ειδικού ενδιαφέροντος (π.χ., σοβαρές λοιμώξεις, ευκαιριακές λοιμώξεις, MACE, VTE, κακοήθειες)
- Ασθενείς ηλικίας ≥18 ετών ήταν επιλέξιμοι για ένταξη.
- Διάγνωση ΡΑ ≥3 μηνών σύμφωνα με τα κριτήρια ταξινόμησης των ACR/EULAR 2010 για τη ΡΑ με ενεργό νόσο (≥6 διογκωμένες αρθρώσεις από τις 66, ≥6 ευαίσθητες αρθρώσεις από τις 68 που εξετάστηκαν, hsCRP ≥5 mg/L) και τουλάχιστον ένα από τα ακόλουθα κατά τον προληπτικό έλεγχο: ≥3 διαβρώσεις στις ακτινογραφίες παλαμών και πελμάτων, ή ≥1 διάβρωση και θετικοί για RF ή ACCP.
- Οι ασθενείς έπρεπε να είχαν ανεπαρκή ανταπόκριση στη ΜΤΧ.
- Οι ασθενείς με προηγούμενη έκθεση το ανώτερο σε 1 bDMARD (εκτός από adalimumab) ήταν επιλέξιμοι (έως 20% του συνολικού αριθμού ασθενών της μελέτης), εάν είχαν είτε περιορισμένη έκθεση (<3 μήνες) είτε έπρεπε να διακόψουν την αγωγή με bDMARD λόγω δυσανεξίας.
- Οι ασθενείς με ανεπαρκή ανταπόκριση σε προηγούμενα bDMARDs ή προηγούμενη έκθεση σε αναστολέα JAK αποκλείστηκαν.
ACCP: αντικυκλική κιτρουλινική πρωτεΐνη, ACR: Αμερικανικό Κολλέγιο Ρευματολογίας, ACR20: βελτίωση τουλάχιστον 20% στα βασικά κριτήρια του Αμερικανικού Κολλεγίου Ρευματολογίας, bDMARD: βιολογικό τροποποιητικό της νόσου αντιρευματικό φάρμακο, CDAI: συμβατικό συνθετικό τροποποιητικό της νόσου αντιρευματικό φάρμακο, DAS28 (CRP): ): Βαθμολογία Ενεργότητας της Νόσου σε 28 αρθρώσεις (C-αντιδρώσα πρωτεΐνη), EMA: Ευρωπαϊκός Οργανισμός Φαρμάκων, EOW: κάθε δεύτερη εβδομάδα, EULAR: Ευρωπαϊκή Εταιρεία κατά του Ρευματισμού, FDA: Αμερικανικός Οργανισμός Τροφίμων και Φαρμάκων, hsCRP: υψηλής ευαισθησίας C-αντιδρώσα πρωτεΐνη, MACE: Μείζον ανεπιθύμητο καρδιαγγειακό συμβάν, MTX: μεθοτρεξάτη, QD: άπαξ ημερησίως, RF: ρευματοειδής παράγοντας, VTE: φλεβική θρομβοεμβολή.
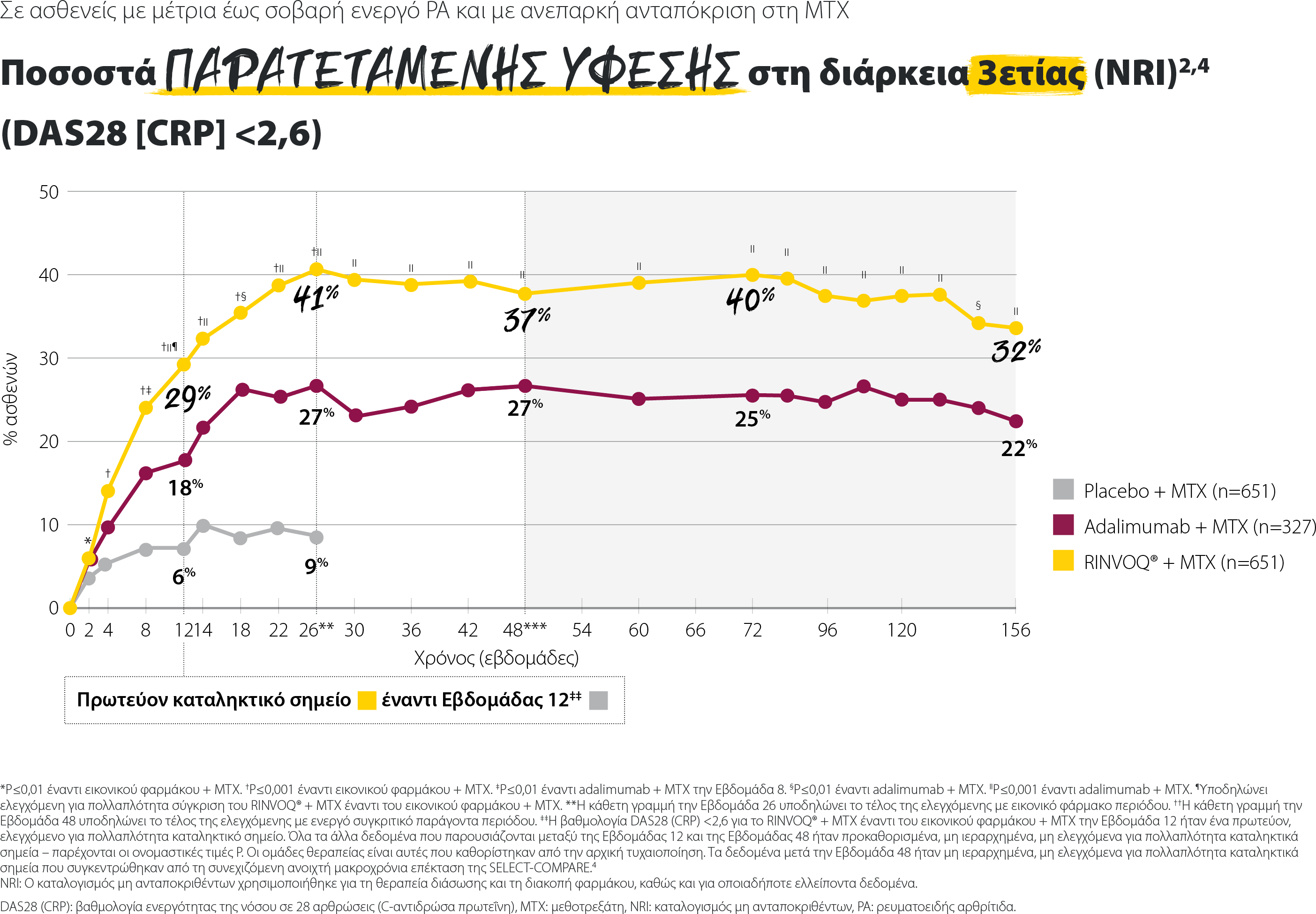
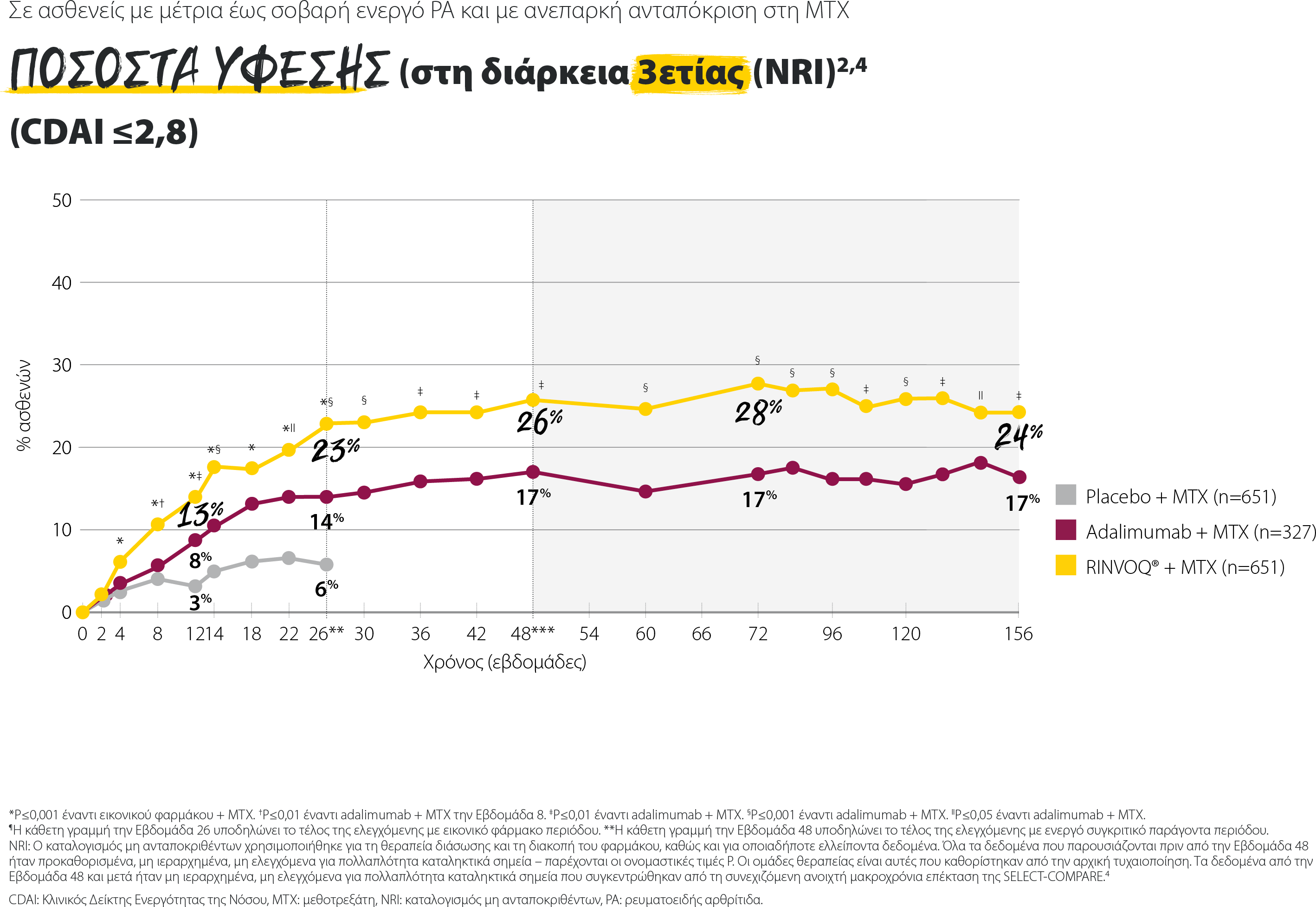
Σημαντικά υψηλότερα ποσοστά ύφεσης του RINVOQ® + MTX σε όλους τους δείκτες κλινικής ύφεσης
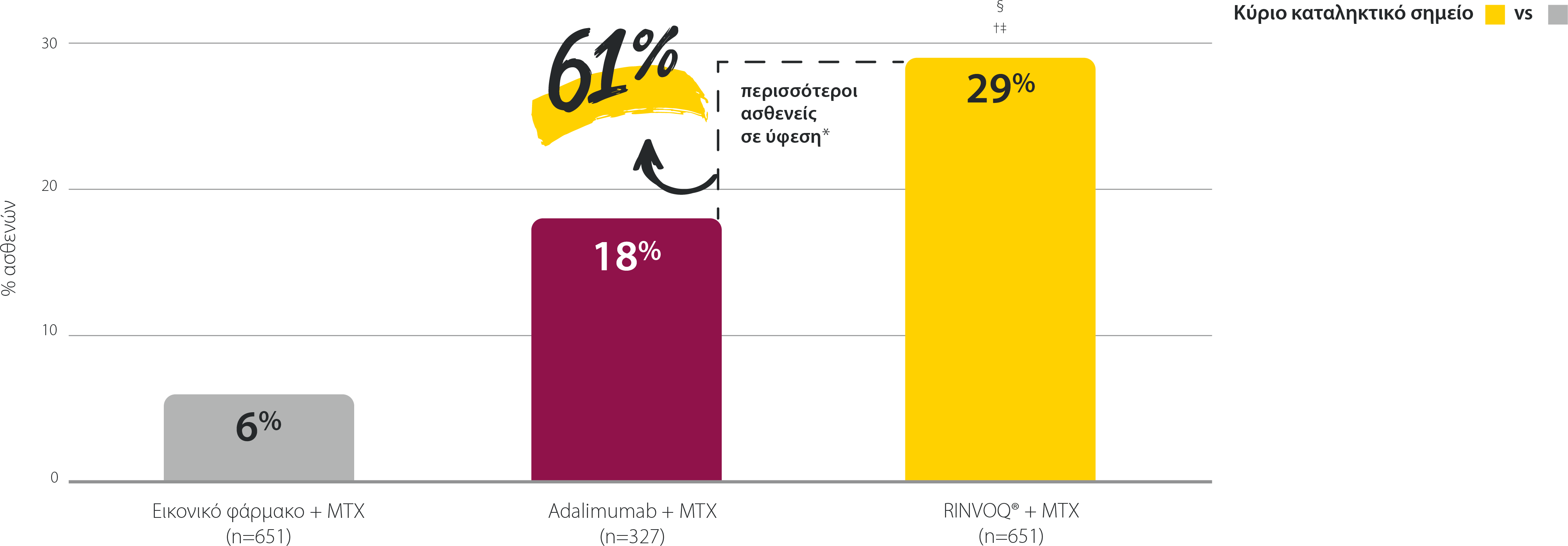
SELECT-COMPARE: Ύφεση (DAS28 [CRP] <2,6) ποσοστά την εβδομάδα 12 (NRI)1,2
Η τιμή DAS28 (CRP) <2,6 για τον συνδυασμό RINVOQ® + MTX έναντι εικονικού φαρμάκου+ MTX την εβδομάδα 12 ήταν κύριο καταληκτικό σημείο με έλεγχο πολλαπλότητας. Η τιμή DAS28 (CRP) <2,6 για τον συνδυασμό RINVOQ® + MTX έναντι του adalimumab + MTX την εβδομάδα 12 ήταν προκαθορισμένο μη ταξινομημένο καταληκτικό σημείο χωρίς έλεγχο πολλαπλότητας. Παρέχεται η ονομαστική τιμή P.
*61% είναι η σχετική διαφορά μεταξύ 29% (RINVOQ® + MTX) και 18% (adalimumab + MTX) των ασθενών που πέτυχαν ύφεση (DAS28 [CRP] <2,6) την Εβδομάδα 12.
† P≤0,001 έναντι εικονικού φαρμάκου + MTX
‡ P≤0,001 έναντι του adalimumab + MTX
§Υποδηλώνει σύγκριση του RINVOQ® + MTX έναντι εικονικού φαρμάκου + MTX με έλεγχο πολλαπλότητας.
DAS28 (CRP): Βαθμολογία Ενεργότητας της Νόσου σε 28 αρθρώσεις (C-αντιδρώσα πρωτεΐνη), MTX: μεθοτρεξάτη; NRI: καταλογισμός μη ανταποκριθέντων.
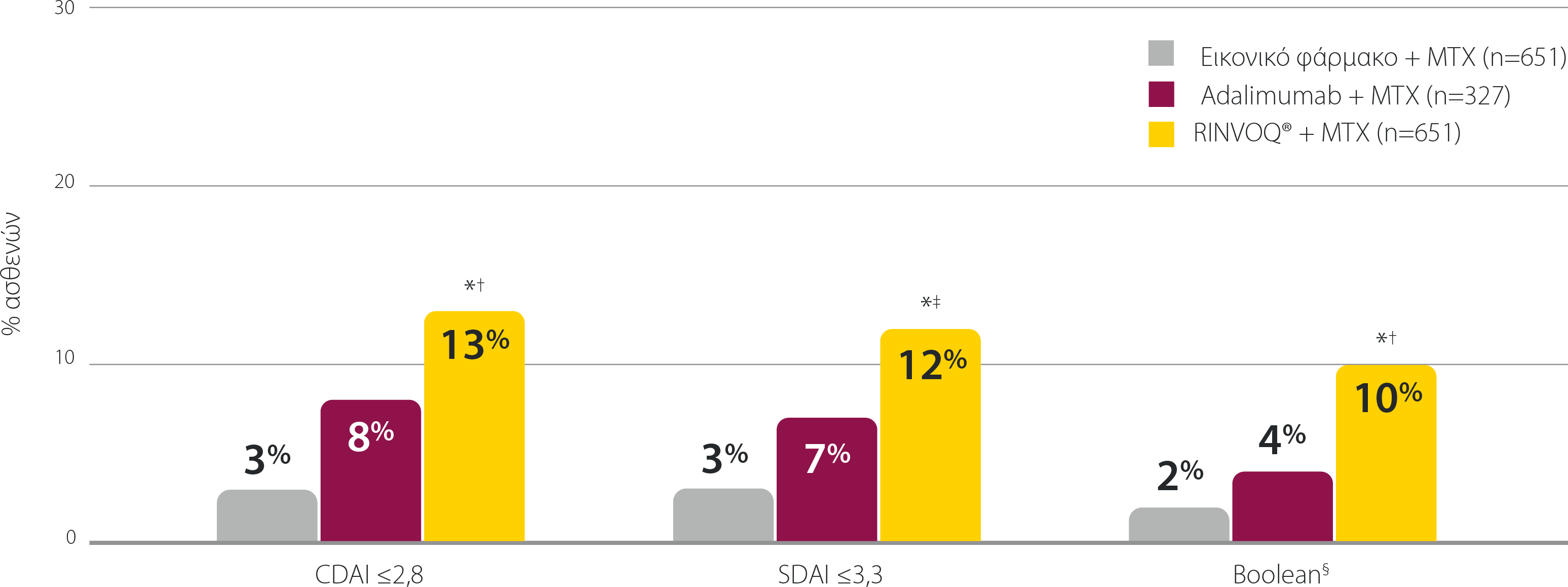
Ποσοστά ύφεσης του σχήματος RINVOQ® + MTX σε όλους τους δείκτες κλινικής ύφεσης
SELECT-COMPARE: Ποσοστά ύφεσης την εβδομάδα 12 (NRI)1,2
Τα δεδομένα που παρουσιάζονται αποτελούν προκαθορισμένα μη ιεραρχημένα καταληκτικά σημεία χωρίς έλεγχο πολλαπλότητας. Παρέχονται οι τιμές P.
*P≤0,001 έναντι εικονικού φαρμάκου + MTX
†P≤0,01 έναντι του adalimumab + MTX
‡P≤0,05 έναντι του adalimumab + MTX
§Ορισμός ύφεσης κατά ACR/EULAR: Ένας ασθενής πρέπει να πληροί, ανά πάσα στιγμή, όλα τα παρακάτω: TJC ≤1, SJC ≤1, CRP ≤1 mg/dL, και PGA ≤1 (σε κλίμακα 0-10).
ACR: Αμερικανικό Κολλέγιο Ρευματολογίας, CDAI: Δείκτης Κλινικής Ενεργότητας της Νόσου, CRP: C-αντιδρώσα πρωτεΐνη, EULAR: Ευρωπαϊκή Εταιρεία κατά του Ρευματισμού, MTX: μεθοτρεξάτη, NRI: καταλογισμός μη ανταποκριθέντων, PGA: Σφαιρική αξιολόγηση ασθενή, SDAI: Απλοποιημένος δείκτης ενεργότητας της νόσου, SJC: αριθμός διογκωμένων αρθρώσεων, TJC: αριθμός ευαίσθητων αρθρώσεων.
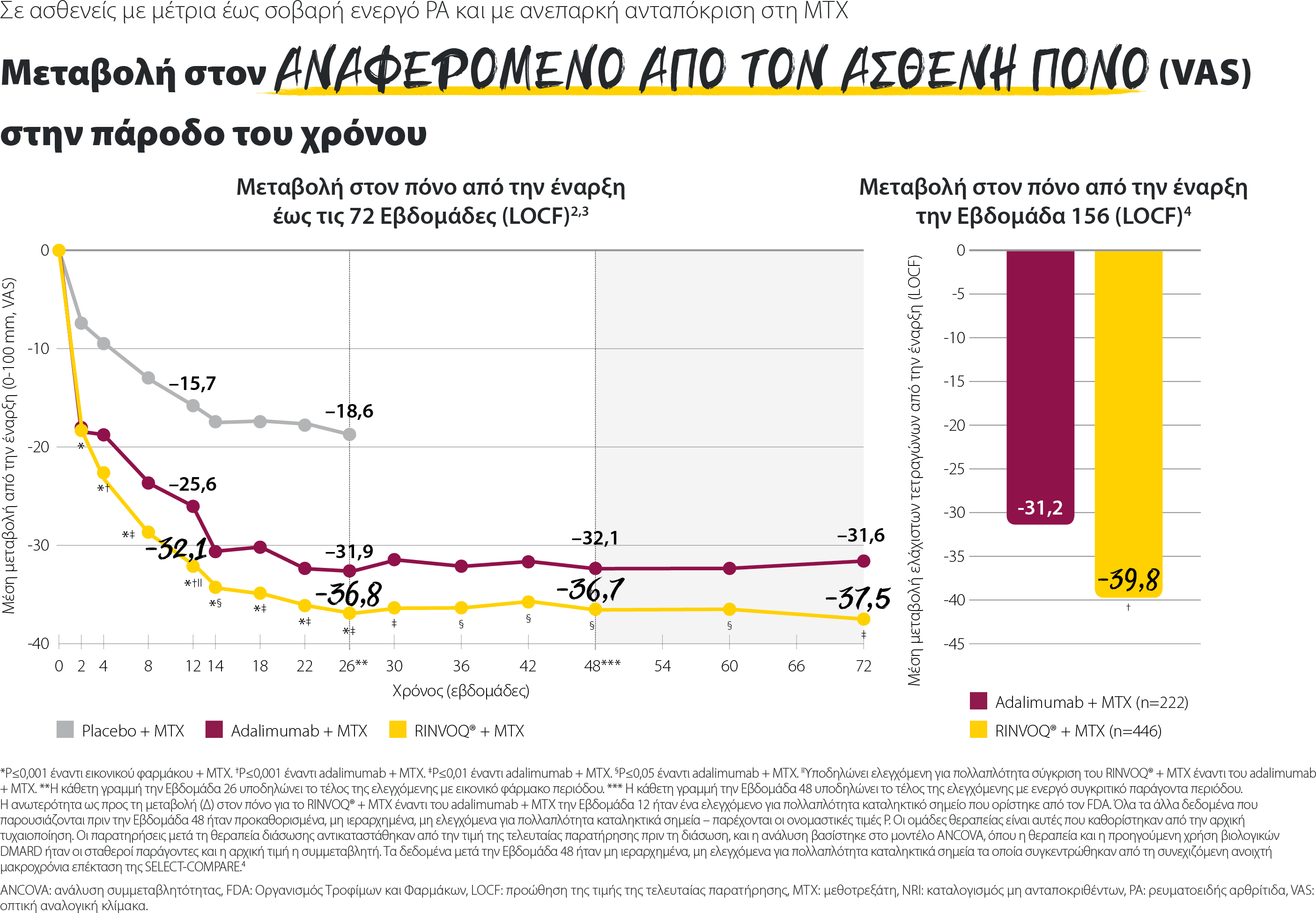
Το RINVOQ® + MTX ήταν ανώτερο συγκριτικά με το adalimumab + MTX την εβδομάδα 12 όσον αφορά τα εξής:
SELECT-COMPARE2
Η ανωτερότητα όσον αφορά τα κριτήρια ACR50, Δ τον πόνο, και Δ τον δείκτη HAQ-DI για τον συνδυασμό RINVOQ® + MTX έναντι του adalimumab + MTX την εβδομάδα 12 ήταν ιεραρχημένα από τον FDA βασικά δευτερεύοντα καταληκτικά σημεία με έλεγχο πολλαπλότητας. Η τιμή Δ HAQ-DI για τον συνδυασμό RINVOQ® + MTX έναντι εικονικού φαρμάκου + MTX την εβδομάδα 12 ήταν ιεραρχημένα από τον ΕΜΑ βασικό δευτερεύον καταληκτικό σημείο με έλεγχο πολλαπλότητας. Όλα τα υπόλοιπα δεδομένα που παρουσιάζονται ήταν προκαθορισμένα μη ιεραρχημένα καταληκτικά σημεία χωρίς έλεγχο πολλαπλότητας. Παρέχονται οι ονομαστικές τιμές P.
*P≤0,001 έναντι εικονικού φαρμάκου + MTX
†P≤0,001 έναντι του adalimumab + MTX
‡P≤0,01 έναντι του adalimumab + MTX
§Υποδηλώνει σύγκριση ανωτερότητας του RINVOQ® + MTX έναντι του συνδυασμού adalimumab + MTX με έλεγχο πολλαπλότητας.
IIΥποδηλώνει σύγκριση του RINVOQ® + MTX έναντι εικονικού φαρμάκου + MTX με έλεγχο πολλαπλότητας.
ACR50: βελτίωση τουλάχιστον 50% στα βασικά κριτήρια του Αμερικανικού Κολλεγίου Ρευματολογίας, ANCOVA: Ανάλυση συνδιακύμανσης, EMA: Ευρωπαϊκός Οργανισμός Φαρμάκων, FDA: Αμερικανικός Οργανισμός Τροφίμων και Φαρμάκων, HAQ-DI: Ερωτηματολόγιο Εκτίμησης Υγείας - Δείκτης Αναπηρίας, MTX: μεθοτρεξάτη, NRI: καταλογισμός μη ανταποκριθέντων, VAS: οπτική αναλογική κλίμακα.
Αναστολή της ακτινολογικής εξέλιξης με το RINVOQ®
SELECT-COMPARE: Αναστολή της εξέλιξης της δομικής αρθρικής βλάβης την Εβδομάδα 26 (γραμμική αναγωγή)1,2
SELECT-COMPARE: Αναστολή της εξέλιξης της δομικής αρθρικής βλάβης την εβδομάδα 48 (γραμμική αναγωγή)1,3
Η μεταβολή στη βαθμολογία mTSS για τον συνδυασμό RINVOQ® + MTX έναντι του εικονικού φαρμάκου + MTX την εβδομάδα 26 ήταν ταξινομημένο δευτερεύον καταληκτικό σημείο με έλεγχο πολλαπλότητας. Όλα τα υπόλοιπα δεδομένα που παρουσιάζονται για τον συνδυασμό RINVOQ® + MTX έναντι εικονικού φαρμάκου + MTX ήταν προκαθορισμένα μη ταξινομημένα καταληκτικά σημεία χωρίς έλεγχο πολλαπλότητας. Παρέχονται οι ονομαστικές τιμές P. Πραγματοποιήθηκαν μη στατιστικές συγκρίσεις μεταξύ των ομάδων χορήγησης RINVOQ® και adalimumab για τα ακτινογραφικά καταληκτικά σημεία.
*P≤0,001 έναντι εικονικού φαρμάκου + MTX
†Υποδηλώνει σύγκριση του RINVOQ® + MTX έναντι εικονικού φαρμάκου + MTX με έλεγχο πολλαπλότητας.
Οι θεραπευτικές ομάδες παρουσιάζονται βάσει της αρχικής τυχαιοποίησης. Για την ομάδα του εικονικού φαρμάκου, όλα τα δεδομένα την εβδομάδα 48 υπολογίστηκαν με γραμμική αναγωγή. Τα ακτινογραφικά δεδομένα που συλλέχθηκαν κατά την αλλαγή θεραπείας ή τη διακοπή του εικονικού φαρμάκου (για τους ασθενείς που διέκοψαν το εικονικό φάρμακο) χρησιμοποιήθηκαν για την αναγωγή. Συγκεκριμένα, για τους ασθενείς που λάμβαναν το εικονικό φάρμακο, οι οποίοι μεταπήδησαν στο RINVOQ® την εβδομάδα 26, η ακτινογραφία της εβδομάδας 26 χρησιμοποιήθηκε για αναγωγή, προκειμένου να υπολογιστούν τα δεδομένα της εβδομάδας 48. Για τους ασθενείς που τυχαιοποιήθηκαν να λάβουν το RINVOQ® ή adalimumab που έλαβαν θεραπεία διάσωσης, τα δεδομένα της εβδομάδας 48 υπολογίστηκαν επίσης με γραμμική αναγωγή, χρησιμοποιώντας τα ακτινογραφικά δεδομένα που συγκεντρώθηκαν κατά την αλλαγή της θεραπείας.1-3
LS: ελάχιστα τετράγωνα, mTSS: τροποποιημένη συνολική βαθμολογία Sharp, MTX: μεθοτρεξάτη, MTX-IR: ανεπαρκής ανταπόκριση στη MTX.
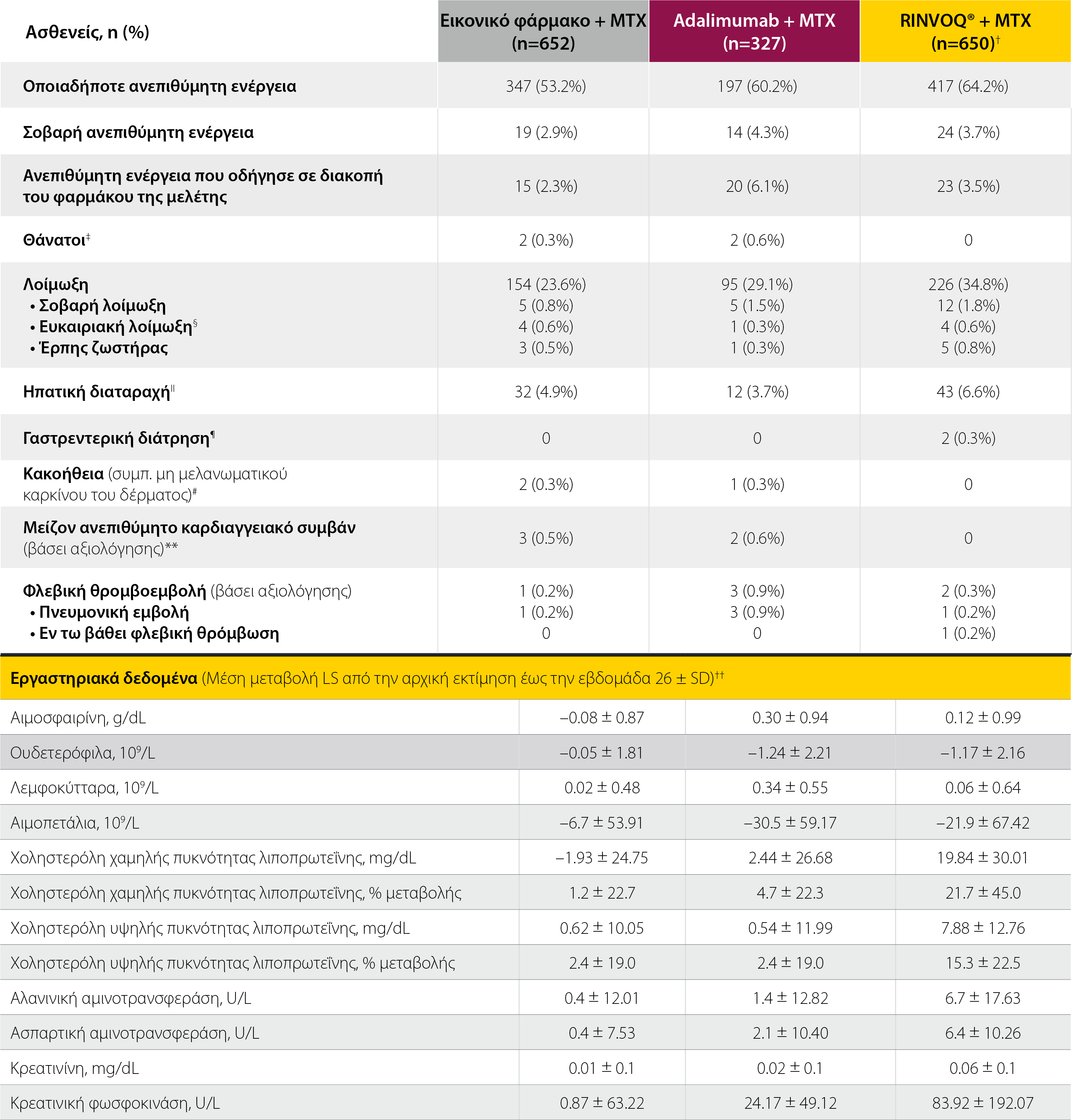
SELECT-COMPARE: Ανεπιθύμητες ενέργειες σε διάστημα 26 εβδομάδων θεραπείας2*
*Οι ανεπιθύμητες ενέργειες συγκεντρώθηκαν και συνοψίσθηκαν έως την εβδομάδα 26 και αξιολογήθηκαν ως εξής: Για ασθενείς που παρέμειναν στην αρχικά τυχαιοποιημένη θεραπεία έως την εβδομάδα 26, συμπεριλήφθηκαν όλα τα συμβάντα έως την εβδομάδα 26. Για τους ασθενείς που πληρούσαν τα κριτήρια διάσωσης την εβδομάδα 14,18 ή 22, αποκλείστηκαν τα συμβάντα που παρατηρήθηκαν με το ξεκίνημα της ημέρας έναρξης της θεραπείας διάσωσης.
†Ένας ασθενής που τυχαιοποιήθηκε στο RINVOQ® έλαβε μόνο μία ένεση εικονικού φαρμάκου πριν από τη διακοπή και περιλαμβάνεται στην ομάδα του εικονικού φαρμάκου για αξιολογήσεις της ασφάλειας.
‡Θάνατοι: Στην ομάδα του εικονικού φαρμάκου + MTX, σημειώθηκε 1 καρδιαγγειακός (CV) θάνατος και 1 θάνατος λόγω πνευμονίας από Pneumocystis jiroveci. Στην ομάδα του adalimumab + MTX, σημειώθηκε 1 θάνατος λόγω κρανιοεγκεφαλικού τραυματισμού και 1 καρδιαγγειακός θάνατος.
§Αναφέρθηκε μόνο 1 συμβάν λανθάνουσας φυματίωσης (στην ομάδα του RINVOQ® + MTX).
IIΗπατικές διαταραχές: Κυρίως αυξημένες τιμές σε δοκιμασίες ηπατικής λειτουργίας.
¶Γαστρεντερική διάτρηση (προσδιορισμός με χρήση Τυποποιημένων Όρων του MedDRA [SQM, Standardized MedDRA Queries] για τη γαστρεντερική διάτρηση): μη αυθόρμητες διατρήσεις, όμως 1 περιτονίτιδα και 1 πρωκτικό απόστημα.
#Κακοήθειες: Στην ομάδα του εικονικού φαρμάκου + MTX, παρατηρήθηκε 1 καρκίνος του τραχήλου και 1 καρκίνωμα βασικών κυττάρων. Στην ομάδα του adalimumab + MTX, παρατηρήθηκε 1 καρκίνωμα βασικών κυττάρων.
**Μείζονα ανεπιθύμητα καρδιαγγειακά συμβάντα (βάσει αξιολόγησης): Στην ομάδα του εικονικού φαρμάκου + MTX, παρατηρήθηκαν 2 μη θανατηφόρα εμφράγματα μυοκαρδίου και 1 καρδιαγγειακός θάνατος.
††Μόνο ασθενείς που διέκοψαν ενώ λαμβάναν το αρχικά τυχαιοποιημένο φάρμακο της μελέτης περιλαμβάνονται στην ανάλυση.
CPK: κρεατινική φωσφοκινάση, LS: ελάχιστα τετράγωνα, MTX: μεθοτρεξάτη.
References
- RINVOQ® Περίληψη Χαρακτηριστικών Προϊόντος, 12-2023.
- Fleischmann R, Pangan AL, Song IH, et al. Upadacitinib versus placebo or adalimumab in patients with rheumatoid arthritis and an inadequate response to methotrexate: results of a phase 3, double-blind, randomized controlled trial [published online July 9, 2019]. Arthritis Rheumatol. doi:10.1002/art.41032
- Fleischmann RM, Genovese MC, Enejosa JV, et al. Safety and effectiveness of upadacitinib or adalimumab plus methotrexate in patients with rheumatoid arthritis over 48 weeks with switch to alternate therapy in patients with insufficient response [published online July 30, 2019]. Ann Rheum Dis. doi:10.1136/annrheumdis-2019-215764
- 4.Fleischmann R, Mysler E, Bessette L, et al. Long-term safety and efficacy of upadacitinib or adalimumab in patients with rheumatoid arthritis: results through 3 years from the SELECTCOMPARE study. RMD Open 2022;8:e002012. doi:10.1136/ rmdopen-2021-002012