Ρευματοειδής αρθρίτιδα
Το RINVOQ ενδείκνυται για τη θεραπεία της μέτριας έως σοβαρής ενεργού ρευματοειδούς αρθρίτιδας σε ενήλικες ασθενείς, οι οποίοι έχουν ανταποκριθεί ανεπαρκώς σε, ή οι οποίοι εμφανίζουν δυσανεξία σε ένα ή περισσότερα τροποποιητικά της νόσου αντιρευματικά φάρμακα (DMARDs). Το RINVOQ μπορεί να χρησιμοποιηθεί ως μονοθεραπεία ή σε συνδυασμό με μεθοτρεξάτη.
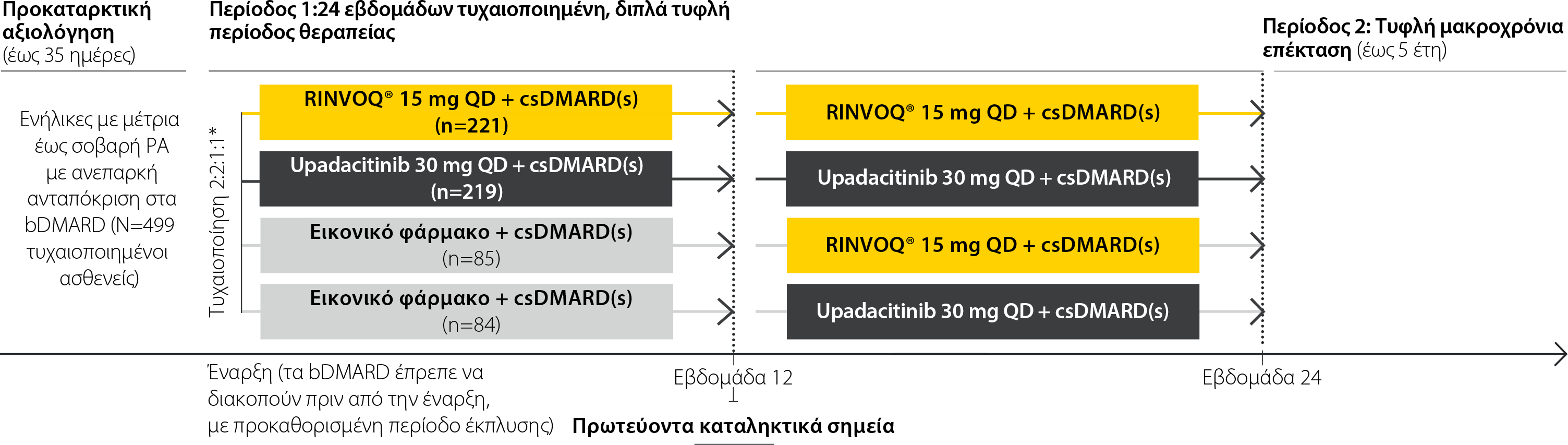
SELECT-BEYOND: Σχεδιασμός μελέτης
Μια μελέτη φάσης III για τη διερεύνηση της αποτελεσματικότητας και της ασφάλειας του συνδυασμού RINVOQ® + csDMARDs σε σύγκριση με τον συνδυασμό εικονικού φαρμάκου + csDMARDs σε ασθενείς με μέτρια έως σοβαρή ΡΑ σε ασθενείς και ανεπαρκή ανταπόκριση σε bDMARDs1
Οι ασθενείς συνέχισαν τη σταθερή θεραπεία με csDMARD για τις πρώτες 24 εβδομάδες της μελέτης, η οποία περιορίστηκε σε από του στόματος ή παρεντερική MTX, χλωροκίνη, υδροξυχλωροκίνη, σουλφασαλαζίνη, ή λεφλουνομίδη. Οι ασθενείς μπορούσαν να έχουν λάβει το ανώτερο 2 θεραπείες υποβάθρου με csDMARDs, εκτός από τον συνδυασμό MTX και λεφλουνομίδης, ο οποίος δεν επιτρεπόταν.
*Η διαστρωμάτωση της τυχαιοποίησης πραγματοποιήθηκε με βάση τον αριθμό προηγούμενων bDMARDs με τα οποία δεν επιτεύχθηκε ανταπόκριση (1 -2 με ίδιο μηχανισμό δράσης έναντι ≥3 με τον ίδιο μηχανισμό δράσης ή τουλάχιστον 2 βιολογικά φάρμακα με διαφορετικούς μηχανισμούς δράσης).
Κύρια
RINVOQ® 15 mg + csDMARD(s) και upadacitinib 30 mg + csDMARD(s) έναντι εικονικού φαρμάκου + csDMARD(s) την εβδομάδα 12 για DAS28 (CRP) ≤3,2 (EMA) ή ACR20 (FDA)
Ασφάλεια
Ανεπιθύμητες ενέργειες, σοβαρές ανεπιθύμητες ενέργειες, ανεπιθύμητες ενέργειες ειδικού ενδιαφέροντος (π.χ. σοβαρές λοιμώξεις, ευκαιριακές λοιμώξεις, MACE, VTE, κακοήθειες)
- Ασθενείς ηλικίας ≥18 ετών μπορούσαν να συμμετέχουν.
- Διάγνωση ΡΑ ≥3 μηνών σύμφωνα με τα κριτήρια ταξινόμησης των ACR/EULAR 2010 για τη ΡΑ με ενεργό νόσο (τουλάχιστον 6 διογκωμένες αρθρώσεις από τις 66, τουλάχιστον 6 ευαίσθητες αρθρώσεις από τις 68, και τιμή hsCRP ίση με 3 mg/L ή μεγαλύτερη).
- Οι ασθενείς έπρεπε να είχαν ανεπαρκή ανταπόκριση για τουλάχιστον 3 μήνες με τουλάχιστον ένα bDMARD ή δυσανεξία ή τοξικότητα στα bDMARDs.
- Οι ασθενείς λάμβαναν θεραπεία με csDMARD για τουλάχιστον 3 μήνες και σε σταθερές δόσεις για τουλάχιστον 4 εβδομάδες πριν από την ένταξη στη μελέτη.
- Χωρίς προηγούμενη έκθεση σε αναστολέα JAK.
Η εγκεκριμένη δόση του RINVOQ είναι 15 mg μία φορά την ημέρα. Το upadacitinib 30 mg QD δεν αποτελεί εγκεκριμένη δόση.
ACR: Αμερικανικό Κολλέγιο Ρευματολογίας, ACR20: βελτίωση τουλάχιστον 20% στα βασικά κριτήρια του Αμερικανικού Κολλεγίου Ρευματολογίας, bDMARD: βιολογικό τροποποιητικό της νόσου αντιρευματικό φάρμακο, csDMARD: συμβατικό συνθετικό τροποποιητικό της νόσου αντιρευματικό φάρμακο, DAS28 (CRP): Βαθμολογία Ενεργότητας της Νόσου σε 28 αρθρώσεις (C-αντιδρώσα πρωτεΐνη), EMA: Ευρωπαϊκός Οργανισμός Φαρμάκων; EULAR: Ευρωπαϊκή Εταιρεία κατά του Ρευματισμού, FDA: Αμερικανικός Οργανισμός Τροφίμων και Φαρμάκων, hsCRP: υψηλής ευαισθησίας C-αντιδρώσα πρωτεΐνη, JAK: κινάση Janus, MACE: Μείζον ανεπιθύμητο καρδιαγγειακό συμβάν, MTX: μεθοτρεξάτη, QD: άπαξ ημερησίως, VTE: φλεβική θρομβοεμβολή.
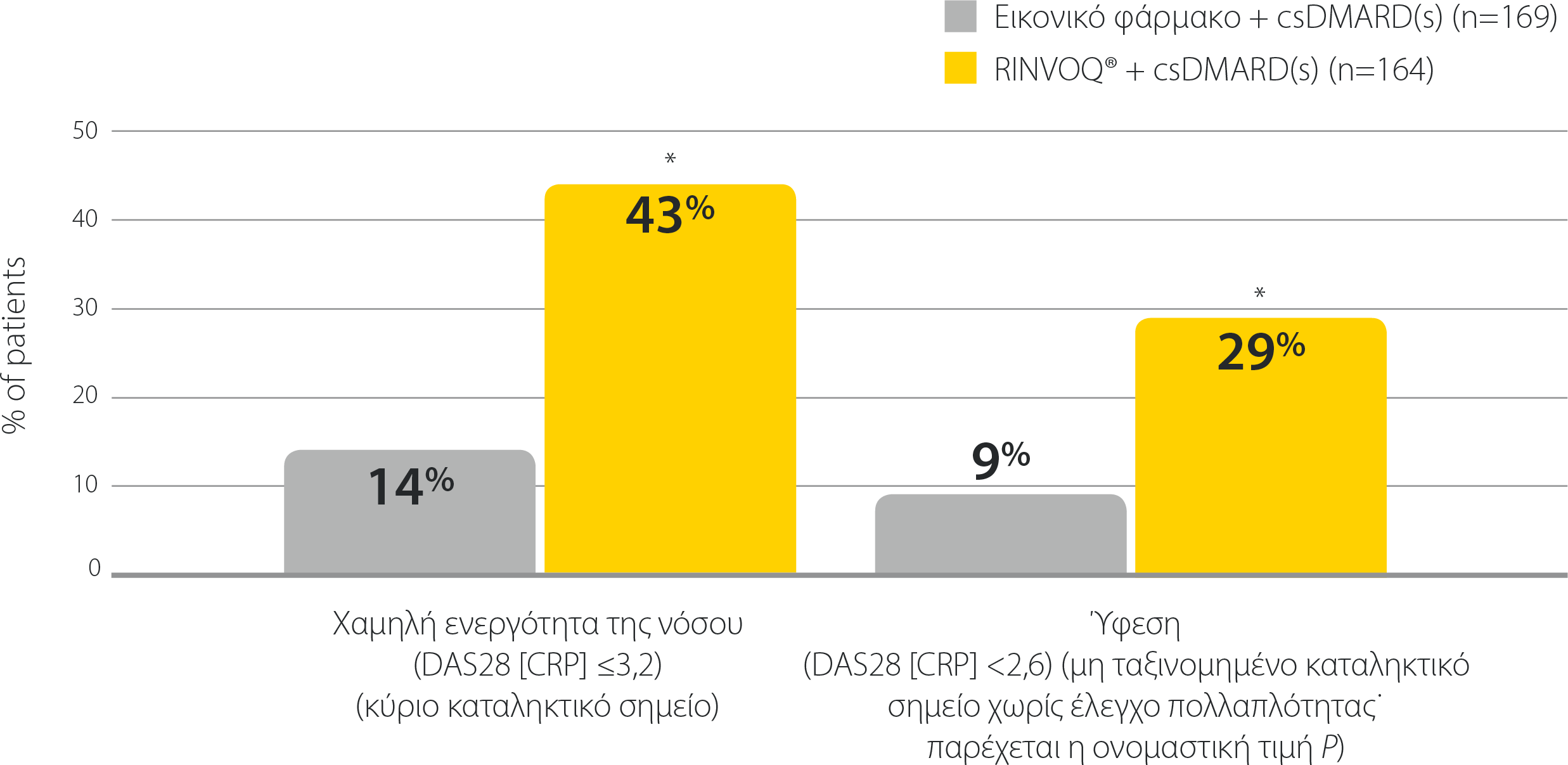
RINVOQ®: Αποτελεσματικότητα σε όλα τα καταληκτικά σημεία
SELECT-BEYOND: Χαμηλή ενεργότητα της νόσου και ύφεση την εβδομάδα 12 σε ασθενείς με ανεπαρκή ανταπόκριση σε bDMARDs (NRI)1,2
*P≤0,001 έναντι εικονικού φαρμάκου + csDMARD(s)
bDMARD: βιολογικό τροποποιητικό της νόσου αντιρευματικό φάρμακο, csDMARD: συμβατικό συνθετικό τροποποιητικό της νόσου αντιρευματικό φάρμακο, DAS28 (CRP): Βαθμολογία Ενεργότητας της Νόσου σε 28 αρθρώσεις (C-αντιδρώσα πρωτεΐνη), NRI: καταλογισμός μη ανταποκριθέντων.
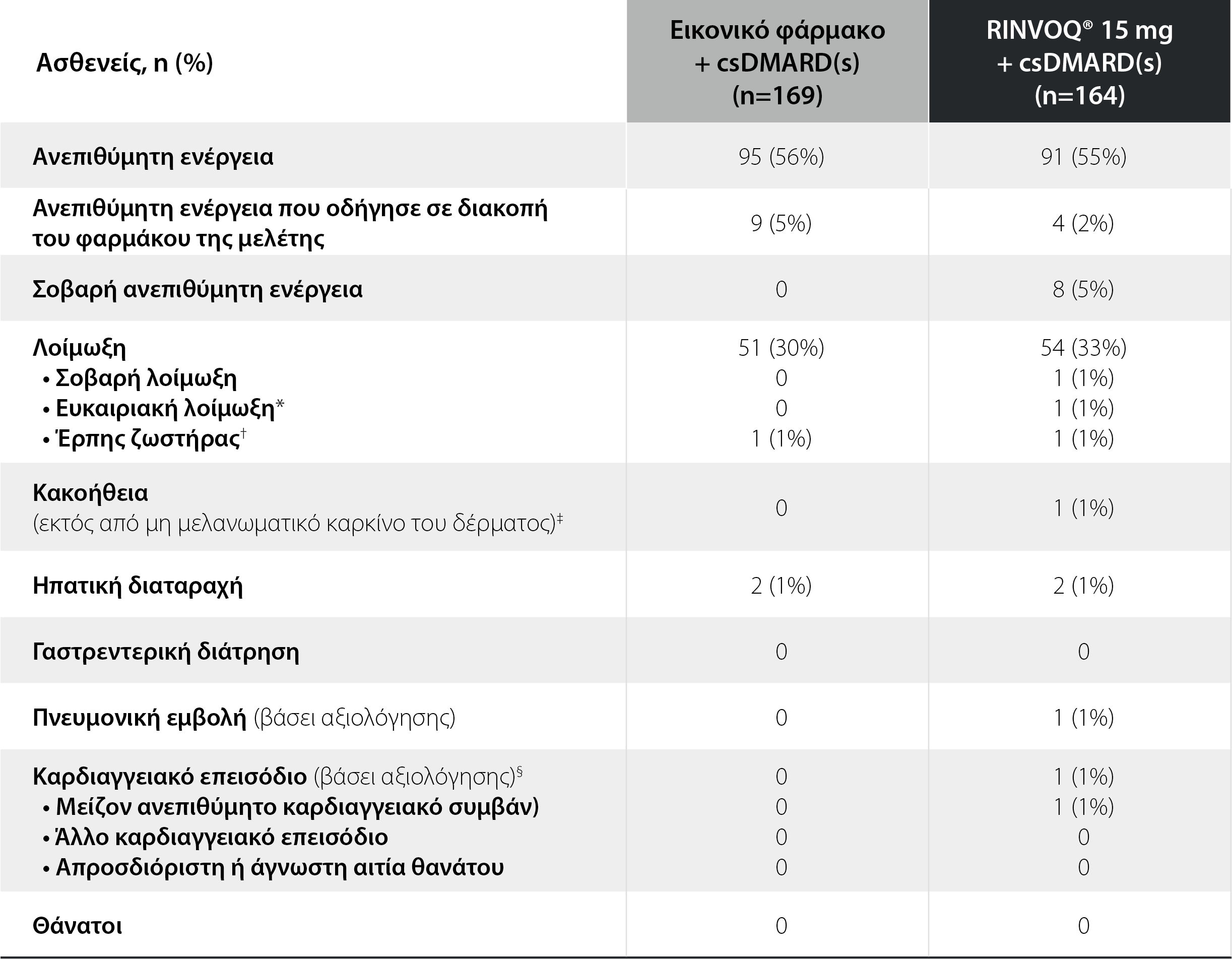
SELECT-BEYOND: Ανεπιθύμητες ενέργειες σε διάστημα 12 εβδομάδων θεραπείας1
Κανένας ασθενής δεν ανέφερε φυματίωση, μη μελανωματικό καρκίνο του δέρματος ή λέμφωμα.
*Στοματικές καντιντιάσεις.
†Τα περισσότερα συμβάντα ήταν ήπια και όλα, εκτός από 1 αφορούσαν προσβολή ενός δερματομίου˙ 2 συμβάντα ήταν σοβαρά.
‡Ένα κακοήθες μελάνωμα στην ομάδα του RINVOQ 15 mg, κατά τις Εβδομάδες 0–12.
§Ένα ισχαιμικό εγκεφαλικό επεισόδιο τις εβδομάδες 0-12 στην ομάδα του RINVOQ® 15 mg.
References
- Genovese MC, Fleischmann R, Combe B, et al. Safety and efficacy of upadacitinib in patients with active rheumatoid arthritis refractory to biologic disease- modifying anti-rheumatic drugs (SELECT-BEYOND): a double-blind, randomised controlled phase 3 trial. Lancet. 2018;391(10139):2513-2524. doi:10.1016/S0140- 6736(18)31116-4
- RINVOQ® Περίληψη Χαρακτηριστικών Προϊόντος, 12-2023.