Ρευματοειδής αρθρίτιδα
Το RINVOQ ενδείκνυται για τη θεραπεία της μέτριας έως σοβαρής ενεργού ρευματοειδούς αρθρίτιδας σε ενήλικες ασθενείς, οι οποίοι έχουν ανταποκριθεί ανεπαρκώς σε, ή οι οποίοι εμφανίζουν δυσανεξία σε ένα ή περισσότερα τροποποιητικά της νόσου αντιρευματικά φάρμακα (DMARDs). Το RINVOQ μπορεί να χρησιμοποιηθεί ως μονοθεραπεία ή σε συνδυασμό με μεθοτρεξάτη.
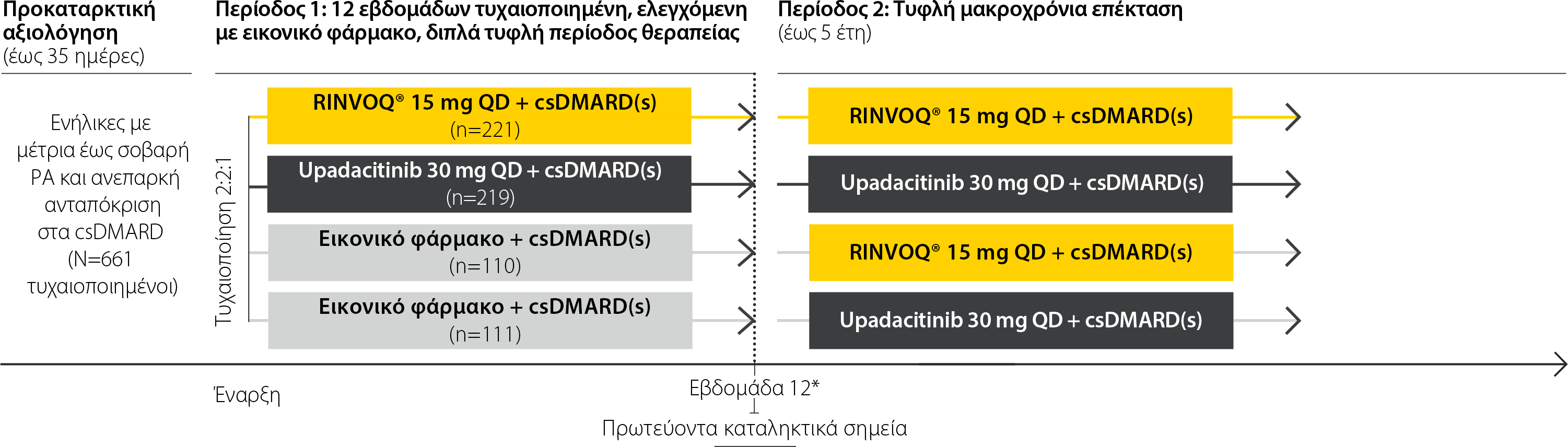
SELECT-NEXT: Σχεδιασμός μελέτης
Μια μελέτη φάσης III για τη διερεύνηση της αποτελεσματικότητας και της ασφάλειας του σχήματος RINVOQ® + csDMARDs σε σύγκριση με εικονικό φάρμακο + csDMARDs σε ασθενείς με μέτρια έως σοβαρή ΡΑ και ανεπαρκή ανταπόκριση σε csDMARDs1
Τα csDMARDs που επιτρέπονταν ως θεραπεία υποβάθρου ήταν από του στόματος και παρεντερικά χορηγούμενη MTX, σουλφασαλαζίνη, υδροξυχλωροκίνη, χλωροκίνη, και λεφλουνομίδη. Επιτρεπόταν η συγχορήγηση έως 2 csDMARDs ως ταυτόχρονων θεραπειών υποβάθρου, εξαιρουμένου του συνδυασμού MTX και λεφλουνομίδης.
*Από την εβδομάδα 12 και μετά, οι ασθενείς που αρχικά τυχαιοποιήθηκαν να λάβουν εικονικό φάρμακο κατά την έναρξη άλλαξαν σε RINVOQ 15 mg ή upadacitinib 30 mg σύμφωνα με την προκαθορισμένη αντιστοίχιση της τυχαιοποίησης. Οι ασθενείς που αντιστοιχήθηκαν στο RINVOQ 15 mg ή σε upadacitinib 30 mg συνέχισαν τη δόση που είχε καθοριστεί για αυτούς.
Κύρια
RINVOQ® 15 mg + csDMARD(s) και upadacitinib 30 mg + csDMARD(s) έναντι εικονικού φαρμάκου+ csDMARD(s) την εβδομάδα 12 για DAS28 (CRP) <3,2 (EMA) ή ACR20 (FDA)
Ασφάλεια
Ανεπιθύμητες ενέργειες, σοβαρές ανεπιθύμητες ενέργειες, ανεπιθύμητες ενέργειες ειδικού ενδιαφέροντος (π.χ. σοβαρές λοιμώξεις, ευκαιριακές λοιμώξεις, MACE, VTE, κακοήθειες)
- Ασθενείς ηλικίας ≥18 ετών ήταν επιλέξιμοι για ένταξη.
- Διάγνωση ΡΑ ≥3 μηνών σύμφωνα με τα κριτήρια ταξινόμησης των ACR/EULAR 2010 για τη ΡΑ με ενεργό νόσο (τουλάχιστον 6 διογκωμένες αρθρώσεις από τις 66, τουλάχιστον 6 ευαίσθητες αρθρώσεις από τις 68, και τιμή hsCRP ίση με 3 mg/L ή μεγαλύτερη).
- Είχαν λάβει csDMARDs για ≥3 μήνες και λάμβαναν σταθερή δόση για ≥4 εβδομάδες πριν από την έναρξη της μελέτης.
- Οι ασθενείς έπρεπε να έχουν ανεπαρκή ανταπόκριση σε τουλάχιστον 1 προηγούμενη θεραπεία με csDMARD (MTX, σουλφασαλαζίνη ή λεφλουνομίδη).
- Οι ασθενείς με προηγούμενη έκθεση το ανώτερο σε 1 bDMARD ήταν επιλέξιμοι (έως 20% του συνολικού αριθμού ασθενών της μελέτης), εάν είχαν είτε περιορισμένη έκθεση (<3 μήνες) είτε έπρεπε να διακόψουν την αγωγή με bDMARD λόγω δυσανεξίας.
- Χωρίς προηγούμενη έκθεση σε αναστολέα JAK ή προηγούμενη ανεπαρκή ανταπόκριση σε bDMARDs.
Η εγκεκριμένη δόση του RINVOQ® είναι 15 mg μία φορά την ημέρα. Το upadacitinib 30 mg QD δεν αποτελεί εγκεκριμένη δόση.
ACR: Αμερικανικό Κολλέγιο Ρευματολογίας, ACR20:βελτίωση τουλάχιστον 20% στα βασικά κριτήρια του Αμερικανικού Κολλεγίου Ρευματολογίας, bDMARD: βιολογικό τροποποιητικό της νόσου αντιρευματικό φάρμακο, csDMARD: συμβατικό συνθετικό τροποποιητικό της νόσου αντιρευματικό φάρμακο, DAS28 (CRP): Βαθμολογία Ενεργότητας της Νόσου σε 28 αρθρώσεις (C-αντιδρώσα πρωτεΐνη), EMA: Ευρωπαϊκός Οργανισμός Φαρμάκων, EULAR: Ευρωπαϊκή Εταιρεία κατά του Ρευματισμού, FDA: Αμερικανικός Οργανισμός Τροφίμων και Φαρμάκων, hsCRP: υψηλής ευαισθησίας C-αντιδρώσα πρωτεΐνη, JAK: κινάση Janus, MACE: Μείζον ανεπιθύμητο καρδιαγγειακό συμβάν, MTX: μεθοτρεξάτη; QD: άπαξ ημερησίως, SF-36: Σύντομο Έντυπο (36 Στοιχείων) Έρευνας Υγείας, VTE: φλεβική θρομβοεμβολή.
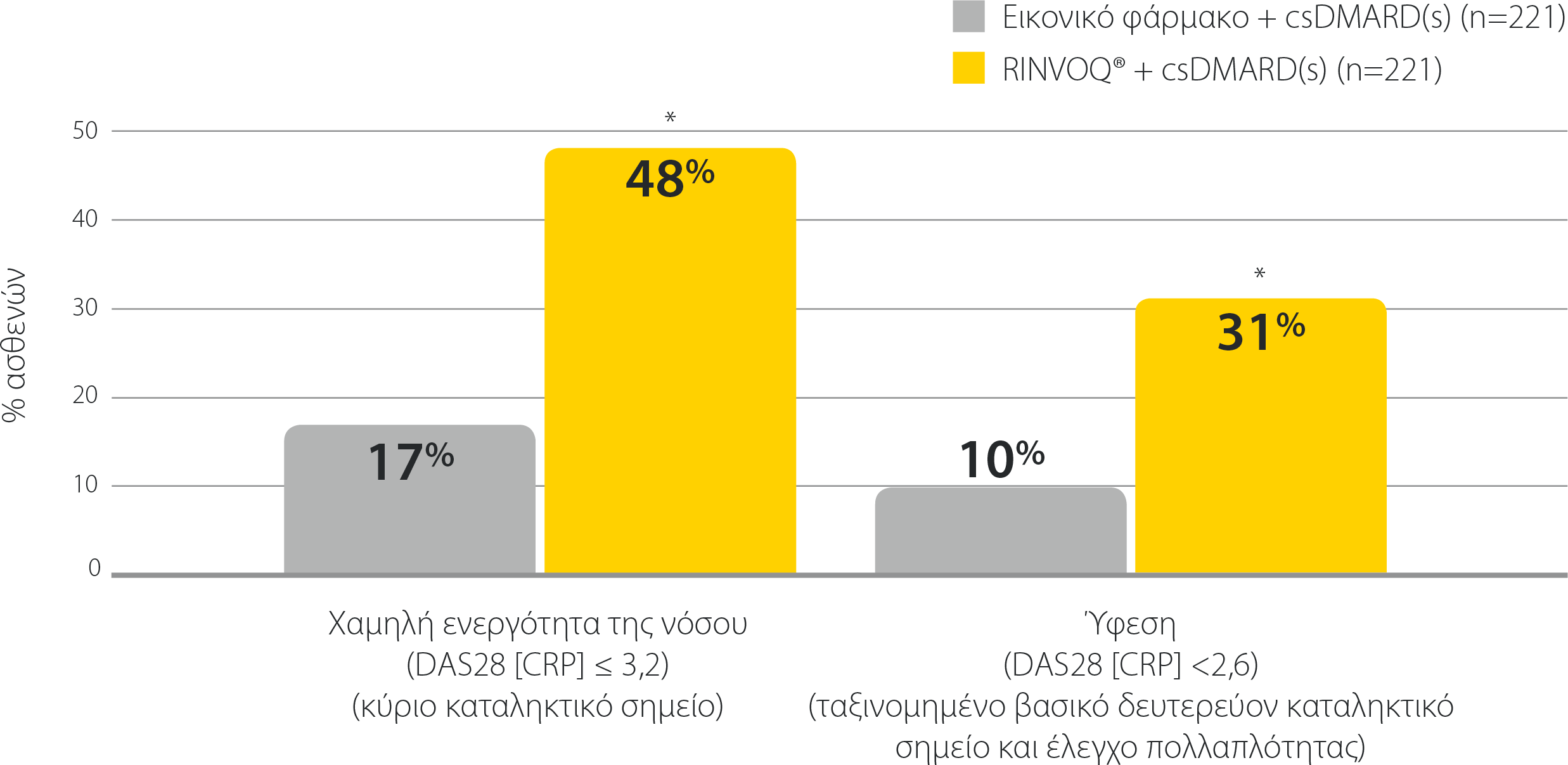
RINVOQ®: Αποτελεσματικότητα σε συνδυασμό με csDMARDs μετά από ανεπαρκή ανταπόκριση σε csDMARDs
SELECT-NEXT: Χαμηλή ενεργότητα της νόσου και ύφεση την εβδομάδα 12 σε ασθενείς με ανεπαρκή ανταπόκριση σε csDMARDs (NRI)1,2
*P≤0,001 έναντι εικονικού φαρμάκου + csDMARD(s)
csDMARD: συμβατικό συνθετικό τροποποιητικό της νόσου αντιρευματικό φάρμακο, DAS28 (CRP): Βαθμολογία Ενεργότητας της Νόσου σε 28 αρθρώσεις (C-αντιδρώσα πρωτεΐνη), NRI: καταλογισμός μη ανταποκριθέντων.
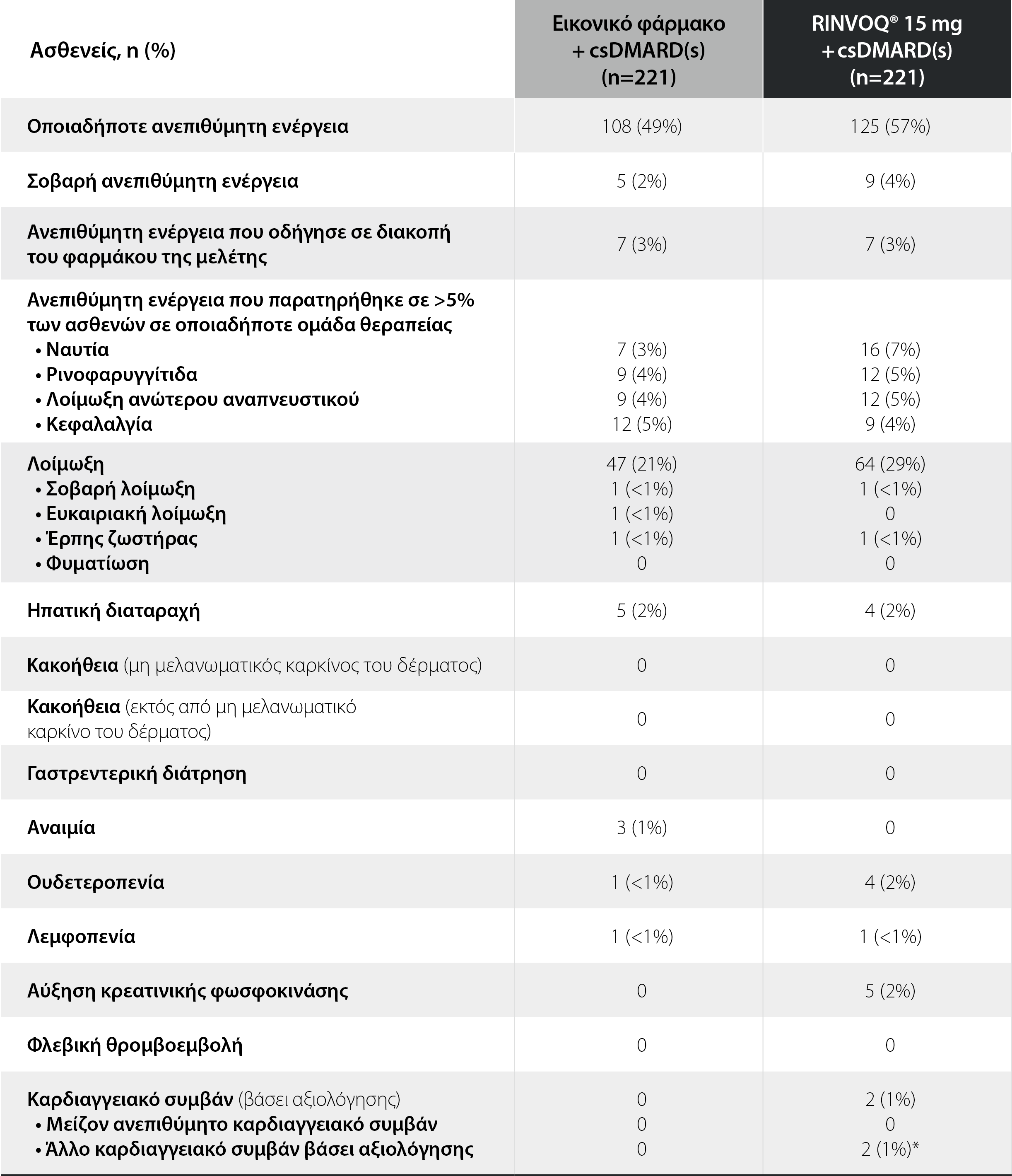
SELECT-NEXT: Ανεπιθύμητες ενέργειες σε διάρκεια 12 εβδομάδων θεραπείας1
References
- Burmester GR, Kremer JM, Van den Bosch F, et al. Safety and efficacy of upadacitinib in patients with rheumatoid arthritis and inadequate response to conventional synthetic disease-modifying anti-rheumatic drugs (SELECT-NEXT): a randomised, double-blind, placebo-controlled phase 3 trial. Lancet. 2018; 391(10139): 2503-2512. doi:10.1016/S0140-6736(18)31115-2.
- RINVOQ® Περίληψη Χαρακτηριστικών Προϊόντος, 12-2023.