L’apoptosi
Meccanismi di morte cellulare programmata in condizioni fisiologiche e patologiche
Se una cellula prolifera o muore richiede un insieme complesso di decisioni cellulari che dipendono dall’ambiente e dalle sue condizioni fisiche e nutrizionali. Il signaling nelle cellule è regolato in maniera ottimale attraverso un’ampia gamma di macromolecole e messaggeri che controlla il destino della cellula creando varie reti interconnesse di regolatori ed effettori.1
La morte cellulare programmata o apoptosi è un meccanismo cruciale per tutti gli organismi pluricellulari per controllare la proliferazione cellulare e mantenere l’omeostasi tissutale, così come eliminare cellule dannose o non necessarie dall’organismo.2
L’apoptosi spesso si verifica come risultato di una varietà di fattori, come per esempio il danno genomico, lo stress cellulare, il turbamento dell’omeostasi del calcio, la chiusura dei canali anionici voltaggio-dipendenti (VDAC, voltage-dependent anion channel) che inibiscono gli scambi metabolici tra i mitocondri e il citoplasma, eccetera.1
L’apoptosi si differenzia in modo sostanziale dagli altri tipi di morte cellulare in termini di incidenza, morfologia e biochimica:
- Le alterazioni morfologiche peculiari delle cellule apoptotiche includono la condensazione e la frammentazione del nucleo, il restringimento cellulare, il blebbing dinamico della membrana e la perdita di adesione alla matrice extracellulare o alle cellule vicine.2 I frammenti cellulari e degli organelli e i blebs iniziano a formare i corpi apoptotici, che vengono poi internalizzati dai macrofagi o dalle cellule vicine per endocitosi/fagocitosi. L’assenza di rilascio dei componenti cellulari nel fluido extracellulare comporta l’assenza di infiammazione (Figura 1).1
- Le alterazioni biochimiche consistono nel clivaggio del DNA cromosomiale nei frammenti internucleosomiali, l’esternazione della fosfatidilserina e l’attivazione di una famiglia di proteasi note come caspasi.2
Inizialmente, Hanahan e Weinberg proposero 6 alterazioni essenziali della fisiologia cellulare che contribuiscono tutte assieme alla trasformazione maligna (Figura 1)
Figura 1. Citologia dell’apoptosi. Tratto da Fig. 4, ref. 1.
Il processo della morte cellulare apoptotica, per com’è definita a livello molecolare, è unico nei Metazoi (animali).3 L’identificazione dei meccanismi apoptotici è cruciale e facilita la comprensione della patogenesi delle malattie che derivano da un’apoptosi disfunzionale.2
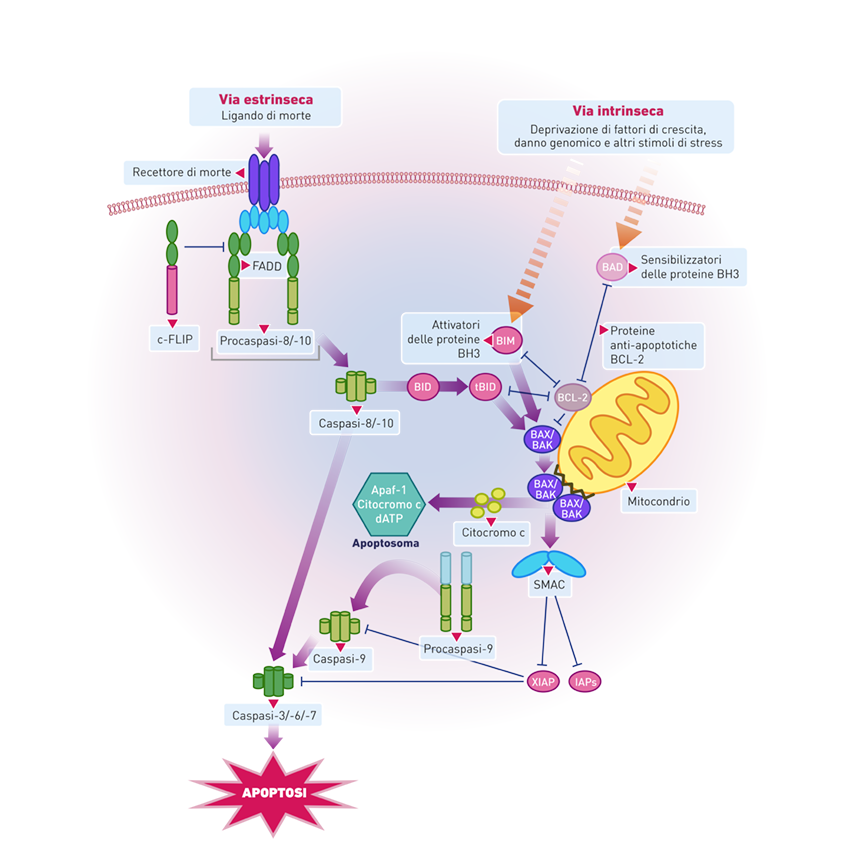
Nei mammiferi, ci sono due pathway apoptotici centrali (Figura 2):
- La via estrinseca (pathway mediato dai recettori di morte);
- La via intrinseca (pathway mediato dai mitocondri).2
Entrambi i pathway convergono a livello dei mitocondri attraverso la proteina tBID (truncated BH3-interacting domain).4 I segnali della via estrinseca e intrinseca alla fine inducono la permeabilizzazione della membrana mitocondriale esterna al citocromo c e ad altre proteine dello spazio intermembrana mitocondriale. Quando queste proteine vengono rilasciate nel citosol, si verificano altri eventi di segnalazione che attivano la cascata delle caspasi che clivano diversi substrati nucleari e citoplasmatici che conducono alla morte della cellula. Infatti, nello spazio intermembrana mitocondriale risiedono diverse proteine pro-apoptotiche, e quando l’integrità della membrana mitocondriale esterna è compromessa, fuoriescono e causano l’attivazione degli apoptosomi, la condensazione della cromatina, il blebbing della membrana e la distruzione della membrana nucleare.1
Figura 2. Via intrinseca e via estrinseca dell’apoptosi. Tratto da Fig. 1, ref. 5.
Oltre a queste due vie, ci sono pathway aggiuntivi di attivazione delle caspasi che sono meno noti, tra cui il ruolo iniziatrice della caspasi-12 o della caspasi-2 nell’apoptosi attivata dallo stress del reticolo endoplasmatico. Il pathway della perforina/granzima è un’altra via che coinvolge la citotossicità mediata dai linfociti T. Questo pathway induce l’apoptosi sia attraverso il granzima A sia attraverso il granzima B.2
Le caspasi
L’apoptosi è principalmente eseguita da una famiglia di proteasi note come caspasi (proteasi cistenil aspartato-specifiche).5 Esistono tre tipi di caspasi mammifere in base alle loro specifiche funzioni nelle diverse vie, ovvero i pathway di sviluppo, infiammatori ed apoptotici. Perciò, alcune caspasi (come la caspasi-1) non hanno un ruolo nell’esecuzione dell’apoptosi, mentre diverse caspasi hanno duplici ruoli sia nel signaling apoptotico che non-apoptotico. In aggiunta, sulla base della loro posizione nelle cascate del signaling apoptotico, le caspasi sono classificate come:
- Caspasi iniziatrici (caspasi-8 e -9) e
- Caspasi effettrici o esecutrici (caspasi-3, -6 e -7).2
In quanto attori fondamentali delle vie di segnalazione che inducono la morte, la regolazione dell’attivazione delle caspasi deve essere soggetta a diversi livelli di controllo, per assicurare che la morte cellulare apoptotica sia innescata solo sotto condizioni appropriate.5 Le caspasi iniziatrici sono prodotte come zimogeni inattivi composti da un prodominio contenente un dominio di reclutamento delle caspasi (CARD, caspase-recruitment domain) o dominio effettore di morte (DED, death effector domain), una subunità grande e una subunità piccola. Le caspasi iniziatrici vengono reclutate attraverso i loro prodomini in ampie piattaforme di attivazione e attivate per dimerizzazione. Al contrario, le caspasi effettrici sono attivate per clivaggio dello zimogeno tra la subunità grande e quella piccola, e sono perciò dipendenti dalle caspasi iniziatrici per la loro attivazione. Le caspasi cataliticamente attive sono composte da un eterotetramero di due subunità grandi e due subunità piccole (Figura 3).6
Figura 3. La famiglia delle caspasi. Tratto da Fig. 1, ref. 6.
La proteolisi irreversibile ed estesa conseguente all’attivazione delle caspasi effettrici, e la successiva induzione della morte cellulare, può essere innescata dalla via del recettore di morte o dalla via mitocondrio-dipendente, rispettivamente note come via estrinseca e via intrinseca dell’apoptosi.5
La via estrinseca
La stimolazione della via estrinseca è innescata dall’associazione dei recettori di morte sulla superficie cellulare, un sottogruppo appartenente alla superfamiglia del recettore del fattore di necrosi tumorale (TNF, tumor necrosis factor), con i loro rispettivi ligandi citochinici attivanti (noti anche come ligandi di morte), membri della famiglia di proteine TNF. I membri della famiglia di TNF sono per lo più sintetizzati come proteine transmembrana di tipo II che si assemblano in omotrimeri biologicamente attivi.5
Tra i sistemi recettore di morte-ligando più largamente studiati vi sono:
- il sistema TNF recettore-1 (TNFR-1)-TNF (noto anche come TNF-α),
- FAS (APO-1, CD95)-FASL,
- il ligando induttore dell’apoptosi correlato a TNF (TRAIL, TNF-related apoptosis inducing ligand) recettore-1 (TRAILR-1, DR-4) e TRAIL recettore-2 (TRAILR-2, DR-5)-TRAIL.5
La trasduzione del segnale mediante i recettori di morte implica l’oligomerizzazione del recettore mediante l’aggregazione di un motivo intracellulare comune ai membri della famiglia dei recettori di morte, noto come dominio di morte (DD, death domain). Il legame con il ligando porta al reclutamento di proteine adattatrici contenenti il dominio DD, come le proteine con dominio di morte associate a FAS (FADD, FAS-associated death domain proteins) e le proteine con dominio di morte associate a TNFR-1, ai domini dei recettori aggregati mediante interazioni DD-DD. Queste proteine adattatrici includono un modulo di interazione proteica omotipica addizionale, il dominio effettore di morte (DED, death effector domain), che sequestra lo zimogeno inattivo delle caspasi iniziatrici (caspasi-8 e -10) con un DED al loro prodominio, formando il complesso che induce il segnale di morte (DISC, death inducing signaling complex). La formazione del DISC media l’oligomerizzazione e la conseguente attivazione della caspasi-8. L’attivazione delle caspasi effettrici, tra cui la caspasi-3, la caspasi-6 e la caspasi-7, da parte delle caspasi iniziatrici attivate a monte ha come conseguenza il clivaggio di numerosi substrati delle caspasi e la successiva morte della cellula (Figura 4).5
Figura 4. La via estrinseca dell’apoptosi. Tratto da Fig. 1, ref. 7.
In risposta alla stimolazione del recettore di morte, l’entità dell’attivazione della caspasi-8 al DISC può essere insufficiente per provocare l’apoptosi e perciò un segnale apoptotico efficace richiede il coinvolgimento della via intrinseca mitocondriale per la piena attivazione delle caspasi effettrici, come la caspasi-3, e la conseguente induzione della MOMP a valle. Il clivaggio e la conseguente attivazione di BID da parte della caspasi-8 per generare il frammento attivato di BID (tBID) funge da conduttore attraverso il quale viene trasmesso il segnale apoptotico dalla via estrinseca alla via intrinseca. In questo scenario, l’attività della caspasi-8 indotta dal signaling del recettore di morte è adeguata a clivare la BID citosolica full-length e provocare la produzione di tBID e la sua traslocazione nei mitocondri, che porta al rilascio dei fattori apoptogenici. Queste molecole pro-apoptotiche promuovono in ultima istanza l’attivazione della caspasi effettrice-3 e la conseguente attivazione della caspasi-8, generando così un loop di feedback per amplificare la risposta apoptotica.5
La via intrinseca
La via mitocondriale dell’apoptosi, chiamata anche via intrinseca, è il meccanismo apoptotico più comune nei vertebrati. È attivata in risposta a una varietà di stress cellulari, tra cui il danno genomico, la deprivazione di fattori di crescita, lo stress al reticolo endoplasmatico, e segnali ambientali.6 Inoltre, può essere attivata dalla radiazione UV e gamma, dal calore, da fattori di virulenza virale e dall’attivazione di alcuni fattori oncogenici.5
Questi segnali di stress sono riconosciuti da molteplici componenti intracellulari che inviano il segnale ai mitocondri, risultando nella permeabilizzazione della membrana mitocondriale esterna (MOMP, mitochondrial outer membrane permeabilization). Le molecole responsabili del controllo dell’induzione della MOMP sono regolatori centrali dell’apoptosi, poiché la MOMP è considerata un evento critico nella via mitocondriale che invia la cellula all’apoptosi.5
Di conseguenza, la famiglia di proteine BCL-2 funge da “switch apoptotico” mediando la permeabilizzazione della membrana mitocondriale. La famiglia BCL-2 include regolatori della via intrinseca sia prosia anti-apoptotici. Ogni membro della famiglia BCL-2 contiene almeno uno dei quattro domini conservati noti come domini BH (BCL-2 homology, BH1-4).5
Ci sono tre ampie classi di proteine BCL-2:
- Le proteine effettrici pro-apoptotiche (BAX e BAK), che sono necessarie e sufficienti per la MOMP;
- Le proteine anti-apoptotiche BCL-2 che bloccano l’apoptosi;
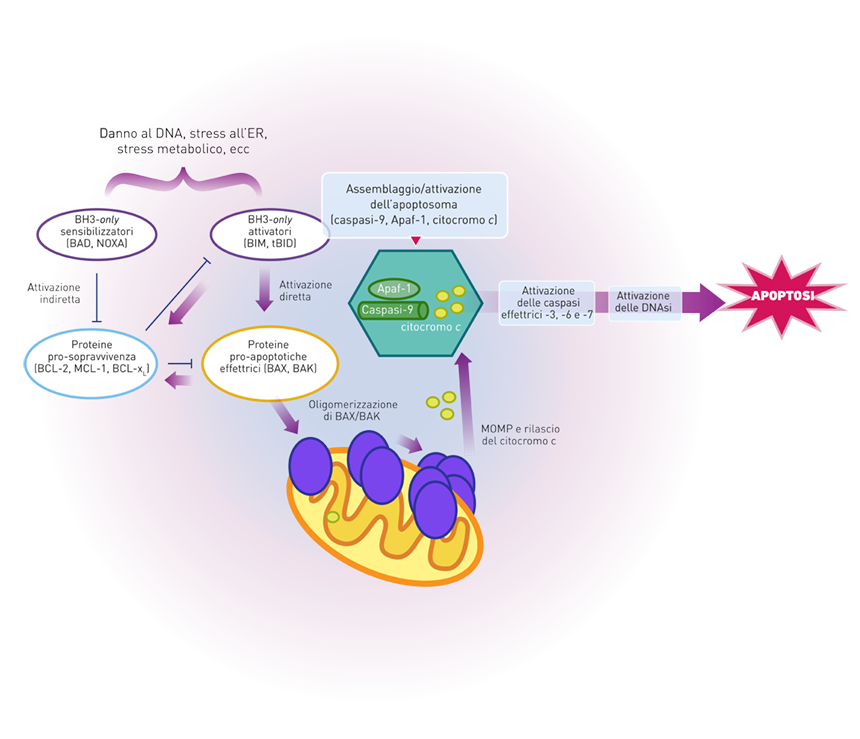
- Le proteine BH3-only che attivano gli effettori pro-apoptotici e/o neutralizzano le proteine anti-apoptotiche BCL-2.6
Gli effettori pro-apoptotici risiedono nella cellula in forme inattive legate alla membrana mitocondriale esterna (BAK) oppure solubili nel citoplasma (BAX). L’attivazione di BAX e BAK è innescata in seguito al legame transiente con un sottogruppo di proteine BH3-only che fungono da attivatori diretti. Le proteine anti-apoptotiche BCL-2 inibiscono la MOMP sequestrando le proteine attivatrici dirette e/o gli effettori. Un altro gruppo di proteine BH3-only, chiamate sensibilizzatori o derepressori, promuove la MOMP antagonizzando le proteine anti-apoptotiche BCL-2, rilasciando così sia le proteine BH3-only attivatrici dirette sia BAX e BAK (Figura 5).6
Figura 5. Meccanismi di regolazione della MOMP. Tratto da Fig. 3C, ref. 6.
BAX e BAK sono i diretti responsabili della perdita dell’integrità della membrana mitocondriale esterna. Una volta attivate, formano ampi oligomeri che si inseriscono nella membrana mitocondriale esterna, compromettendola (Figura 6). BAX e BAK agiscono in modo ridondante sulla MOMP e almeno una di esse è necessaria per permeabilizzare i mitocondri.6
Figura 6. Azione di BAX e BAK sulla membrana mitocondriale esterna. Tratto da Fig. 3B, ref. 6.
La MOMP induce varie proteine, normalmente confinate nello spazio intermembrana mitocondriale (IMS, intermembrane mitochondrial space), a diffondere nel citosol. Tra le proteine che sfuggono dall’IMS, un insieme di proteine, note come fattori apoptogenici, giocano un ruolo vitale nell’iniziazione mitocondrio-dipendente della cascata delle caspasi che induce la morte cellulare.5
Nel citosol, il fattore apoptogenico citocromo c lega il fattore attivante le proteasi apoptotiche-1 (Apaf-1, apoptotic protease activating factor-1) in un modo dipendente dal dATP per guidare la formazione di un complesso noto come apoptosoma che recluta la procaspasi-9, mediando così l’oligomerizzazione e l’attivazione della caspasi-9. L’attivazione della caspasi-9 porta al processamento e all’attivazione delle caspasi esecutrici -3, -6 e -7 che determinano la morte della cellula (Figura 7).5
Figura 7. La via intrinseca dell’apoptosi. Tratto da Fig. 2, ref. 4.
Meccanismi di regolazione dell’apoptosi
Il processo dell’apoptosi in sé è finemente regolato.1
Punto di controllo 1: controllo dell’apoptosi attraverso la regolazione della MOMP dalle proteine BCL-2
Le proteine BH3-only fungono da rilevatori sensibili degli stimoli apoptotici che trasmettono i segnali di morte alle proteine simil-BAX a valle, i principali effettori della via intrinseca, promuovendo così l’apoptosi. Sotto specifiche condizioni, l’attivazione di alcuni membri della famiglia BH3-only può indurre modificazioni trascrizionali e post-traduzionali distinte.5
È stato proposto che il numero relativamente elevato di proteine BH3-only, insieme ai meccanismi di attivazione unici di particolari proteine BH3-only, contribuiscano alla capacità della cellula di decifrare i segnali da un’ampia varietà di stimoli apoptotici attivando risposte specifiche ai diversi segnali di morte.5
Inoltre, dato che le interazioni tra i membri della famiglia BCL-2 governano l’attivazione di BAX e BAK e la conseguente induzione della MOMP, variazioni nelle attività di legame dei membri della famiglia BCL-2 pro- e anti-apoptotici in risposta a molti stimoli diversi giocano un ruolo fondamentale nel determinare se una cellula vivrà o morirà.5
Punto di controllo 2: inibizione dell’apoptosi mediata da IAP
Considerando che la proteolisi è un processo irreversibile, uno stretto controllo del clivaggio proteolitico mediato dalle caspasi è imperativo per prevenire un’inappropriata distruzione della cellula. Per questo motivo, le cellule utilizzano diversi livelli di regolazione per modulare l’attivazione delle caspasi. Uno di questi livelli di regolazione delle caspasi implica l’inibizione dell’attività delle caspasi da parte delle proteine IAP (inhibitor apoptosis protein).5
Tutti i membri delle proteine IAP contengono almeno un dominio di ripetizione IAP baculovirale (BIR, baculovirus IAP repeat) e molti hanno copie di questo motivo caratteristico delle proteine IAP. I domini BIR delle proteine IAP possono mediare le interazioni con diverse proteine, e la loro capacità di legare direttamente le caspasi può fungere da meccanismo per l’inibizione delle caspasi mediata dalle proteine IAP.5
È stato scoperto che diverse proteine IAP giocano un ruolo complesso nel modulare le vie di segnalazione che attivano i fattori di trascrizione NF-κB. I membri di questa famiglia di fattori di trascrizione sono regolatori chiave di una serie di processi fisiologici, tra cui le risposte immunitarie innate e adattative, l’infiammazione e la sopravvivenza cellulare, e la loro consolidata attività di indurre l’espressione dei geni che codificano per proteine anti-apoptotiche è stata riconosciuta come un mezzo importante di soppressione dell’apoptosi e di promozione della sopravvivenza cellulare.5
Punto di controllo 3: regolazione dell’apoptosi da parte di c-FLIP
c-FLIP è una proteina che contiene un dominio DED che viene reclutata nel DISC e regola l’attivazione della caspasi-8 nella via di segnalazione del recettore di morte. Ad alti livelli di espressione, tutte e tre le isoforme di c-FLIP sono reclutate al DISC attraverso le interazioni con il DED e successivamente compromettono il signaling apoptotico indotto dal recettore di morte bloccando l’attivazione della caspasi-8. La funzione di c-FLIP nel bloccare l’attivazione della caspasi-8 a livello del DISC è riconosciuta come un importante punto di controllo sull’attività delle caspasi per proteggere la cellula dalla distruzione involontaria.5
Ruolo dell’apoptosi nel cancro
Un segnale apoptotico adeguato è di fondamentale importanza per preservare un sano equilibrio tra la morte e la sopravvivenza della cellula e nel mantenere l’integrità del genoma, come evidenziato dal riconoscimento dell’evasione dell’apoptosi come hallmark of cancer.2
I pathway apoptotici possono essere alterati dalle cellule tumorali dal punto di vista trascrizionale, traduzionale e post-traduzionale. Soprattutto, questi meccanismi non sono esclusivi e le cellule tumorali possono utilizzare un numero di strategie diverse per evadere l’apoptosi (Figura 8).2
Figura 8. Meccanismi che contribuiscono all’evasione dell’apoptosi e alla carcinogenesi. Tratto da Fig. 2, ref. 8.
Squilibrio tra le proteine BCL-2
Sono state descritte diverse proteine che svolgono attività pro- o anti-apoptotica nella cellula: il rapporto tra queste proteine pro- e anti-apoptotiche gioca un ruolo importante nella regolazione della morte cellulare, e la compromissione del loro equilibrio è nota contribuire alla carcinogenesi riducendo l’apoptosi nelle cellule maligne. Per esempio, il disequilibrio tra le proteine BCL-2 pro- e anti-apoptotiche può promuovere la sopravvivenza cellulare.2
TP53
La proteina p53, chiamata anche proteina tumorale 53 (TP53, tumor protein 53) è uno degli oncosoppressori più noti, codificato dal gene oncosoppressore TP53 localizzato sul braccio corto del cromosoma 17 (17p13.1). Il suo nome deriva dal suo peso molecolare, ovvero 53 kDa. Non solo è coinvolta nell’induzione dell’apoptosi, ma gioca anche un ruolo chiave nella regolazione del ciclo cellulare, nello sviluppo, nel differenziamento, nell’amplificazione genica, nella ricombinazione del DNA, nella segregazione cromosomica e nella senescenza cellulare, ed è perciò chiamato “il guardiano del genoma”.8
Difetti nel gene dell’oncosoppressore TP53 sono stati collegati ad oltre il 50% dei tumori umani. Di recente, è stato riportato che alcuni geni target di TP53 coinvolti nell’apoptosi sono espressi in modo aberrante nelle cellule di melanoma, portando ad un’attività anormale di TP53 e contribuendo alla proliferazione di queste cellule. In aggiunta, è stato trovato che quando TP53 mutato è silenziato, questa down-regolazione dell’espressione di TP53 mutato risulta in una crescita cellulare a colonie ridotta nelle cellule tumorali umane, dovuto all’induzione dell’apoptosi.8
Aumentata espressione delle proteine IAP
Come detto prima, le proteine IAP sono un gruppo di proteine strutturalmente e funzionalmente simili che regolano l’apoptosi, la citochinesi e la trasduzione del segnale. Le proteine IAP sono inibitori endogeni delle caspasi e possono inibire l’attività delle caspasi legando i propri domini conservati BIR ai siti attivi delle caspasi, promuovendo la degradazione delle caspasi attive o mantenendo le caspasi lontane dai loro substrati. È stata riportata un’espressione deregolata delle proteine IAP in diversi tumori. Per esempio, la livina è stata ritrovata altamente espressa nel melanoma e nel linfoma, mentre la survivina è iper-espressa in vari tumori.8
Ridotta attività delle caspasi
Le caspasi rimangono tra gli attori più importanti nell’avvio e nell’esecuzione dell’apoptosi. È perciò ragionevole credere che bassi livelli di caspasi o la compromissione della loro funzione possa portare a un’apoptosi ridotta e alla carcinogenesi. In alcuni casi, più di una caspasi può essere down-regolata, contribuendo alla crescita delle cellule tumorali e allo sviluppo tumorale.8
Signaling compromesso del recettore di morte
Sono state identificate diverse anomalie nella via di segnalazione del recettore di morte che possono portare all’evasione della via estrinseca dell’apoptosi. Queste anomalie includono la down-regolazione del recettore o la compromissione della sua funzione a prescindere dal meccanismo o dal tipo di difetto, così come bassi livelli dei segnali di morte: tutte queste anomalie contribuiscono ad un signaling compromesso e perciò ad una riduzione dell’apoptosi.8
Clicca per scaricare lo slide-kit
Clicca per scaricare la brochure
Bibliografia
- Abou-Ghali M, Stiban J. Regulation of ceramide channel formation and disassembly: insight on the initiation of apoptosis. Saudi J Biol Sci. 2015;22(6):760-772.
- Goldar S, et al. Molecular mechanisms of apoptosis and roles in cancer development and treatment. Asian Pac J Cancer Prev. 2015;16(6):2129-2144.
- Green DR, Fitzgerald P. Just so stories about the evolution of apoptosis. Curr Biol. 2016;26:R620-R627.
- Valentin R, et al. The rise of apoptosis: targeting apoptosis in hematologic malignancies. Blood. 2018;132(12):1248-1264.
- Plati J, et al. Apoptotic cell signaling in cancer progression and therapy. Integr Biol (Camb). 2011;3(4):279-296.
- Green DR, Llambi F. Cell death signaling. Cold Spring Harb Perspect Biol. 2015;7:a006080.
- Yuan X, et al. Developing TRAIL/TRAIL-death receptor-based cancer therapies. Cancer Metastasis Rev. 2018;37(4):733-748.
- Wong SRY. Apoptosis in cancer: from pathogenesis to treatment. J Exp Clin Cancer Res. 2011;30:87
IT-ONC-210002