Gli “Hallmarks of Cancer”
Meccanismi genetici e molecolari alla base dello sviluppo e della crescita delle neoplasie
È ormai noto come la tumorigenesi nell’uomo sia un processo multistep, le cui fasi riflettono alterazioni genetiche che guidano la progressiva trasformazione delle cellule normali in cellule altamente maligne.
Le cellule tumorali presentano alterazioni nei circuiti di regolazione che governano la proliferazione cellulare e l’omeostasi. Sono state identificate oltre 100 tipologie distinte di cancro, e all’interno di specifici organi possono essere trovati diversi sottotipi tumorali. Questa complessità provoca una serie di domande:1
- Quanti circuiti regolatori diversi devono essere alterati affinché una cellula diventi cancerosa?1
- Sono sempre gli stessi circuiti regolatori ad essere alterati nelle diverse forme neoplastiche?1
- Quali di questi sistemi agiscono in maniera autonoma, e quali dipendono dai segnali che la cellula riceve dall’ambiente circostante?1
- È possibile che gruppi ampi e diversi di geni associati al cancro possano dipendere dalle azioni di piccoli gruppi di circuiti regolatori?1
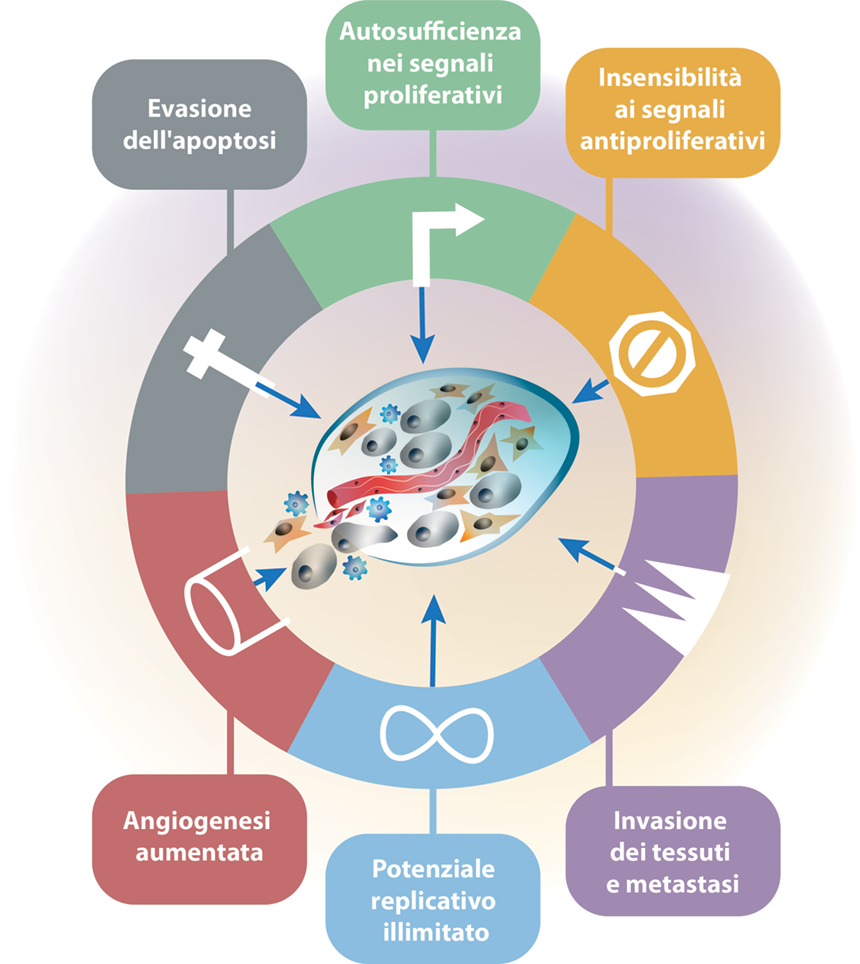
Inizialmente, Hanahan e Weinberg proposero 6 alterazioni essenziali della fisiologia cellulare che contribuiscono tutte assieme alla trasformazione maligna (Figura 1)
Figura 1. I primi 6 “Hallmarks of Cancer”. Tratto da Fig. 1, ref. 1.
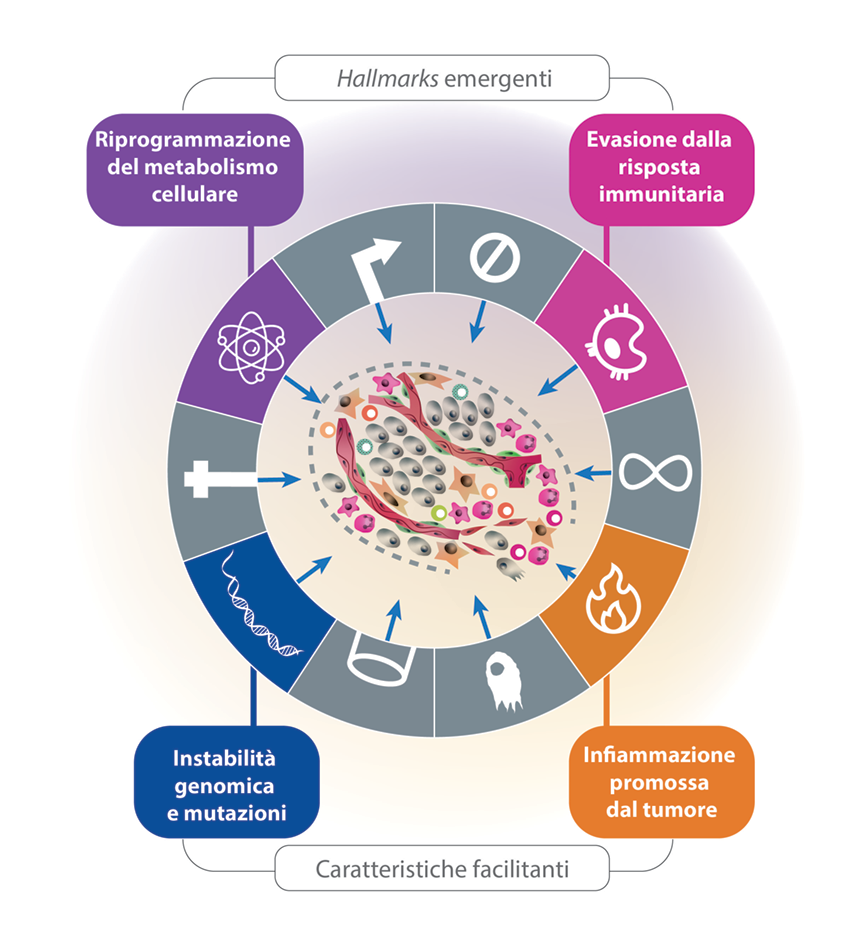
Nel 2011, Hanahan e Weinberg hanno evidenziato come sempre più nuovi studi abbiano suggerito che altri due hallmark siano coinvolti nella patogenesi di alcuni tumori, se non tutti. In aggiunta, due ulteriori capacità facilitano l’acquisizione sia dei primi hallmark presentati, sia di quelli emergenti (Figura 2).2
Figura 2. Hallmark emergenti e caratteristiche facilitanti aggiuntivi. Tratto da Fig. 3, ref. 2.
Gli autori suggeriscono che la maggioranza dei tumori, se non tutti, possano acquisire lo stesso set di capacità funzionali durante il loro sviluppo, anche se attraverso meccanismi diversi.1 Infatti, man mano che si sviluppa, ogni tumore incontra una serie di barriere e ostacoli che devono essere superati o aggirati, alcuni dei quali sono tessuto-specifici e perciò richiedono soluzioni tessuto-specifiche affinché il tumore possa crescere abbondantemente e progredire verso la malignità. Ma anche nell’affrontare la stessa sfida, tumori differenti possono risolvere il problema in modi diversi, sviluppando mutazioni e adattamenti distintivi che gli permettono di acquisire queste 6-8 capacità.3
Praticamente tutti i tumori mostrano queste capacità, anche se in misura diversa. I mezzi variabili per ottenerle sono incorporati in due capacità facilitanti che hanno ciascuna una variabilità intrinseca: l’instabilità genomica con mutazioni (casuali ma geneticamente selezionate) e l’infiammazione promossa dal tumore; entrambe facilitano in modo dimostrabile l’acquisizione degli hallmarks e allo stesso tempo sono intrinsecamente diverse nella loro manifestazione.3
Gli “Hallmarks of Cancer” permettono di fornire un’utile mappa concettuale per comprendere la complessa biologia dei tumori. Il riconoscimento dell’ampia applicabilità di questi concetti influenzerà sempre più lo sviluppo di nuovi strumenti per la cura dei tumori umani.2
Autosufficienza nei segnali proliferativi
Prima che possano passare da uno stato quiescente ad uno stato proliferativamente attivo, le cellule normali richiedono segnali di crescita mitogenica. Questi segnali sono trasmessi all’interno della cellula da recettori transmembrana che legano diverse classi di molecole di segnale: fattori di crescita solubili, componenti della matrice extracellulare e molecole di adesione/interazione cellula-cellula. Per quanto si sa, nessuna cellula normale può proliferare in assenza di suddetti segnali stimolatori.1
I tumori sono in grado di generare autonomamente i segnali proliferativi di cui necessitano, riducendo così la loro dipendenza dai segnali esogeni (Figura 3).1 Alcuni esempi:
- Capacità di produrre fattori di crescita a cui sono responsivi (stimolazione autocrina): es. PDGF (platelet-derived growth factor) nei glioblastomi; TGF-α (tumor growth factor-alfa) nei sarcomi.1
- Deregolazione dei recettori che trasducono segnali proliferativi: es. iper-espressione di EGFR (epidermal growth factor receptor) nei tumori cerebrali, gastrici e mammari, o di HER-2/neu nei tumori gastrici e mammari.1
- Variazione del tipo di integrine espresse.1
- Alterazione dei componenti intracellulari del signaling, come la cascata SOS-Ras-Raf-MAPK.1
I recettori che trasducono segnali stimolatori possono essi stessi essere oggetto di deregolazione da parte delle cellule tumorali. L’iper-espressione dei recettori potrebbe rendere la cellula tumorale in grado di diventare eccessivamente responsiva a livelli di fattori di crescita nell’ambiente circostante che normalmente non innescherebbero la proliferazione.1
Insensibilità ai segnali antiproliferativi
All’interno dei tessuti normali, una serie di segnali antiproliferativi contribuisce a mantenere la quiescenza delle cellule e l’omeostasi tissutale. Questi segnali sono veicolati da inibitori di crescita solubili oppure da componenti della matrice extracellulare o da inibitori posti sulla superficie delle cellule vicine.1
I segnali antiproliferativi bloccano la crescita in due meccanismi distinti. Le cellule possono essere costrette a uscire dalle fasi attive del ciclo cellulare verso uno stato quiescente (fase G0). In alternativa, le cellule possono essere indotte in modo permanente a rinunciare al loro potenziale replicativo mediante l’entrata in uno stato post-mitotico, normalmente associato con l’acquisizione di specifici tratti associati al differenziamento.1
Le cellule tumorali devono evadere questi segnali in modo da poter proliferare. Molti, e forse tutti, i segnali antiproliferativi sono incanalati attraverso la proteina pRb (retinoblastoma protein). Quando è in uno stato iper-fosforilato, pRb blocca la proliferazione sequestrando e alterando la funzione dei fattori di trascrizione E2F che controllano l’espressione di una banca di geni essenziali per la progressione dalla fase G1 alla fase S del ciclo cellulare. Il malfunzionamento del pathway di pRb libera i fattori E2F e permette quindi la proliferazione, rendendo le cellule insensibili ai fattori antiproliferativi che normalmente operano lungo questa via per bloccare l’avanzata attraverso la fase G1 del ciclo cellulare (Figura 4).1
Figura 4. Inattivazione di pRb e passaggio dalla fase G0 alla fase G1 tardiva. Tratto da Fig. 1, ref. 5.
Una strategia per impedire il differenziamento, invece, coinvolge l’oncogene c-myc, che codifica per un fattore di trascrizione. Durante il normale sviluppo, l’azione pro-replicativa di Myc, in associazione ad un altro fattore, Max, può essere soppiantata da complessi alternativi di Max con un gruppo di fattori di trascrizione Mad; i complessi Mad-Max provocano segnali che inducono il differenziamento. Tuttavia, l’iper-espressione di Myc, osservata in molti tumori, può annullare questo processo, spostando l’equilibrio in favore dei complessi Myc-Max, e perciò impedendo il differenziamento e promuovendo la proliferazione.1
Evasione dall’apoptosi
La capacità dei tumori di crescere non dipende solo dal tasso di proliferazione cellulare ma anche dal tasso di diminuzione della crescita. La morte cellulare programmata, o apoptosi, rappresenta il meccanismo principale di questa diminuzione della crescita cellulare.1
L’apparato apoptotico si divide in due classi di componenti:
- Sensori: responsabili del monitoraggio dell’ambiente extra- e intracellulare per le condizioni di normalità e anormalità che determinano se la cellula deve vivere o morire.1
- Effettori: responsabili diretti della morte cellulare (o apoptosi) della cellula.1
La resistenza all’apoptosi può essere acquisita dalle cellule tumorali mediante varie strategie (Figura 5).1
Figura 5. Meccanismi che contribuiscono all’evasione dall’apoptosi e alla carcinogenesi. Tratto da Fig. 2, ref. 6.
Il meccanismo più frequente riguarda la perdita di regolatori pro-apoptotici mediante mutazioni che coinvolgono il gene oncosoppressore TP53. La conseguente inattivazione funzionale del suo prodotto, la proteina p53, è osservata in oltre il 50% dei tumori umani e provoca la rimozione di un componente chiave del sistema di rilevazione di danno genetico che innesca la cascata effettrice dell’apoptosi. Anche altri segnali pro-apoptotici innescati da altre anomalie, come l’ipossia e l’iper-espressione di oncogeni, si incanalano in parte verso l’apoptosi mediante p53, e perciò sono anch’essi danneggiati in caso di inattivazione di p53.1
Anche l’asse PI3K-AKT/PKB, che trasmette segnali anti-apoptotici, è probabilmente coinvolto nell’attenuare l’apoptosi in una quota sostanziale di tumori umani. Questa via di segnalazione è attivata da fattori extracellulari come IGF-1/2 (insulin-like growth factor-1/2) o IL-3 (interleuchina-3) attraverso segnali intracellulari partiti da Ras, oppure mediante la perdita dell’oncosopressore pTEN, una fosfatasi fosfolipidica che normalmente attenua il segnale di sopravvivenza indotto da AKT.1
In alternativa, i tumori possono aggirare l’apoptosi aumentando l’espressione di regolatori anti-apoptotici, come BCL-2.2
Potenziale proliferativo illimitato
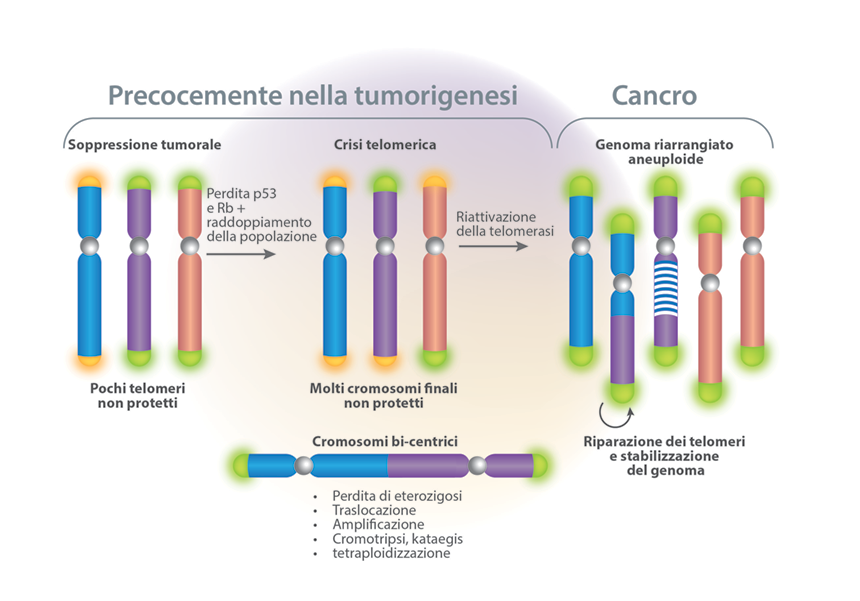
Le tre capacità sopracitate portano allo scollegamento della cellula dai segnali pro- o antiproliferativi provenienti dall’ambiente. Tuttavia, questo di per sé non assicura la crescita espansiva delle cellule tumorali. Infatti, normalmente le cellule in coltura hanno un potenziale proliferativo limitato: una volta che progrediscono attraverso un certo numero di replicazioni, smettono di proliferare in un processo chiamato senescenza. Il conto delle generazioni cellulari è tenuto dalla perdita di 50-100 bp del DNA telomerico alla fine di ogni cromosoma durante ogni ciclo cellulare. La progressiva erosione dei telomeri attraversi successivi cicli di replicazione alla fine causano la perdita della loro abilità di proteggere le estremità del DNA cromosomiale. Le estremità non protette dei cromosomi si fondono tra loro, il che produce uno squilibrio cariotipico associato con la crisi telomerica e risulta, quasi inevitabilmente, nella morte della cellula colpita.1
Il mantenimento dei telomeri è evidente in quasi tutti i tipi di cellule maligne: l’85-90% di esse acquisisce la capacità di up-regolare l’enzima telomerasi, che aggiunge ripetizioni esanucleotidiche alle estremità del DNA telomerico. In questo modo, i telomeri si mantengono di una lunghezza superiore alla soglia critica, che a sua volta permette la moltiplicazione illimitata delle cellule figlie (Figura 6).1
Figura 6. Telomeri e cancro. Tratto da Fig. 3, ref. 7.
Angiogenesi aumentata
L’ossigeno e i nutrienti forniti dai vasi sanguigni sono cruciali per la funzionalità e la sopravvivenza cellulare, obbligando virtualmente tutte le cellule di un tessuto a risiedere entro 100 μm dai capillari. La crescita di nuovi vasi sanguigni, denominata neoangiogenesi, è un processo normalmente transitorio e finemente regolato. Il bilancio dei segnali positivi e negativi incoraggia o blocca l’angiogenesi.1
Alcuni segnali sono veicolati da fattori solubili e i loro recettori posti sull’endotelio, come i fattori pro-angiogenici VEGF (vascular endothelial growth factor) o FGF-1/2 (fibroblast growth factor-1/2), o i fattori anti-angiogenici trombospondina-1 e il suo recettore CD36. Anche le integrine e le molecole di adesione che mediano le interazioni cellula-matrice e cellula-cellula svolgono un ruolo importante. Complessivamente, sono note oltre due dozzine di fattori pro-angiogenici e altrettanti anti-angiogenici.1
La capacità dei tumori di indurre e sostenere la crescita di vasi sanguigni sembra essere acquisita in una fase precisa durante lo sviluppo tumorale, attraverso uno switch angiogenico a partire dalla quiescenza vascolare (Figura 7). La neovascolarizzazione sembra essere un prerequisito essenziale per la rapida espansione clonale associata con la formazione di tumori macroscopici.1
I tumori sembrano attivare lo switch angiogenico variando l’equilibrio tra i fattori pro- e anti-angiogenici. Una strategia comune coinvolge l’alterazione della trascrizione genica. Molti tumori mostrano un’aumentata espressione di VEGF e/o FGF rispetto ai tessuti normali. In altri tumori, l’espressione di inibitori endogeni, come la trombospondina- 1 o l’interferone-β, è down-regolata.1
Figura 7. L’ipotesi dell’equilibrio dello switch angiogenico. Tratto da Fig. 4, ref. 8.
Invasione dei tessuti e metastasi
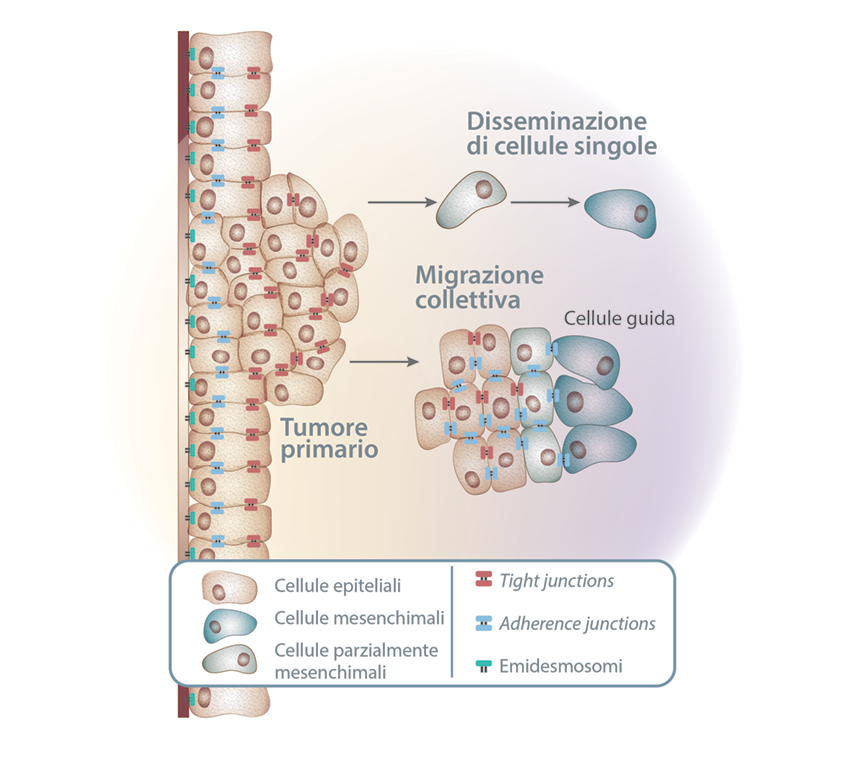
Prima o poi durante lo sviluppo di molte tipologie tumorali, le masse tumorali primarie generano cellule pioniere che si separano dal tumore, invadono i tessuti circostanti e poi viaggiano fino a siti distanti dove formeranno nuove colonie (Figura 8). Questi insediamenti lontani, le metastasi, sono la causa di circa il 90% delle morti dovute a tumore.1
Figura 8. Disseminazione delle cellule tumorali. Tratto da Fig. 1A, ref. 9.
Diverse classi di proteine coinvolte nel legame al tessuto circostante sono alterate nelle cellule che possiedono la capacità di invasione e metastatizzazione. Queste proteine coinvolgono le molecole di adesione cellula-cellula e le integrine (es. E-caderina), che collegano le cellule alla matrice extracellulare. Per esempio, alcuni carcinomi facilitano l’invasione modificando l’espressione delle integrine da quelle che legano la matrice extracellulare presente nel normale epitelio a quelle che preferenzialmente legano i componenti stromali degradati prodotti dalle proteasi extracellulari.1
Il secondo parametro generale della capacità invasiva e metastatica coinvolge le proteasi extracellulari. I geni delle proteasi possono essere up-regolati, oppure possono essere down-regolati quelli degli inibitori delle proteasi.1
Riprogrammazione del metabolismo cellulare
In condizioni aerobiche, le cellule normali metabolizzano il glucosio, prima in piruvato attraverso la glicolisi nel citoplasma e successivamente in anidride carbonica nei mitocondri; in condizioni anaerobiche, la glicolisi è favorita e solo una minima parte del piruvato è trasferito nei mitocondri.2
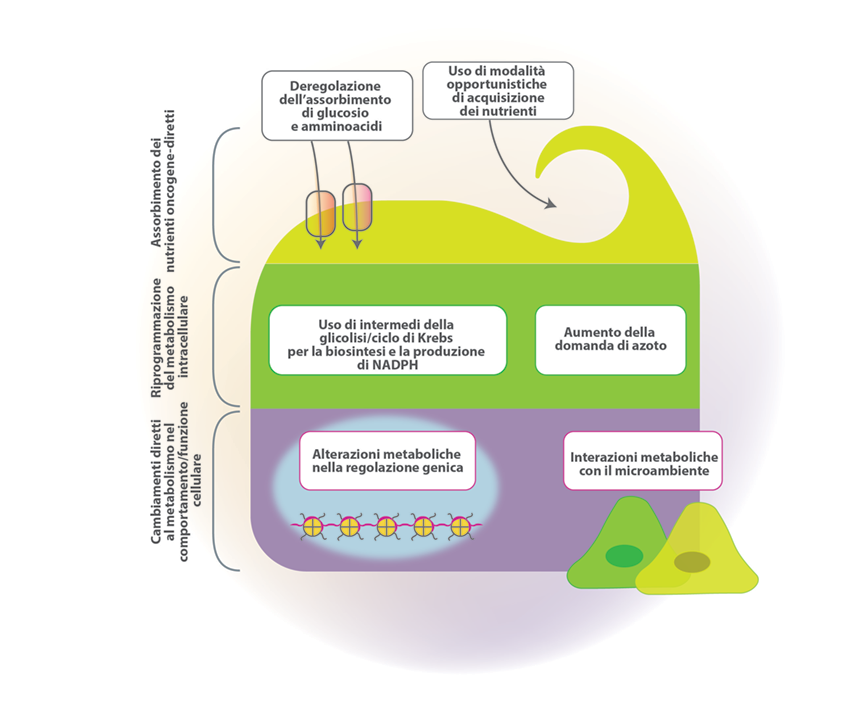
Persino in presenza di ossigeno, le cellule tumorali sono in grado di riprogrammare il proprio metabolismo del glucosio, e quindi la produzione di energia, limitandone la degradazione in larga parte mediante glicolisi, in uno stato definito “glicolisi aerobica” (Figura 9).2
Figura 9. Metabolismo delle cellule tumorali. Tratto da Fig. 1, ref. 10.
Questa riprogrammazione del metabolismo cellulare è apparentemente controintuitiva. Le cellule tumorali devono compensare l’efficienza circa 18 volte inferiore nella produzione di ATP della glicolisi rispetto alla fosforilazione ossidativa mitocondriale. In parte, lo fanno up-regolando i trasportatori del glucosio (es. GLUT-1), che aumentano l’ingresso del glucosio nel citoplasma.2
Questo affidamento alla glicolisi può essere ulteriormente favorito da zone di ipossia all’interno dei tumori. Sia l’oncoproteina Ras sia l’ipossia possono aumentare in maniera indipendente i livelli dei fattori di trascrizione HIF-1α e HIF-2α, che a loro volta up-regolano la glicolisi.2
Una spiegazione funzionale per questa riprogrammazione metabolica risiede nel fatto che l’aumentata glicolisi permette il passaggio di alcuni intermedi glicolitici a diverse vie biosintetiche, come quelle relative alla sintesi di nucleosidi e aminoacidi; ciò facilita, a sua volta, la biosintesi di macromolecole e organelli richiesti per l’assemblaggio di nuove cellule.2
Curiosamente, è stato osservato che alcuni tumori contengono due sottopopolazioni cellulari che differiscono per le vie con cui generano energia. Una sottopopolazione consiste in cellule dipendenti dalla glicolisi (“effetto Warburg”) e che producono lattato, mentre le cellule della seconda popolazione preferenzialmente importano e utilizzano il lattato prodotto dalle cellule vicine come principale fonte di energia, impiegandolo nel ciclo dell’acido citrico. Queste due sottopopolazioni convivono quindi in modo simbiontico.2
Evasione dalla risposta immunitaria
I tumori che riescono a crescere devono aver trovato il modo per evadere dal riconoscimento da parte dei vari componenti del sistema immunitario oppure devono essere stati in grado di limitare il grado di distruzione immunologica, e quindi evadere dall’eradicazione. Tra i meccanismi suggeriti, vi è la capacità di produrre varianti debolmente immunogeniche (immunoediting) che riescono a crescere e formare tumori solidi (Figura 10).2
Figura 10. Meccanismi di immunoediting delle cellule tumorali. Tratto da Fig. 1, ref. 11.
Instabilità genomica e mutazioni
L’acquisizione dei diversi hallmarks elencati qui sopra dipende in larga parte da una successione di alterazioni genomiche nei genomi delle cellule neoplastiche. La straordinaria abilità dei sistemi di mantenimento genomico nel rilevare e risolvere i difetti nel DNA assicura che il tasso di mutazioni spontanee sia generalmente molto basso, ma nelle cellule tumorali spesso il tasso di mutazioni è più elevato. Questo accade a causa dell’aumentata sensibilità ad agenti mutageni, del malfunzionamento dei sistemi di mantenimento genomico (i cosiddetti caretaker), o entrambi. In aggiunta, l’accumulo di mutazioni può essere accelerato dalla compromissione dei sistemi di sorveglianza che normalmente monitorano l’integrità genomica e forzano geneticamente le cellule danneggiate ad andare incontro ad apoptosi oppure a senescenza.2
Il catalogo dei difetti nei geni caretaker includono quelli i cui prodotti sono coinvolti in:
- rilevazione dei difetti genetici e attivazione dei sistemi riparativi,
- riparazione diretta del DNA danneggiato,
- oppure inattivazione o intercettazione delle molecole mutagene prima che danneggino il DNA (Figura 11).2
Figura 11. Fattori coinvolti nell’instabilità genomica e nelle mutazioni nelle cellule tumorali. Tratto da Fig. 1, ref. 12.
Infiammazione promossa dal tumore
Alcuni tumori sono densamente infiltrati da cellule appartenenti sia al sistema immunitario innato che adattativo, riflettendo perciò le condizioni infiammatorie dei tessuti non neoplastici. Paradossalmente e inaspettatamente, questa risposta infiammatoria è in grado di intensificare la tumorigenesi e la progressione tumorale, aiutando le neoplasie allo stadio iniziale ad acquisire nuove capacità. L’infiammazione può contribuire ai diversi hallmarks fornendo molecole bioattive al microambiente tumorale, inclusi fattori di crescita, fattori di sopravvivenza, fattori pro-angiogenici, enzimi che modificano la matrice extracellulare facilitando processi come l’angiogenesi, l’invasione e la metastatizzazione.2
Infine, l’infiammazione può provocare il rilascio di specie reattive dell’ossigeno, sostanze altamente mutagene che possono accelerare l’evoluzione genetica delle cellule tumorali verso un fenotipo più maligno (Figura 12).2
Figura 12. Danno ossidativo dato dall’infiammazione. Tratto da Fig. 1, ref. 13.
Clicca per scaricare lo slide-kit
Clicca per scaricare la brochure
Bibliografia
- Hanahan D, Weinberg RA. The hallmarks of cancer. Cell. 2000;100:57-70.
- Hanahan D, Weinberg RA. Hallmarks of cancer: the next generation. Cell. 2011;144:646-74.
- De Palma M, Hanahan D. The biology of personalized cancer medicine: facing individual complexities underlying hallmark capabilities. Mol Oncol. 2012;6:111-27.
- Goustin AS, et al. Growth factors and cancer. Cancer Res. 1986;46:1015-29.
- Dyson NJ. RB1: a prototype tumor suppressor and an enigma. Genes Dev. 2016;30(13):1492-502.
- Wong RSY. Apoptosis in cancer: from pathogenesis to treatment. J Exp Clin Cancer Res. 2011;30(1):87.
- Maciejowski J, de Lange T. Telomeres in cancer: tumor suppression and genome instability. Nat Rev Mol Cell Biol. 2017;18(3):175-86.
- Hanahan D, Folkman J. Patterns and emerging mechanisms of the angiogenic switch during tumorigenesis. Cell. 1996;86:353-64.
- Lambert AW, Pattabiraman DR, Weinberg RA. Emerging biological principles of metastasis. Cell. 2017;168:670-91.
- Pavlova NN, Thompson CB. The emerging hallmarks of cancer metabolism. Cell. 2016;23:27-47.
- Muenst S, et al. The immune system and cancer evasion strategies: therapeutic concepts. J Intern Med. 2016;279(6):541-62.
- Sahan AZ, Hazra TK, Das S. The pivotal role of DNA repair in infection-mediated inflammation and cancer. Front Microbiol. 2018;9:663.
- Murata M. Inflammation and Cancer. Environ Health Prev Med. 2018;23(1):50.
IT-ONC-210002