Minimal sjukdomsaktivitet för maximal påverkan på sjukdomsbördan1
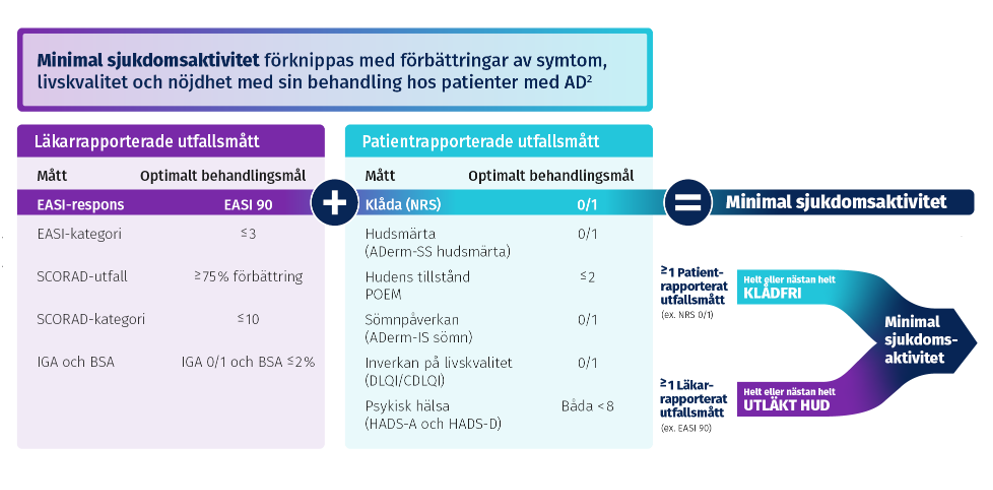
Minimal sjukdomsaktivitet defineras som att uppnå optimala behandlingsmål för både patient- och läkarrapporterade utfallsmått1
I publikationen "Combining treat-to-target principles and shared decision-making: International expert consensus-based recommendations with a novel concept for minimal disease activity criteria in atopic dermatitis" kopplades minimal sjukdomsaktivitet hos patienter med AD till tydliga förbättringar av symptom och livskvalitet samt hur nöjd man är med sin behandling1,2.
Klicka på "studiedesign" nedan för att ta del av studiedesignen.
Studiedesign1
En styrkommitté, executive steering committee (ESC), med sju internationella experter initierade en global och mångkulturell patientstudie (N=88) för att identifiera luckor och behov i nuvarande hantering av AD-patienter.
Olika perspektiv samlades in via 9 regionala underkommittéer av experter utspridda geografiskt över hela världen. Experterna betygsatte med en 10-gradig Likert-skala deras konsensus över en rad rekommendationer för hantering av AD-patienter.
Rekommendationer och kriterier1
Behandlingsmål väljs utifrån en lista med "måttliga" och "optimala" mål baserat på diskussion mellan behandlande läkare och patient. Minimal sjukdomsaktivitet (MDA) definieras som uppnående av optimala mål sett från såväl läkare som patient.

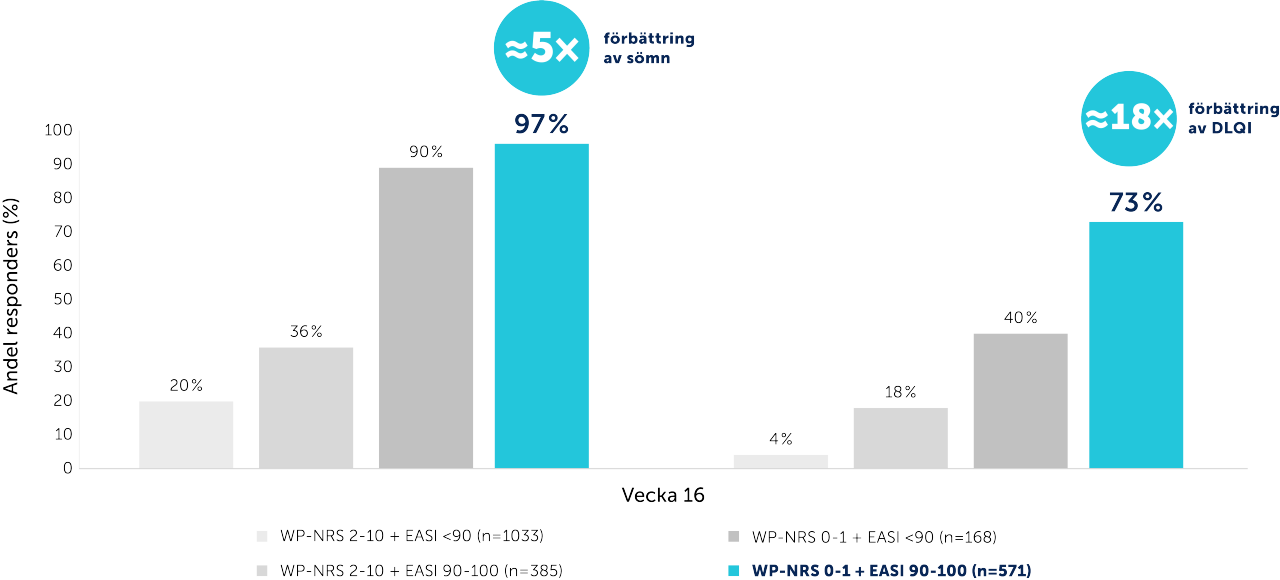
Att uppnå kombinationen av EASI 90 och NRS 0/1 kopplades till förbättrad livskvalitet4
Klicka på "studiedesign" nedan för att ta del av studiedesignen för publikationen "Higher levels of response on clinical atopic dermatitis severity measures are associated with meaningful improvements in patient-reported symptom and quality of life measures: Integrated analysis of three Upadacitinib phase 3 trials"3,4
Studiedesign3
En poolad post-hoc analys som använde data från tre multicenter, randomiserade, dubbelblindade parallellgruppsstudier med patienter som fick upadacitinib eller placebo användes för att utvärdera om ytterligare förbättringar i den kliniska responsen kunde kopplas till förbättringar av PRO och QoL under de första 16 veckorna av behandling.*
Urvalet av behandlingsutfall för att bedöma patienters sjukdomsstatus:

Ju högre poäng i ADerm-IS och DLQI, desto högre svårighetsgrad av sjukdom
*Totalt 2392 patienter inkluderades i analysen. Efter 16 veckors behandling med upadacitinib, vid undersökning av EASI 90 och NRS 0/1 var både förbättringar och svarsfrekvens högst bland patienter som uppnådde samtidig EASI 90 och NRS 0/1.
Kombinerad ITT-population. Beräkningar av andelen patienter som uppnådde svar baserades på tillgängliga data för varje resultat. Svarsstorleken kan därför variera beroende på datatillgänglighet av de olika måtten.
DATABEGRÄNSNINGAR: Dessa är beskrivande, post-hoc analyser som använder observerade data; ingen statistisk signifikans eller några slutsatser kan dras från dessa analyser. Den patientrapporterade datan samlades in via frågeformulär där patienterna ombads att själva rapportera sina symtom och påverkan i förhållande till deras AD; faktorer som inte ingår i dessa PRO eller inte är direkt relaterade till AD kan ha påverkat dessa resultat.
Med RINVOQ kan dina patienter med AD nå optimala behandlingsmål och därmed uppnå minimal sjukdomsaktivitet
Vad skulle behandling med RINVOQ kunna betyda för dina AD-patienter?
EASI 90 + NRS 0/1 = MINIMAL SJUKDOMSAKTIVITET
Om minimal sjukdomsaktivitet innebär att patienten uppnår optimala behandlingsmål utifrån både läkar-och patientrapporterade utfallsmått, t.ex. EASI 90 + NRS 0/1, hur ser det då ut för RINVOQ i studieresultat för detta?
66% uppnådde EASI 90 inom 16 veckor‡5
54% blev helt eller nästan helt klådfria (NRS 0/1) inom 16 veckor**6,7
47% uppnådde minimal sjukdomsaktivitet (EASI 90 + NRS 0/1) efter 1 år†8
Kombinationen av effektiv hudläkning och klådfrihet bibehölls under 188 veckor1
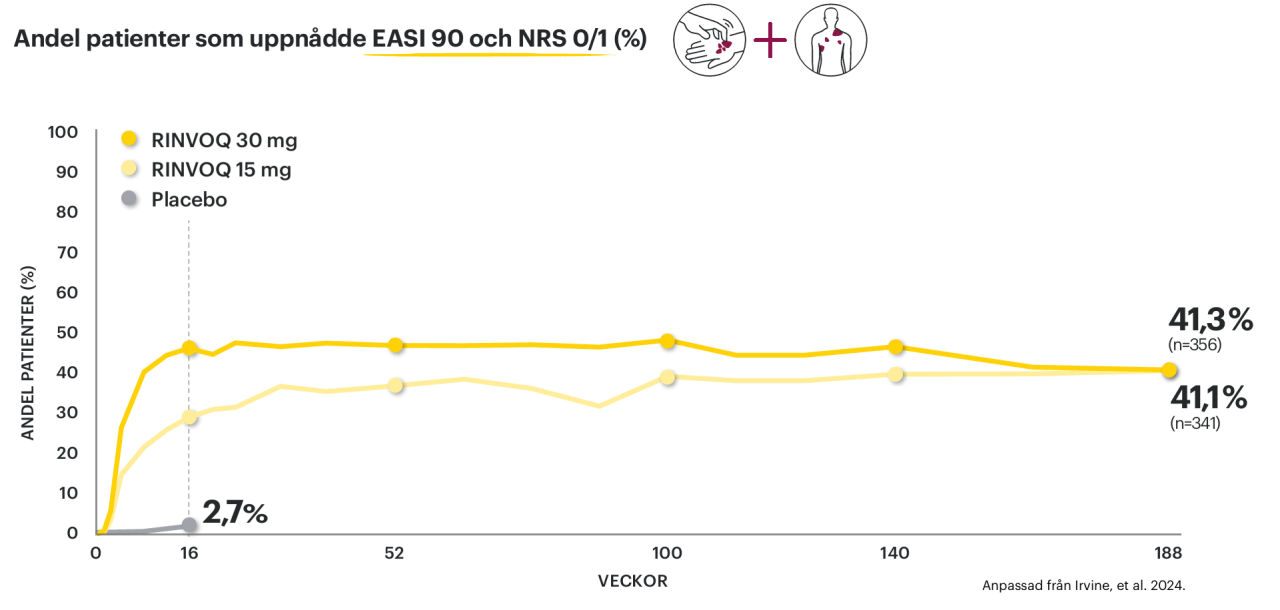
Integrerad analys av MEASURE UP 1 och 2. Den statistiska metoden Observed Case (OC) användes, där all observerad data inkluderas fram till behandlingsavslut och inputation av saknad data görs ej.
‡Andel patienter med RINVOQ 15/30 mg vs placebo som vid vecka 16 uppnått EASI 90: 53/66 % vs 8 % (p<0,001). MEASURE UP 1, NRI-C
**Andel patienter med RINVOQ 15/30 mg vs placebo som uppnått NRS 0/1 vecka 16: 37/54% vs 8% (p<0,05). Integrerad analys av MEASURE UP 1 och 2, OC.
†Andel patienter med RINVOQ 15/30 mg som vid vecka 52 uppnått EASI 90 + NRS 0/1: 37/47 %. Integrerad analys av MEASURE UP 1 och 2
Film om vikten av att uppnå minimial sjukdomsaktivitet
1. Silverberg JI, et al. J Eur Acad Dermatol Venereol. 2024;00:1–10. doi:10.1111/jdv.20229
2. Silverberg JI, et al. Br J Dermatol. 2023;188(Suppl 3):ljad162.008. https://doi.org/10.1093/bjd/ljad162.026.
3. Reich K, et al. J Eur Acad Dermatol Venereol. 2023; 37(8):1634–41. doi: 10.1111/jdv.18995
4. Reich K, et al. J Eur Acad Dermatol Venereol. 2023;37(8):1634–41 (Suppl. 1).
5. RINVOQ produktresumé
6. Simpson EL, et al. JAMA Dermatol. 2022;158(4):404–13
7. AbbVie Data on file ABVRRTI73358
8. Irvine AD, et al. Efficacy and Safety of Upadacitinib Through 188 Weeks in Adolescents and Adults With Moderate-to-Severe Atopic Dermatitis: Phase 3 Randomized Clinical Trial Results. Presenterat på Revolutionizing Atopic Dermatitis (RAD) Virtual Conference, 8 december 2024
RINVOQ® (upadacitinib), depottablett 15 mg, 30 mg, 45 mg (F), Rx, ATC-kod L04AF03 JAK-hämmare. Indikationer: måttlig till svår aktiv reumatoid artrit hos vuxna med otillräckligt behandlingssvar på eller intolerans mot ett eller flera DMARDs i monoterapi eller i kombination med metotrexat. Aktiv psoriasisartrit hos vuxna med otillräckligt behandlingssvar på eller intolerans mot ett eller flera DMARDs, i monoterapi eller i kombination med metotrexat. Axial spondylartrit: – Aktiv icke-radiografisk axial spondylartrit hos vuxna med objektiva tecken på inflammation som anges av förhöjda nivåer av CRP och/eller MRI, som har otillräckligt behandlingssvar på NSAID. – Aktiv ankyloserande spondylit(radiografisk axial spondylartrit) hos vuxna med otillräckligt behandlingssvar på konventionell behandling. Hos vuxna med jättecellsarterit (GCA). Måttlig till svår atopisk dermatit hos vuxna och ungdomar 12 år och äldre vilka är aktuella för systemisk behandling. Måttlig till svår aktiv ulcerös kolit eller Crohns sjukdom hos vuxna med otillräckligt behandlingssvar, förlorat behandlingssvar eller som varit intoleranta mot konventionell behandling eller biologiska läkemedel. Kontraindikationer: Överkänslighet mot den aktiva substansen eller mot något hjälpämne. Aktiv tuberkulos (TB) eller aktiv allvarlig infektion. Gravt nedsatt leverfunktion. Graviditet. Effekter på förmågan att framföra fordon: RINVOQ kan ha en liten effekt på förmågan att framföra fordon och använda maskiner eftersom yrsel och vertigo kan inträffa under behandling.Varningar och försiktighet: RINVOQ ska endast användas om inga lämpliga behandlingsalternativ är tillgängliga för patienter: som är 65 år eller äldre; med en anamnes på aterosklerotisk hjärt-kärlsjukdom eller andra kardiovaskulära riskfaktorer (t.ex. nuvarande eller tidigare långtidsrökare); med riskfaktorer för malignitet (t.ex. nuvarande eller tidigare malignitet). RINVOQ ska inte påbörjas hos patienter med aktiva, allvarliga infektioner, inkl. lokala infektioner och TB. Virusreaktivering, inkl. fall av reaktivering av herpesvirus (t.ex. herpes zoster), har rapporterats i kliniska studier. Påbörja inte eller avbryt tillfälligt behandling om onormala lab-värden som anemi, neutropeni, lymfopeni och levertransaminaser påträffas. RINVOQ associerades med ökade lipidparametrar i kliniska studier. Divertikulit och gastrointestinal perforation har rapporteras i kliniska prövningar och från klinisk erfarenhet. Patienter med aktiv Crohns sjukdom löper ökad risk att utveckla tarmperforation. VTE har rapporterats hos patienter på RINVOQ. Hos patienter med kända VTE-riskfaktorer ska RINVOQ användas med försiktighet. Allvarliga överkänslighetsreaktioner har rapporterats med RINVOQ. Fertilitet, graviditet och amning: Fertila kvinnor ska rådas använda effektiv preventivmetod under behandling och i minst 4 veckor efter avslutad behandling. RINVOQ är kontraindicerat under graviditet och ska inte användas under amning. För ytterligare information samt priser se www.fass.se. För information: kontakta AbbVie AB, 08 684 44 600. Datum för översyn av produktresumén: 2 juni 2025. Begränsning av läkemedelsförmån: RINVOQ subventioneras 1) när behandling med TNF-hämmare gett otillräcklig effekt eller inte är lämplig 2) för patienter med atopisk dermatit när konventionell topikal eller systemisk behandling gett otillräcklig effekt eller inte är lämplig 3) för patienter med jättecellsarterit.
SE-RNQ_AD-220023_v9 senast uppdaterad 2025-08-26




