Att tänka på innan behandlingsstart
RINVOQ bör endast användas om inga andra lämpliga behandlingsalternativ är tillgängliga för patienter:
- som är 65 år eller äldre
- med en anamnes på aterosklerotisk hjärt-kärlsjukdom eller andra kardiovaskulära riskfaktorer (till exempel patienter som är eller har varit rökare under lång tid)
- med riskfaktorer för malignitet (till exempel nuvarande malignitet eller tidigare malignitet)
Kontraindikationer
- Överkänslighet mot den aktiva substansen eller mot något hjälpämne
- Aktiv tuberkulos (TB) eller aktiv allvarlig infektion
- Gravt nedsatt leverfunktion
- Graviditet. Om en patient blir gravid under behandling med upadacitinib ska föräldrarna till fostret informeras om de potentiella riskerna som föreligger för fostret.
| Varningar och försiktighet | |
|---|---|
| Äldre (65+) | Det finns en ökad risk för biverkningar hos patienter som är 65 år eller äldre med RINVOQ 30 mg. Därför är den rekommenderade dosen för långtidsanvändning i denna patientpopulation 15 mg. |
| Immunsuppressiva läkemedel | Kombination med andra potenta immunhämmare, bDMARDs eller andra januskinas (JAK)-hämmare rekommenderas inte. |
| Allvarliga infektioner | RINVOQ ska inte påbörjas hos patienter med en aktiv, allvarlig infektion inklusive lokala infektioner. Behandling med RINVOQ kan återupptas när infektionen är under kontroll. |
| Virusreaktivering | Om en patient utvecklar herpes zoster, ska ett behandlingsavbrott av RINVOQ övervägas tills episoden upphört. |
| Vaccination | Användning av levande försvagat vaccin under eller omedelbart före behandling med RINVOQ rekommenderas inte. Innan RINVOQ sätts in rekommenderas att patienterna är vaccinerade enligt gällande vaccinationsriktlinjer, inklusive profylaktisk zoster-vaccination. |
| Malignitet | Lymfom, hudcancer av icke-melanom typ och andra maligniter har rapporterats hos patienter som behandlats med RINVOQ. Regelbunden undersökning av huden rekommenderas för alla patienter, i synnerhet de med riskfaktorer för hudcancer. |
| Allvarliga kardiovaskulära händelser (MACE) | MACE observerades i kliniska studier med RINVOQ. Hos patienter med kardiovaskulära riskfaktorer ska RINVOQ därför endast användas om inga lämpliga behandlingsalternativ är tillgängliga. |
| Venös tromboembolism (VTE) | RINVOQ ska användas med försiktighet hos patienter som löper hög risk för DVT/LE. Om kliniska symptom på DVT/LE uppstår ska behandling med RINVOQ avslutas. Retinal venocklusion har rapporterats hos patienter som behandlas med JAK-hämmare, inklusive upadacitinib. Patienter ska uppmanas att omedelbart söka läkarvård om de får symtom som tyder på retinal venocklusion. |
| Överkänslighetsreaktioner | Allvarliga överkänslighetsreaktioner som anafylaxi och angioödem har rapporterats hos patienter som får RINVOQ. Om en kliniskt signifikant överkänslighetsreaktion uppstår ska RINVOQ avbrytas och lämplig behandling insättas. |
| Gastrointestinal perforation | RINVOQ bör användas med försiktighet till patienter som löper risk för gastrointestinal perforation. Patienter med nydebuterade symtom från buken ska utredas omedelbart för tidig upptäckt av divertikulit eller gastrointestinal perforation |
| Effekter på förmåga att framföra fordon | RINVOQ kan ha en liten effekt på förmågan att framföra fordon och använda maskiner eftersom yrsel och vertigo kan inträffa under behandling |
| Läkemedelsrester i avföring | Läkemedelsrester i avföring eller stomiproduktion har rapporterats hos patienter som får RINVOQ, primärt vid anatomiska (t.ex. ileostomi, kolostomi, tarmresektion) eller andra funktionella gastrointestinala tillstånd med kortare transittider. Patienter bör övervakas kliniskt och alternativ behandling bör övervägas om patienten har ett otillräckligt terapeutiskt svar. |
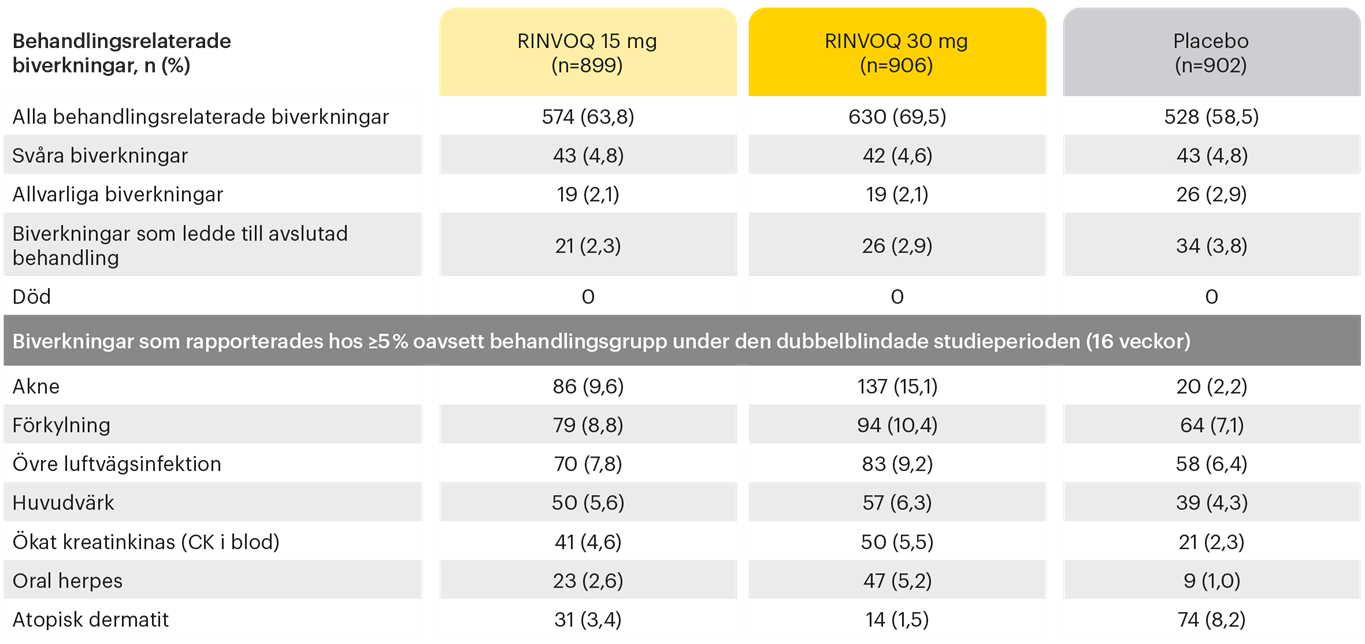
I de placebokontrollerade kliniska prövningarna vid atopisk dermatit var de vanligaste rapporterade biverkningarna (≥ 5% av patienterna) med upadacitinib: övre luftvägsinfektion, akne, herpes simplex, huvudvärk och förhöjt kreatinkinas (CK) i blodet1.
Behandlingsrelaterade biverkningar, vid behandling med RINVOQ vid AD, 16 veckor*3.
Långtidsuppföljning upp till 6 år visar genomgående konsekvent säkerhetsprofil vid behandling med RINVOQ för AD**4
Omfattande klinisk erfarenhet & välstuderat i brett studieprogram
I augusti 2021 godkändes RINVOQ för behandling av måttlig till svår atopisk dermatit hos vuxna och ungdomar från 12 år. RINVOQ godkändes för sin första indikation (reumatoid artrit) 2019 och är idag godkänt vid åtta olika indikationer, inom tre terapiområden1.
· Måttlig till svår atopisk dermatit (AD)
· Måttlig till svår aktiv reumatoid artrit (RA)
· Aktiv psoriasisartrit (PsA)
· Aktiv ankyloserande spondylit (AS)
· Aktiv icke-radiografisk axial spondylartrit (nr-axSpA)
· Måttlig till svår aktiv ulcerös kolit (UC)
· Måttlig till svår aktiv Chrons sjukdom (CD)
· Jättecellsarterit (GCA)
Effekt- och säkerhetsprofilen för RINVOQ har studerats i 20 kliniska studier inom ovan nämnda indikationer†1. Den kliniska erfarenheten av RINVOQ världen över omfattar hittills över 459 000 patienter, varav över 109 000 patienter behandlade för AD2.
För fullständig information om dosering, kontraindikationer, varningar & försiktighet samt biverkningar, se RINVOQ produktresumé, Fass.se.
*Säkerhetsanalys av fas 2b och fas 3 studierna M16-048, Measure Up 1, Measure Up 2, och AD Up
**Integrerad analys av de pågående fas 3-studierna Measure Up 1, 2 och AD Up, omfattande >2 600 patienter och >9 000 patientår.
† RA: SELECT-EARLY, SELECT-NEXT, SELECT-COMPARE, SELECT-MONOTHERAPY, SELECT-BEYOND; PsA: SELECT-PsA 1, SELECT-PsA 2; AS: SELECT-AXIS 1; nr-axSpA: SELECT-AXIS 2; GCA: SELECT-GCA; AD: MEASURE UP 1, MEASURE UP 2, AD UP; UC: U-ACHIEVE Induction; U-ACCOMPLISH; U-ACHIEVE Maintenance; U-ACTIVATE; CD: U-EXCEED, U-EXCEL, U-ENDURE.
1. RINVOQ Produktresumé, www.fass.se
2. AbbVie DOF #ABVRRTI80188 and AbbVie DOF #ABVRRTI80819, Apr 2025 (incl. patients until Dec 2024).
3. Guttman-Yassky E, et al. AAD 2021, poster 27082
4. Bunick C, et al. Long-term upadacitinib safety in moderate-to severe atopic dermatitis up to 6 years: An integrated analysis including over 9000 patient-years of exposure. Presenterat på Revolutionizing Atopic Dermatitis (RAD) Virtual Conference, 8 december 2024.
RINVOQ® (upadacitinib), depottablett 15 mg, 30 mg, 45 mg (F), Rx, ATC-kod L04AF03 JAK-hämmare. Indikationer: måttlig till svår aktiv reumatoid artrit hos vuxna med otillräckligt behandlingssvar på eller intolerans mot ett eller flera DMARDs i monoterapi eller i kombination med metotrexat. Aktiv psoriasisartrit hos vuxna med otillräckligt behandlingssvar på eller intolerans mot ett eller flera DMARDs, i monoterapi eller i kombination med metotrexat. Axial spondylartrit: – Aktiv icke-radiografisk axial spondylartrit hos vuxna med objektiva tecken på inflammation som anges av förhöjda nivåer av CRP och/eller MRI, som har otillräckligt behandlingssvar på NSAID. – Aktiv ankyloserande spondylit (radiografisk axial spondylartrit) hos vuxna med otillräckligt behandlingssvar på konventionell behandling. Hos vuxna med jättecellsarterit (GCA). Måttlig till svår atopisk dermatit hos vuxna och ungdomar 12 år och äldre vilka är aktuella för systemisk behandling. Måttlig till svår aktiv ulcerös kolit eller Crohns sjukdom hos vuxna med otillräckligt behandlingssvar, förlorat behandlingssvar eller som varit intoleranta mot konventionell behandling eller biologiska läkemedel.
Kontraindikationer: Överkänslighet mot den aktiva substansen eller mot något hjälpämne. Aktiv tuberkulos (TB) eller aktiv allvarlig infektion. Gravt nedsatt leverfunktion. Graviditet.
Effekter på förmågan att framföra fordon: RINVOQ kan ha en liten effekt på förmågan att framföra fordon och använda maskiner eftersom yrsel och vertigo kan inträffa under behandling.
Varningar och försiktighet: RINVOQ ska endast användas om inga lämpliga behandlingsalternativ är tillgängliga för patienter: som är 65 år eller äldre; med en anamnes på aterosklerotisk hjärt-kärlsjukdom eller andra kardiovaskulära riskfaktorer (t.ex. nuvarande eller tidigare långtidsrökare); med riskfaktorer för malignitet (t.ex. nuvarande eller tidigare malignitet). RINVOQ ska inte påbörjas hos patienter med aktiva, allvarliga infektioner, inkl. lokala infektioner och TB. Virusreaktivering, inkl. fall av reaktivering av herpesvirus (t.ex. herpes zoster), har rapporterats i kliniska studier. Påbörja inte eller avbryt tillfälligt behandling om onormala lab-värden som anemi, neutropeni, lymfopeni och levertransaminaser påträffas. RINVOQ associerades med ökade lipidparametrar i kliniska studier. Divertikulit och gastrointestinal perforation har rapporteras i kliniska prövningar och från klinisk erfarenhet. Patienter med aktiv Crohns sjukdom löper ökad risk att utveckla tarmperforation. VTE har rapporterats hos patienter på RINVOQ. Hos patienter med kända VTE-riskfaktorer ska RINVOQ användas med försiktighet. Allvarliga överkänslighetsreaktioner har rapporterats med RINVOQ.
Fertilitet, graviditet och amning: Fertila kvinnor ska rådas använda effektiv preventivmetod under behandling och i minst 4 veckor efter avslutad behandling. RINVOQ är kontraindicerat under graviditet och ska inte användas under amning. För ytterligare information samt priser se www.fass.se.
För information: kontakta AbbVie AB, 08 684 44 600. Datum för översyn av produktresumén: 17 november 2025.
Begränsning av läkemedelsförmån: RINVOQ subventioneras 1) när behandling med TNF-hämmare gett otillräcklig effekt eller inte är lämplig 2) för patienter med atopisk dermatit när konventionell topikal eller systemisk behandling gett otillräcklig effekt eller inte är lämplig 3) för patienter med jättecellsarterit.
SE-RNQD-260002
SE-RNQ-AD-220023 v9, senast uppdaterad 2025-08-26