RINVOQ ger snabb och bibehållen minskning av klåda och eksem vid måttlig till svår atopisk dermatit1-3
Snabb och bibehållen minskning av klåda
• Minskad klåda (NRS ≥4 poäng) sågs efter 1 dag med RINVOQ 30 mg och efter 2 dagar med RINVOQ 15 mg*1,2
• Fler än varannan patient uppnådde klådminskning (NRS ≥4 poäng) inom 16 veckor**1
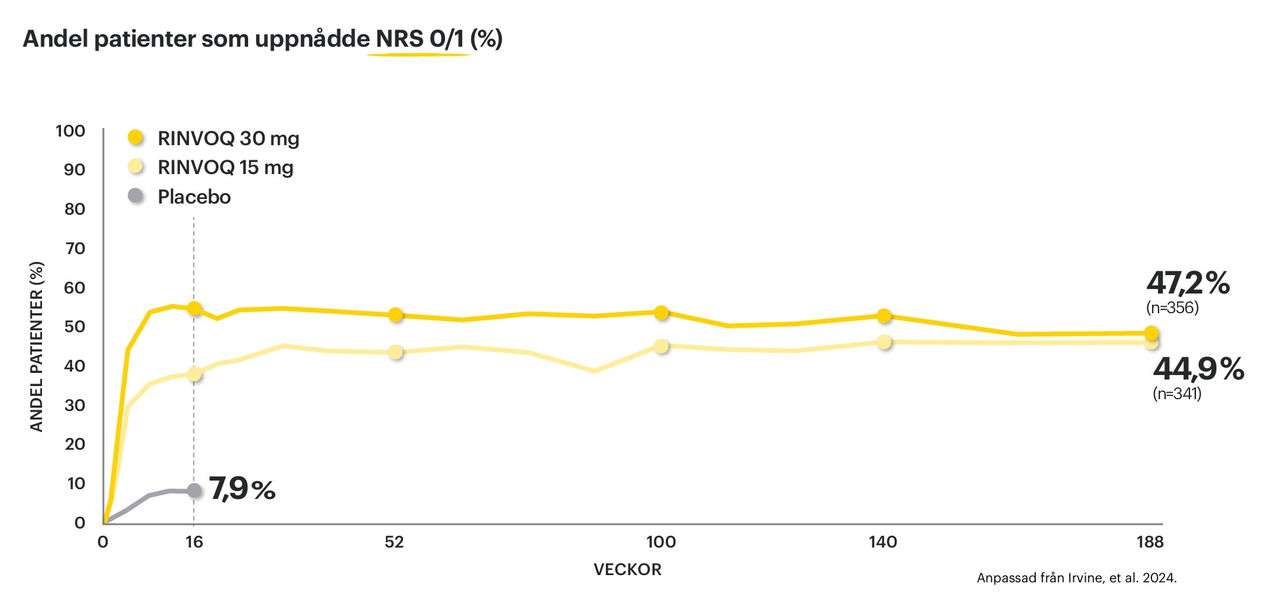
• Bibehållen effekt (NRS 0/1) visad upp till 188 veckor†3
Bibehållen höggradig hudläkning
• Signifikant hudläkning sågs redan efter 2 veckor**1
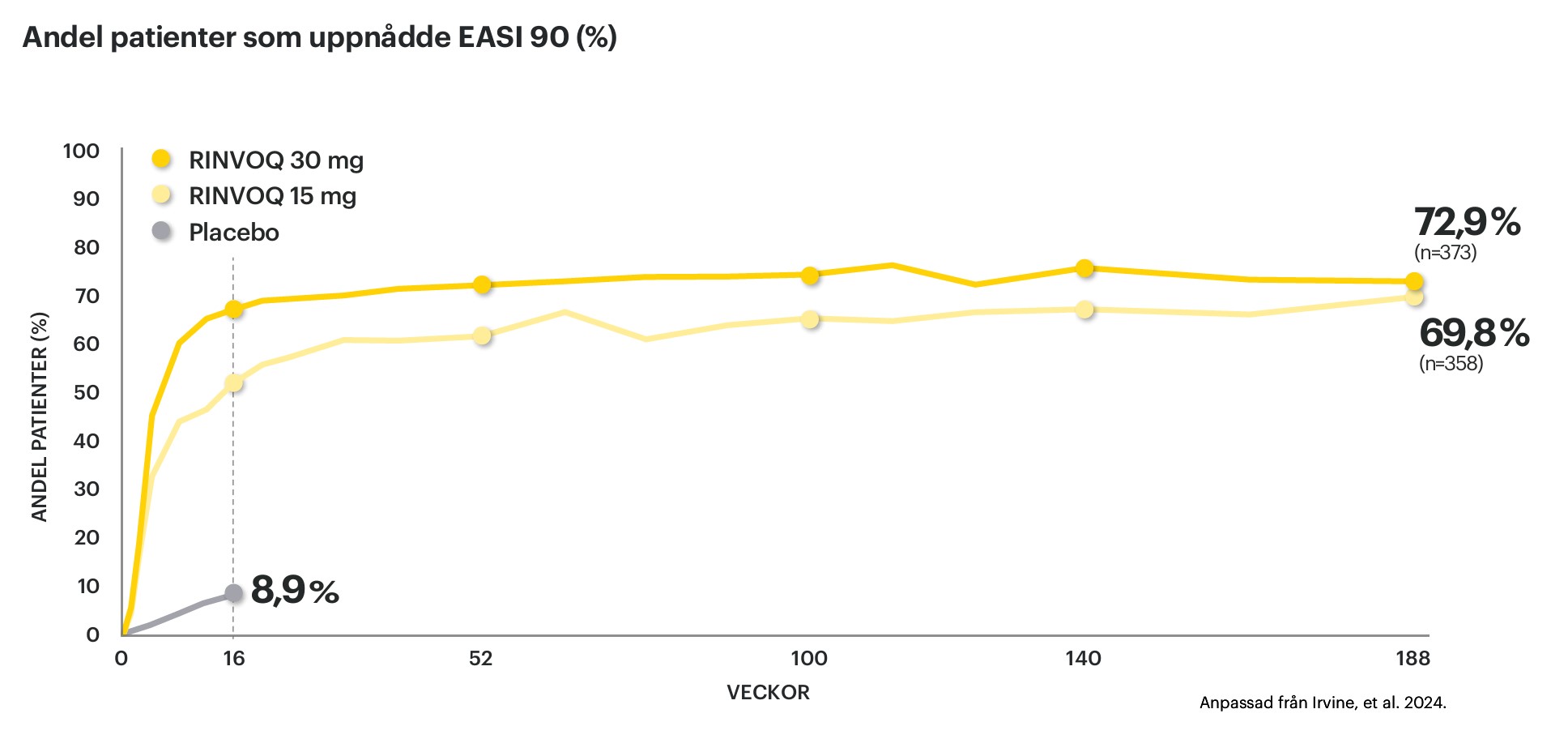
• Fler än 4 av 10 uppnådde minst 90% hudläkning (EASI90) inom 16 veckor**1
• Vid 1 års uppföljning hade fler än 6 av 10 uppnått EASI 90. Bibehållen effekt visad upp till 188 veckor†3
Graferna nedan visar EASI 90-respons samt NRS 0/1 vid analys upp till 188 veckor†3.
* Measure Up 1, NRI-C: Andel patienter som uppgav ≥4 poäng förbättring av NRS efter 1 dag med RINVOQ 30 mg: 12% vs placebo 4 %, p=0.0003; 2 dagar med RINVOQ 15 mg: 16% vs placebo 3% (p<0.0001).
** Measure Up 1, NRI-C: Andel patienter med RINVOQ 15/30 mg vs placebo som uppnådde EASI 75 vecka 2: 38%/47% vs 4% (p<0,001); ≥4 poäng förbättring av NRS vecka 16: 52%/60% vs 12% (p<0,001); EASI 90 vecka 16: 53/66 % vs 8 % (p<0,001).
† Integrerad analys från Measure Up 1 och 2, OC: Andel patienter med RINVOQ 15/30 mg som uppnådde NRS 0/1 vecka 188: 45%/47% och där n avser patientantal vecka 16. Andel patienter med RINVOQ 15/30 mg som uppnådde EASI 90 vecka 188 återges i grafen, där n avser patientantal vecka 16.
NRI-C: non-responder imputation, inklusive imputation av data som saknas på grund av coronavirussjukdom.
OC: Observed Cases.
1. Produktresumé RINVOQ, www.fass.se
2. Guttman-Yassky E, et al. Lancet 2021;397(10290):2151–2168
3. Irvine AD, et al. Efficacy and Safety of Upadacitinib Through 188 Weeks in Adolescents and Adults With Moderate-to-Severe Atopic Dermatitis: Phase 3 Randomized Clinical Trial Results. Presenterat på Revolutionizing Atopic Dermatitis (RAD) Virtual Conference, 8 december 2024.
RINVOQ® (upadacitinib), depottablett 15 mg, 30 mg, 45 mg (F), Rx, ATC-kod L04AF03 JAK-hämmare. Indikationer: måttlig till svår aktiv reumatoid artrit hos vuxna med otillräckligt behandlingssvar på eller intolerans mot ett eller flera DMARDs i monoterapi eller i kombination med metotrexat. Aktiv psoriasisartrit hos vuxna med otillräckligt behandlingssvar på eller intolerans mot ett eller flera DMARDs, i monoterapi eller i kombination med metotrexat. Axial spondylartrit: – Aktiv icke-radiografisk axial spondylartrit hos vuxna med objektiva tecken på inflammation som anges av förhöjda nivåer av CRP och/eller MRI, som har otillräckligt behandlingssvar på NSAID. – Aktiv ankyloserande spondylit (radiografisk axial spondylartrit) hos vuxna med otillräckligt behandlingssvar på konventionell behandling. Hos vuxna med jättecellsarterit (GCA). Måttlig till svår atopisk dermatit hos vuxna och ungdomar 12 år och äldre vilka är aktuella för systemisk behandling. Måttlig till svår aktiv ulcerös kolit eller Crohns sjukdom hos vuxna med otillräckligt behandlingssvar, förlorat behandlingssvar eller som varit intoleranta mot konventionell behandling eller biologiska läkemedel.
Kontraindikationer: Överkänslighet mot den aktiva substansen eller mot något hjälpämne. Aktiv tuberkulos (TB) eller aktiv allvarlig infektion. Gravt nedsatt leverfunktion. Graviditet.
Effekter på förmågan att framföra fordon: RINVOQ kan ha en liten effekt på förmågan att framföra fordon och använda maskiner eftersom yrsel och vertigo kan inträffa under behandling.
Varningar och försiktighet: RINVOQ ska endast användas om inga lämpliga behandlingsalternativ är tillgängliga för patienter: som är 65 år eller äldre; med en anamnes på aterosklerotisk hjärt-kärlsjukdom eller andra kardiovaskulära riskfaktorer (t.ex. nuvarande eller tidigare långtidsrökare); med riskfaktorer för malignitet (t.ex. nuvarande eller tidigare malignitet). RINVOQ ska inte påbörjas hos patienter med aktiva, allvarliga infektioner, inkl. lokala infektioner och TB. Virusreaktivering, inkl. fall av reaktivering av herpesvirus (t.ex. herpes zoster), har rapporterats i kliniska studier. Påbörja inte eller avbryt tillfälligt behandling om onormala lab-värden som anemi, neutropeni, lymfopeni och levertransaminaser påträffas. RINVOQ associerades med ökade lipidparametrar i kliniska studier. Divertikulit och gastrointestinal perforation har rapporteras i kliniska prövningar och från klinisk erfarenhet. Patienter med aktiv Crohns sjukdom löper ökad risk att utveckla tarmperforation. VTE har rapporterats hos patienter på RINVOQ. Hos patienter med kända VTE-riskfaktorer ska RINVOQ användas med försiktighet. Allvarliga överkänslighetsreaktioner har rapporterats med RINVOQ.
Fertilitet, graviditet och amning: Fertila kvinnor ska rådas använda effektiv preventivmetod under behandling och i minst 4 veckor efter avslutad behandling. RINVOQ är kontraindicerat under graviditet och ska inte användas under amning. För ytterligare information samt priser se www.fass.se.
För information: kontakta AbbVie AB, 08 684 44 600. Datum för översyn av produktresumén: 17 november 2025.
Begränsning av läkemedelsförmån: RINVOQ subventioneras 1) när behandling med TNF-hämmare gett otillräcklig effekt eller inte är lämplig 2) för patienter med atopisk dermatit när konventionell topikal eller systemisk behandling gett otillräcklig effekt eller inte är lämplig 3) för patienter med jättecellsarterit.
SE-RNQD-260002
SE-RNQ-AD-220023 v9, senast uppdaterad 2025-08-26