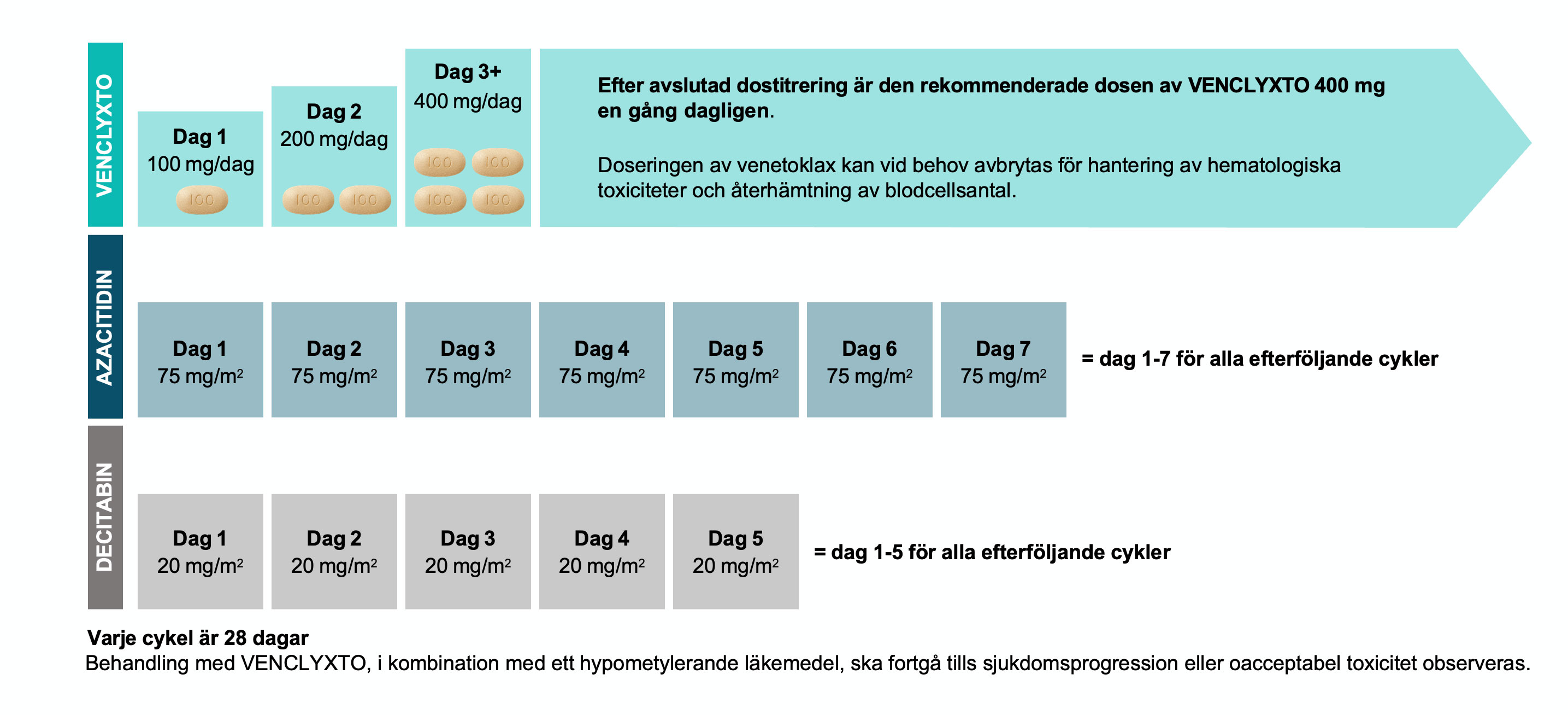
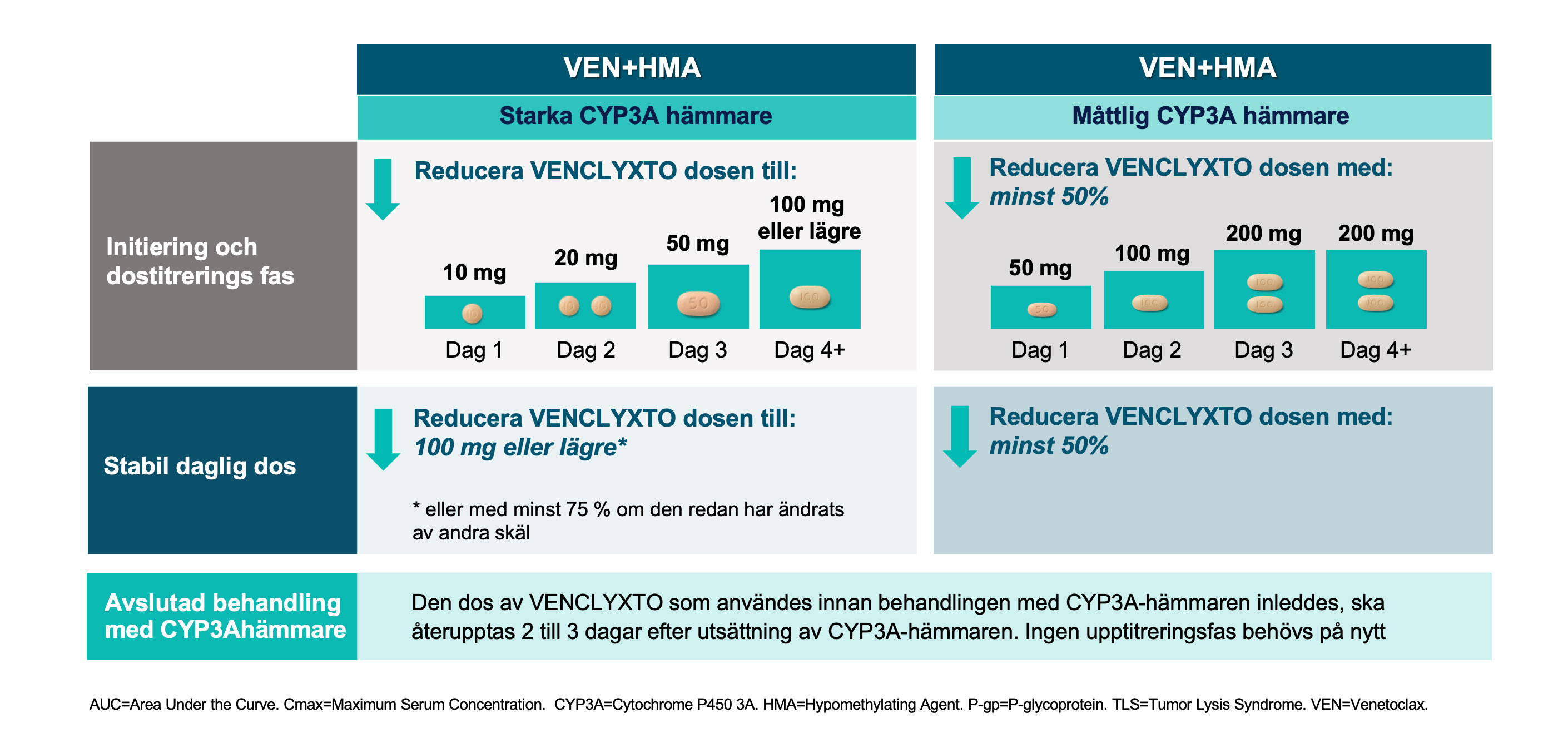
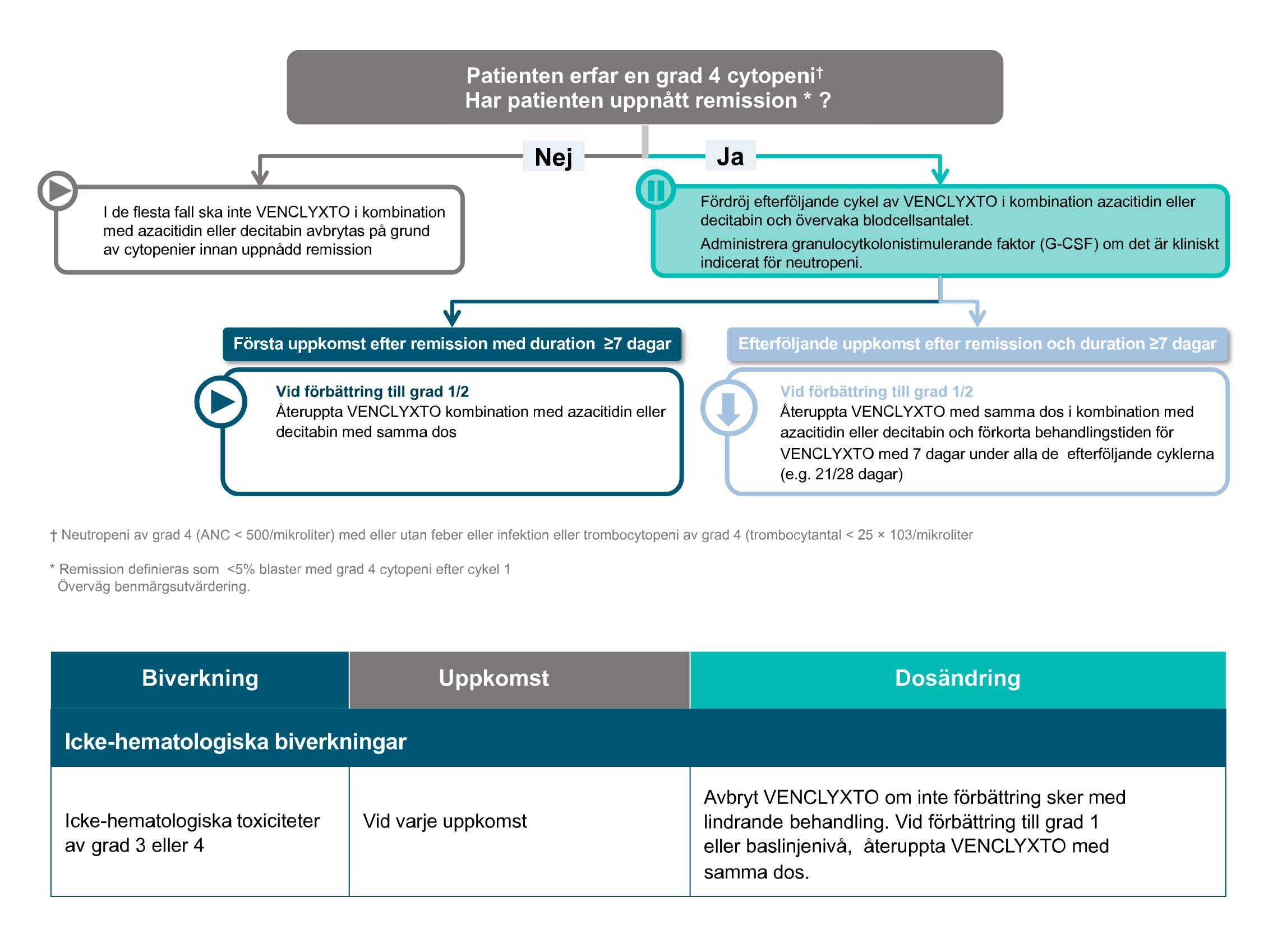
Rekommenderad dosering vid behandling av AML1
Efter avslutad dostitrering är den rekommenderade dosen av VENCLYXTO 400 mg en gång dagligen. Behandling med VENCLYXTO, i kombination med ett hypometylerande läkemedel, ska fortgå tills sjukdomsprogression eller oacceptabel toxicitet observeras.
Doseringen av Venclyxto kan vid behov avbrytas för hantering av hematologiska toxiciteter och återhämtning av blodcellsantal.
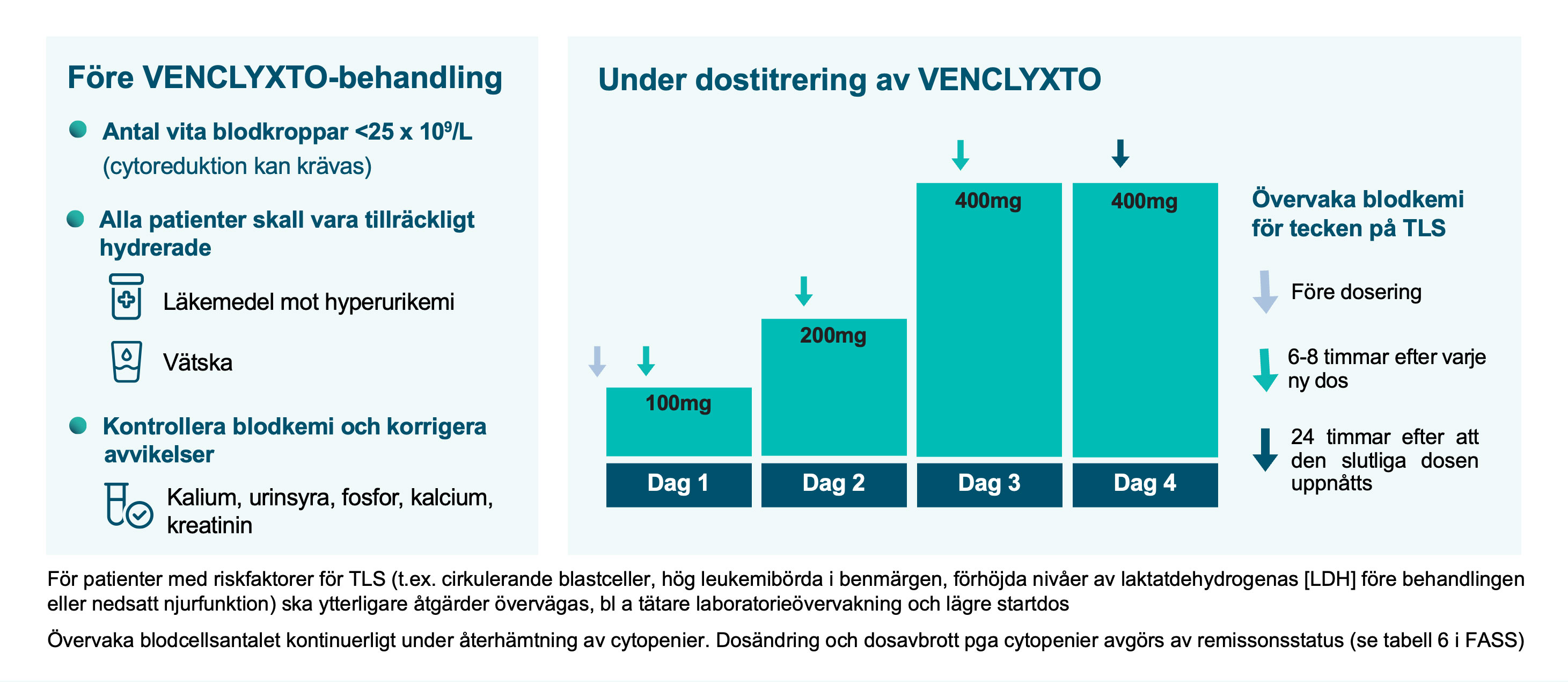
Vilka förebyggande åtgärder bör följas?
*Oral tablet.
†Administer intravenously. Dose may be split as 100 mg and 900 mg on Days 1 and 2 of Cycle 1, respectively. Graphic not to scale. Each cycle is 28 days.
Vill du hålla dig informerad om nyheter och inbjudningar från AbbVie Hematologi?
Vill du veta mer om Venclyxto?
Referens: 1. VENCLYXTO Produktresumé 24 jul 2025.