Skyrizi ulcerös kolit - fas III-studier1,2
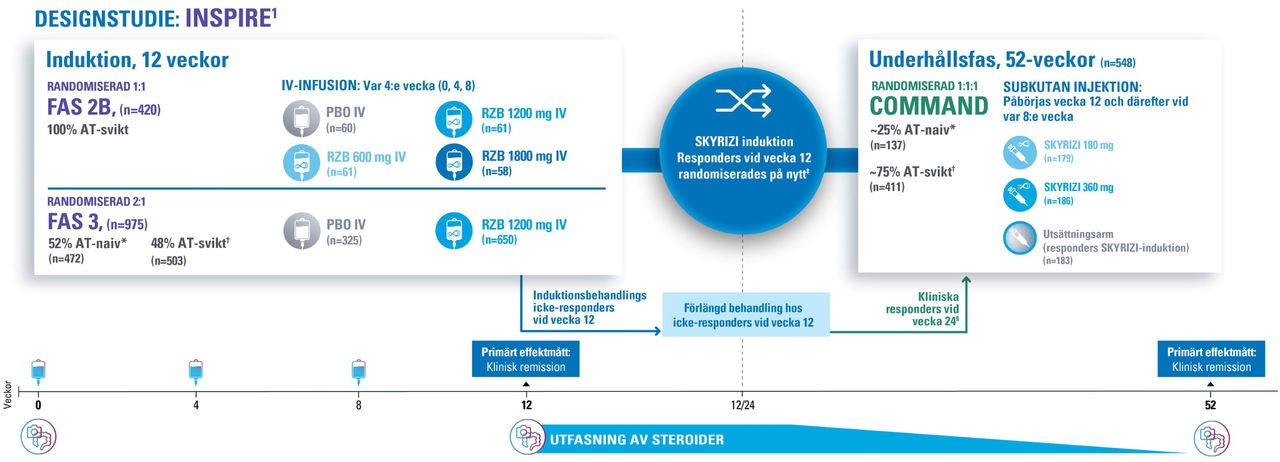
Förlängd behandling för icke-responders vid vecka 12 (n=141): Patienter som inte uppnådde behandlingssvar vid vecka 12 fick förlängd behandling med SKYRIZI (enligt godkänd dosering, 180 mg eller 360 mg) subkutant fram till vecka 24.¹
DEFINITION AV PRIMÄRT EFFEKTMÅTT: Klinisk remission enligt anpassad Mayo-skala (aMS) definieras som en avföringsfrekvens-subskala ≤1, inte högre än vid baslinjen, RBS=0 samt en endoskopisk subskala ≤1 utan tecken på skörhet (friabilitet) vid vecka 12.¹
*Behandlingsnaiva responders för avancerad terapi (AT-naiva) definieras som patienter som inte haft behandlingssvikt (otillräckligt svar eller intolerans) på en eller flera biologiska terapier, JAK-hämmare och/eller S1P-receptormodulatorer.¹ †Responders med behandlingssvikt för avancerad terapi (AT-svikt) definieras som patienter som haft behandlingssvikt (otillräckligt behandlingssvar eller intolerans) på en eller flera biologiska terapier, JAK-hämmare och/eller S1P-receptormodulatorer.¹ ‡Kliniskt svar enligt anpassad Mayo-skala (aMS) definieras som en minskning från baslinjen med ≥2 poäng och ≥30%, samt en minskning av rektal blödnings-subskala (RBS) med ≥1 poäng eller en absolut RBS ≤1.¹ §Patienter från kliniska responders vid vecka 24 är exkluderade från den primära COMMAND-analysen.²
Klinisk respons vecka 41,2
Effekten inträdde snabbt och en större andel patienter som behandlades med SKYRIZI uppnådde klinisk respons så tidigt som vecka 4 jämfört med placebo. Sekundärt effektmått.1
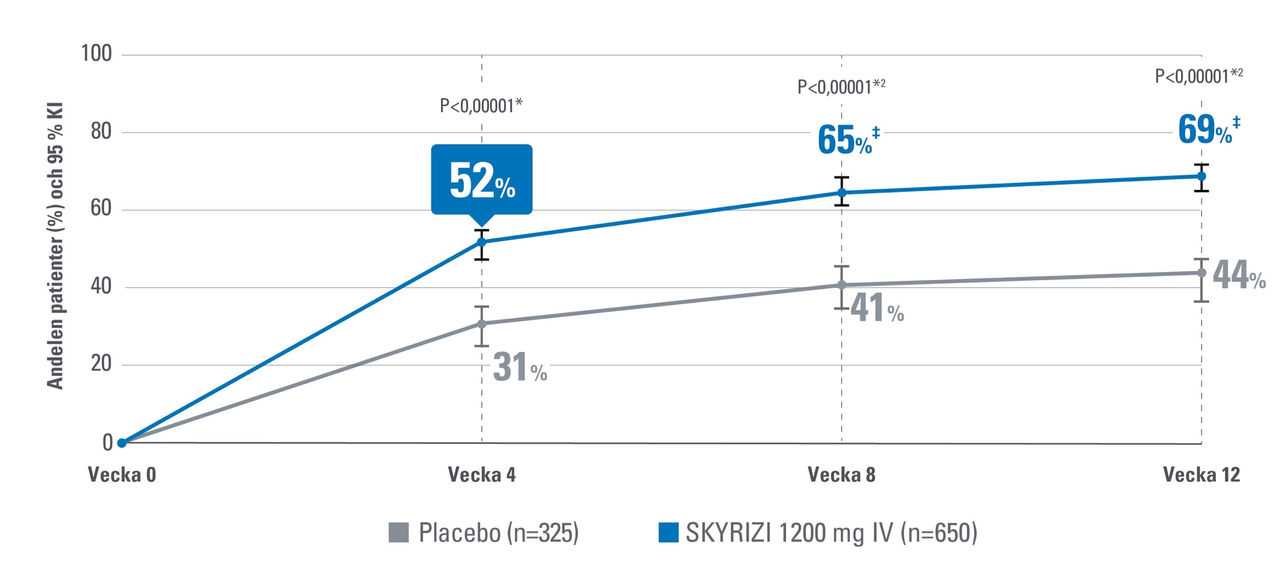
*Statistiskt signifikant under kontroll för multiplicitet för jämförelsen mellan SKYRIZI och placebo (P≤0,00001).
Klinisk remission vecka 12 och 521
Primärt effektmått.1
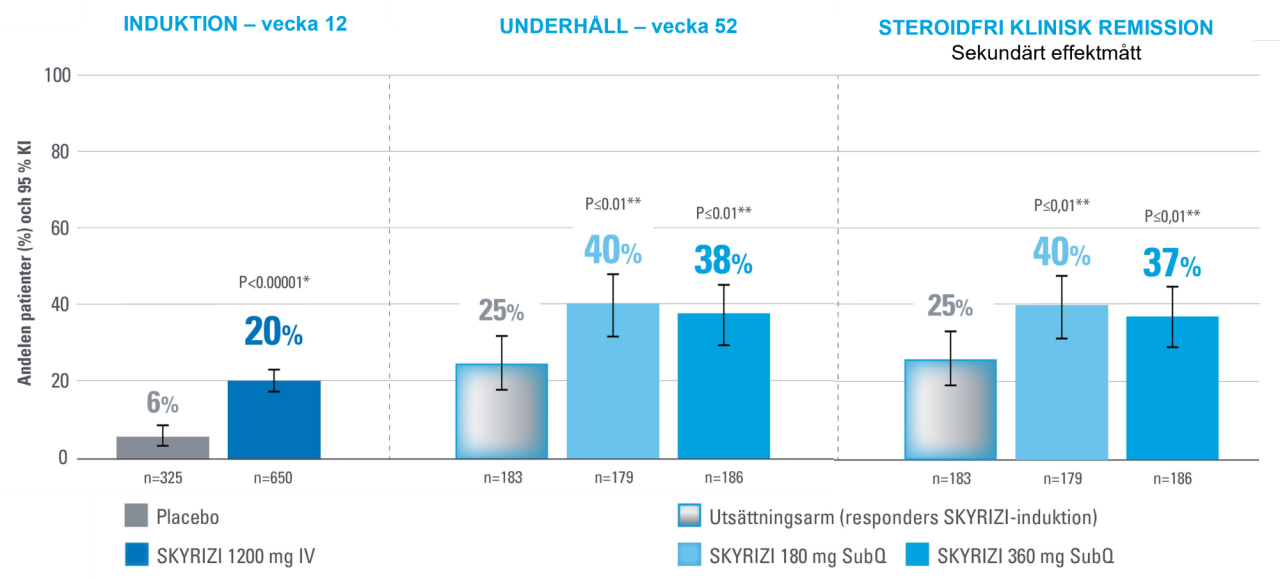
*Justerad behandlingsskillnad (95 % KI).1
**Statistiskt signifikant under multiplicitetskontroll för jämförelse mellan SKYRIZI och placebo.1
Slemhinneläkning vecka 12 och vecka 521
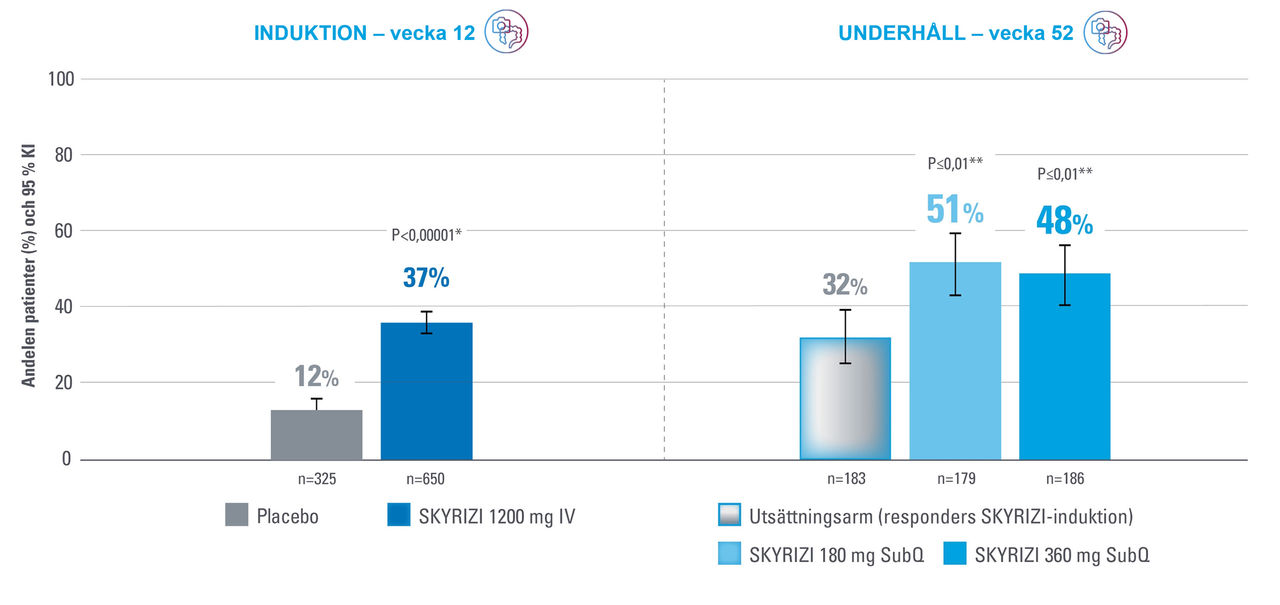
*Justerad behandlingsskillnad (95 % KI)1
**Statistiskt signifikant under multiplicitetskontroll för jämförelse mellan SKYRIZI och placebo.1
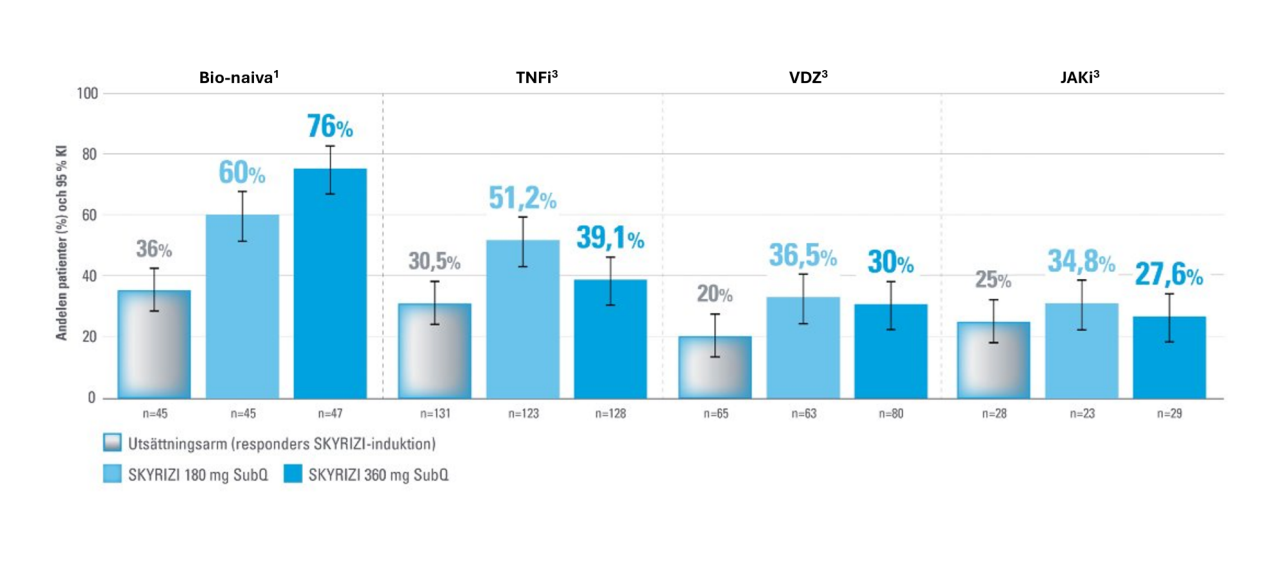
Slemhinneläkning subgruppanalys1,3
Endoskopisk förbättring vid vecka 52 baserat på tidigare användning av läkemedlet. Post-hoc analys.1,3
Biverkningar vecka 122
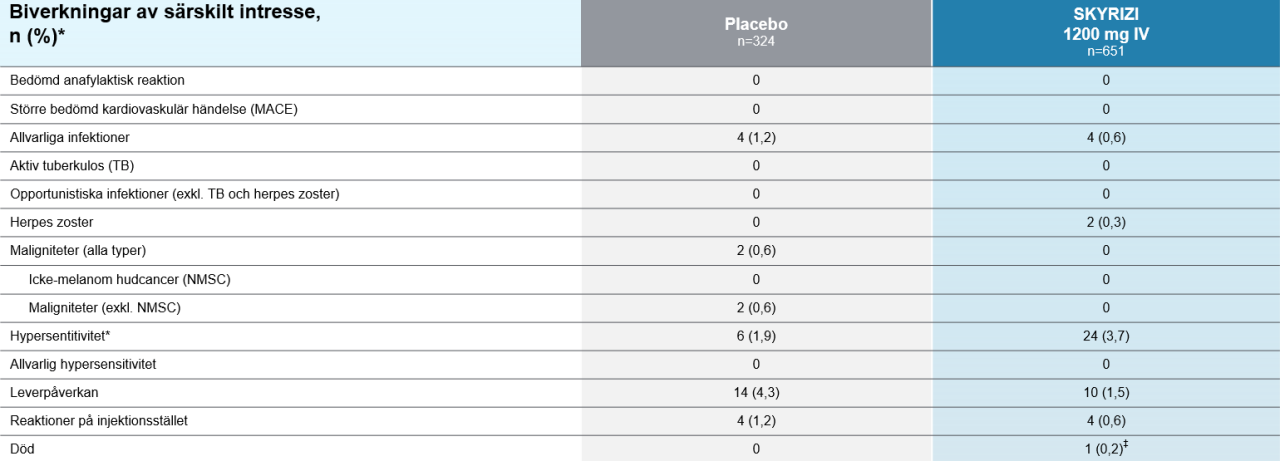
*Population säkerhetsanalys: Alla patienter som fått minst en dos av studieläkemedlet under studieperioden. ‡ Respiratorisk svikt till följd av COVID-19 infektion. Händelsen bedömdes av undersökaren som ej relaterad till behandlingen.
Biverkningar vecka 522
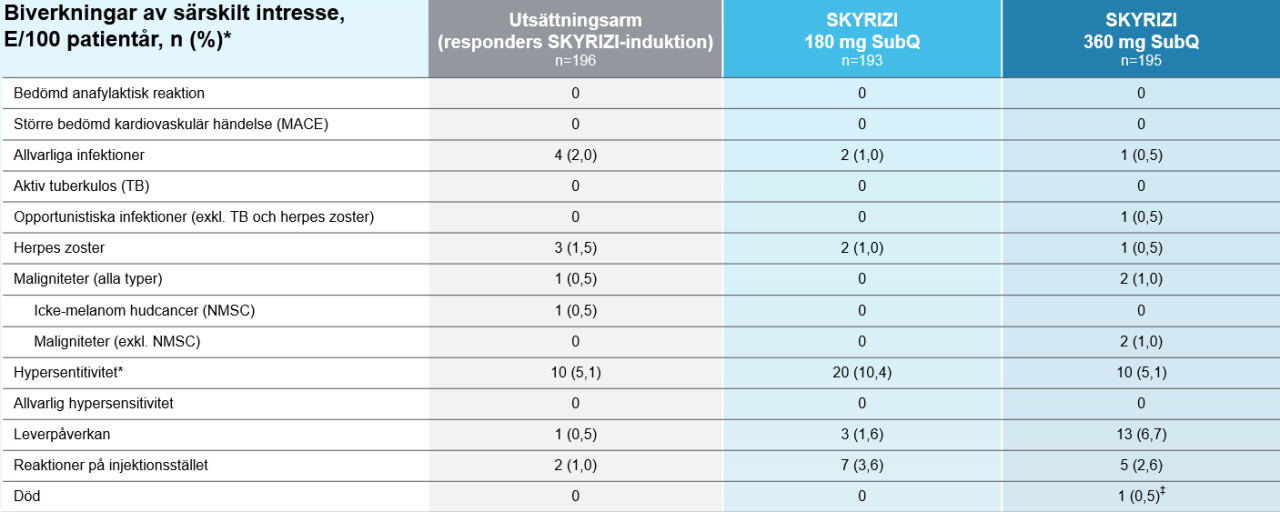
*Population säkerhetsanalys: Alla patienter som fått minst en dos av studieläkemedlet under studieperioden. ‡Patient med dyslipidemi, rökare sedan 34 år, drabbades av en hjärtinfarkt dag 411, efter 6 doser av studieläkemedlet. Händelsen bedömdes av undersökaren som ej relaterad till behandlingen.
Vad säger experterna?
Ta del av intressanta föreläsningar om kliniska studier, nya behandlingsformer och aktuella debattämnen inom IBD. På AbbVie Gastro vill vi dela med oss av forskning som resulterar i nya verktyg för dig som hjälper patienter med IBD.
Referenser:
1. SKYRIZI produktresumé, fass.se. 2. Louis E., et al. JAMA. 2024.12414.. 3. Panaccione R, et al J Crohns and Colitis 2025.
SKYRIZI® (risankizumab) 150 mg injektionsvätska, lösning i förfylld spruta eller förfylld penna (F), 600 mg koncentrat till infusionsvätska, lösning i injektionsflaska (EF), 360 mg injektionsvätska, lösning i cylinderampull, 1 självhäftande injektor (F), 180 mg injektionsvätska, lösning i cylinderampull, 1 självhäftande injektor (EF), Rx, L04AC18 (interleukinhämmare). Indikationer: Behandling av måttlig till svår plackpsoriasis hos vuxna som behöver systemisk behandling. Behandling, som monoterapi eller i kombination med metotrexat (MTX), av aktiv psoriasisartrit hos vuxna med otillräckligt behandlingssvar på eller intolerans mot ett eller flera sjukdomsmodifierande antireumatiska läkemedel (DMARDs). Behandling av vuxna med måttlig till svår aktiv Crohns sjukdom eller ulcerös kolit med otillräckligt behandlingssvar på, förlorat behandlingssvar eller intolerans mot konventionell behandling eller en biologisk behandling. Kontraindikationer: Överkänslighet mot den aktiva substansen eller mot något hjälpämne; Kliniskt betydelsefulla aktiva infektioner (t ex aktiv tuberkulos). Varningar och försiktighet: Risankizumab kan öka risken för infektion. Anafylaktiska reaktioner har rapporterats vid behandling med risankizumab. Avbryt omedelbart behandling och påbörja lämplig behandling om en allvarlig överkänslighetsreaktion inträffar. Fertilitet, graviditet och amning: Fertila kvinnor ska använda effektiv preventivmetod under pågående behandling och i minst 21 veckor efter avslutad behandling. Risankizumab bör undvikas under graviditet. Det är okänt om risankizumab utsöndras i bröstmjölken, risk-nyttabalansen för modern och barnet måste därför värderas. För ytterligare information samt priser se www.fass.se. Datum för översyn av produktresumé: 29 januari 2025. För information: kontakta AbbVie AB, 08 684 44 600. Begränsning av läkemedelsförmån: SKYRIZI 150 mg subventioneras endast vid plackpsoriasis och psoriasisartrit när behandling med TNF-hämmare gett otillräcklig effekt eller inte är lämplig. SKYRIZI 360 mg subventioneras för patienter som har behandlats med TNF-hämmare eller där detta inte är lämpligt. SKYRIZI 600 mg för intravenös infusion tillhandahålls som rekvisitionsläkemedel. Skyrizi 180 mg, för patienter med ulcerös kolit, ingår ännu inte i läkemedelsförmånen. Tills beslut om subvention är Skyrizi 180 mg tillgängligt via rekvisition.
SE-SKZG-240015 v3.0 juni 2025


