Rekommenderad dosering vid Crohns sjukdom ulcerös kolit1
Induktionsbehandling som administreras på klinik av hälso- och sjukvårdspersonal1
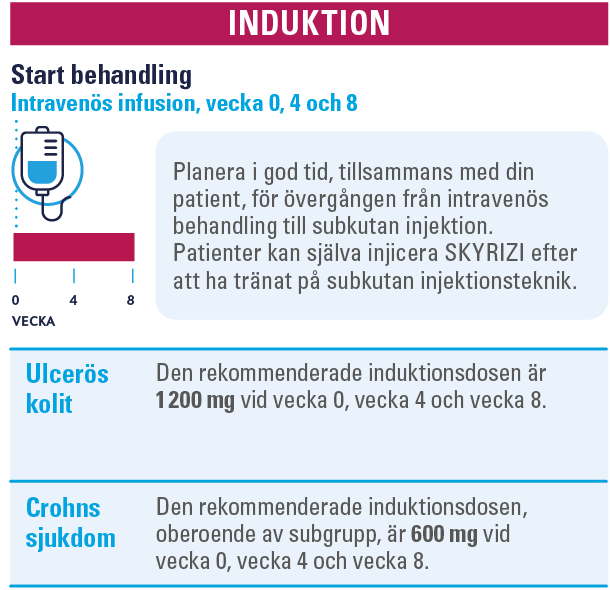
Inför behandlingsstart
Den rekommenderade dosen, oberoende av subgrupp, är 600 mg som administreras via intravenös infusion vid vecka 0, vecka 4 och vecka 8, följt av 360 mg administrerat via subkutan injektion vid vecka 12 och därefter var 8:e vecka. Kontrollera att vaccination med levande vaccin (tex BCG, gula febern eller vattkoppor) inte skett under de senaste 4 veckorna. Avdödat vaccin är OK.
Inför infusionsbehandling
Lösningen bereds genom spädning med natriumklorid 9 mg/ml (0,9%) infusionsvätska, lösning till en slutlig koncentration på cirka 1,2 mg/ml till 6 mg/ml. Spädd lösning för intravenös infusion kan förvaras i 20 timmar vid 2°C till 8°C (i skydd från ljus) eller upp till 8 timmar i rums-temperatur (i skydd från ljus). Infundera den spädda lösningen under minst en timme för 600 mg-dosen; minst två timmar för 1200 mg-dosen.
Underhållsbehandling som kan administreras av patienten1
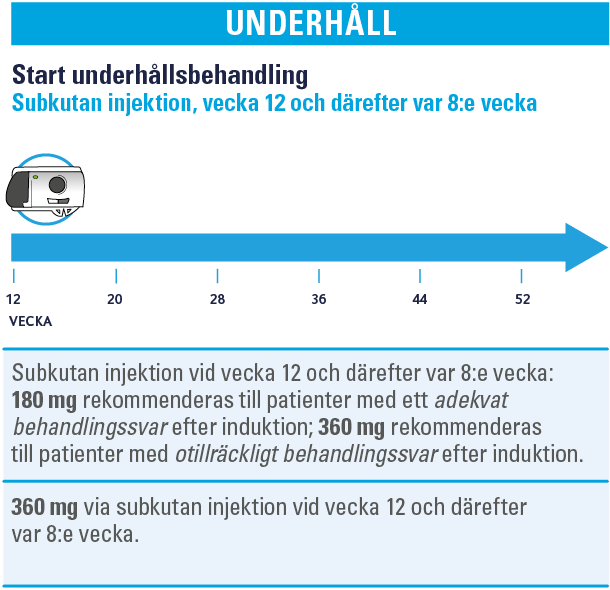
Inför subkutan behandling
Den självhäftande injektorn skall förvaras i kylskåp (2–8°C). Om det behövs kan du även förvara den utanför kylskåpet (högst 25°C) i upp till 24 timmar.
Behandlingsavbrott bör övervägas för patienter som inte har visat något svar efter 24 veckors behandling.
Läs bipacksedeln för SKYRIZI noggrant för detaljerad instruktion om administrering med självhäftande injektor.
Behöver du patientmaterial eller ett doskort?
Här kan du beställa material som stöd för dig som vårdgivare och de patienter som ska börja få behandling med SKYRIZI.

Referens: 1. SKYRIZI produktresumé, fass.se.
SKYRIZI® (risankizumab) 150 mg injektionsvätska, lösning i förfylld spruta eller förfylld penna (F), 600 mg koncentrat till infusionsvätska, lösning i injektionsflaska (EF), 360 mg injektionsvätska, lösning i cylinderampull, 1 självhäftande injektor (F), 180 mg injektionsvätska, lösning i cylinderampull, 1 självhäftande injektor (EF), Rx, L04AC18 (interleukinhämmare). Indikationer: Behandling av måttlig till svår plackpsoriasis hos vuxna som behöver systemisk behandling. Behandling, som monoterapi eller i kombination med metotrexat (MTX), av aktiv psoriasisartrit hos vuxna med otillräckligt behandlingssvar på eller intolerans mot ett eller flera sjukdomsmodifierande antireumatiska läkemedel (DMARDs). Behandling av vuxna med måttlig till svår aktiv Crohns sjukdom eller ulcerös kolit med otillräckligt behandlingssvar på, förlorat behandlingssvar eller intolerans mot konventionell behandling eller en biologisk behandling. Kontraindikationer: Överkänslighet mot den aktiva substansen eller mot något hjälpämne; Kliniskt betydelsefulla aktiva infektioner (t ex aktiv tuberkulos). Varningar och försiktighet: Risankizumab kan öka risken för infektion. Anafylaktiska reaktioner har rapporterats vid behandling med risankizumab. Avbryt omedelbart behandling och påbörja lämplig behandling om en allvarlig överkänslighetsreaktion inträffar. Fertilitet, graviditet och amning: Fertila kvinnor ska använda effektiv preventivmetod under pågående behandling och i minst 21 veckor efter avslutad behandling. Risankizumab bör undvikas under graviditet. Det är okänt om risankizumab utsöndras i bröstmjölken, risk-nyttabalansen för modern och barnet måste därför värderas. För ytterligare information samt priser se www.fass.se. Datum för översyn av produktresumé: 29 januari 2025. För information: kontakta AbbVie AB, 08 684 44 600. Begränsning av läkemedelsförmån: SKYRIZI 150 mg subventioneras endast vid plackpsoriasis och psoriasisartrit när behandling med TNF-hämmare gett otillräcklig effekt eller inte är lämplig. SKYRIZI 360 mg subventioneras för patienter som har behandlats med TNF-hämmare eller där detta inte är lämpligt. SKYRIZI 600 mg för intravenös infusion tillhandahålls som rekvisitionsläkemedel. Skyrizi 180 mg, för patienter med ulcerös kolit, ingår ännu inte i läkemedelsförmånen. Tills beslut om subvention är Skyrizi 180 mg tillgängligt via rekvisition.
SE-SKZG-240015 v3.0 juni 2025




