Studiedesign1,2
Effekt och säkerhet för RINVOQ vid Crohns sjukdom utvärderades i tre randomiserade, dubbelblinda, placebokontrollerade fas 3-multicenterstudier: två induktionsstudier, U‑EXCEED och U‑EXCEL, följt av en underhållsstudie på 52 veckor och en långsiktig förlängningsstudie, U‑ENDURE.1,2

Vid baslinjen i U-EXCEL och U-EXCEED behandlades 36 % respektive 34 % av patienterna med steroider. Av dessa var 38 % (n=63) i båda grupperna som behandlades med RINVOQ steroidfria 90 dagar innan vecka 52 och i klinisk remission, jämfört med 5 % (n=61) i placebogruppen.
† Patienter som behandlades med RINVOQ 45 mg och inte nådde klinisk respons (SF/APS) vecka 12.
Co-primära effektmått
Klinisk remission och endoskopiskt svar1,2
De co-primära effektmåtten var klinisk remission och endoskopiskt svar vid vecka 12 för U-EXCEL och U-EXCEED och vid vecka 52 för U-ENDURE.1,2
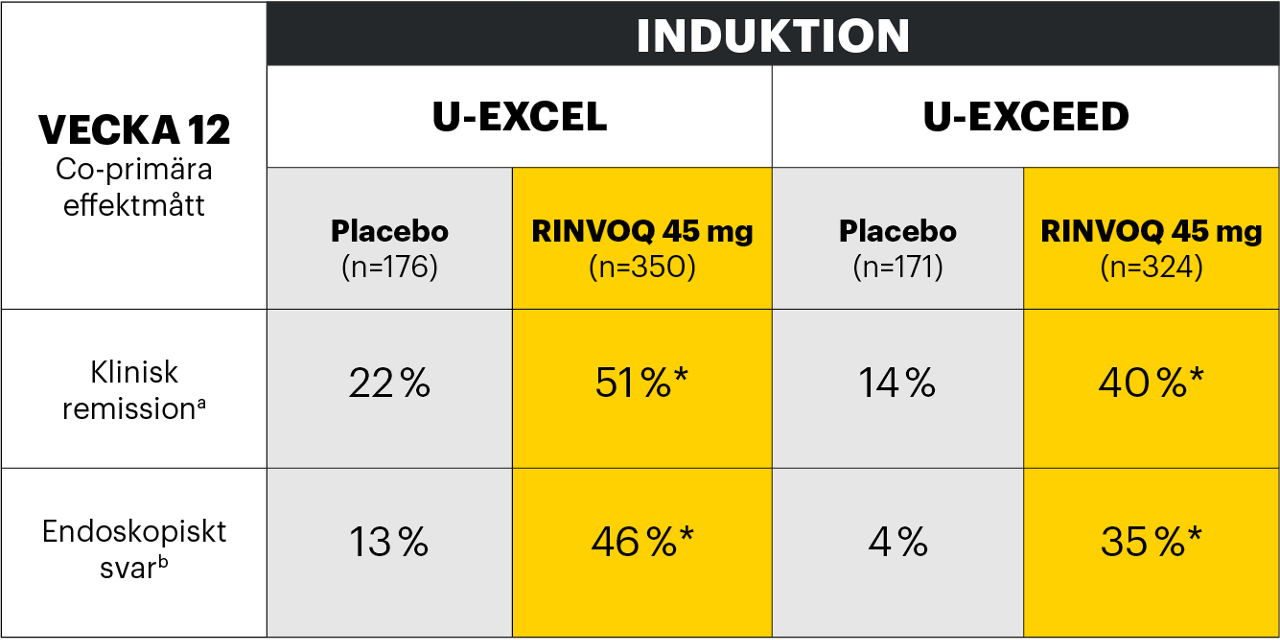
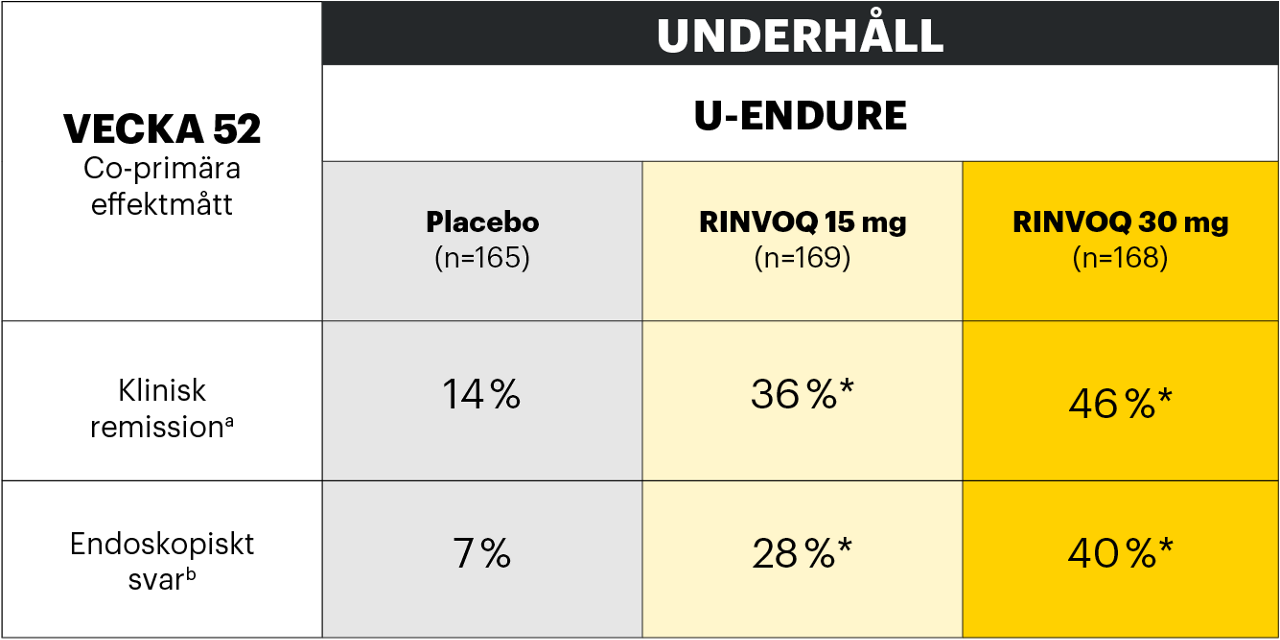
Adapted from Loftus et al. 2022
*p<0,001 vs placebo, multiplicitetskontrollerad analys (ITT).
a Genomsnittlig daglig SF ≤ 2,8 och APS ≤ 1,0 och ingen av dem större än vid baslinjen.
b Minskning av SES-CD > 50 % från baslinjen i induktionsstudien (eller för patienter med SES-CD på 4 vid baslinjen i induktionsstudien, minst 2 poängs minskning från baslinjen i induktionsstudien).
Sekundära effektmått
Tidig effekt - Klinisk respons (CR-100) vid vecka 2 och 121,2
Så tidigt som i vecka 2 visade RINVOQ signifikant bättre klinisk respons (CR-100), jämfört med placebogruppen.1,2

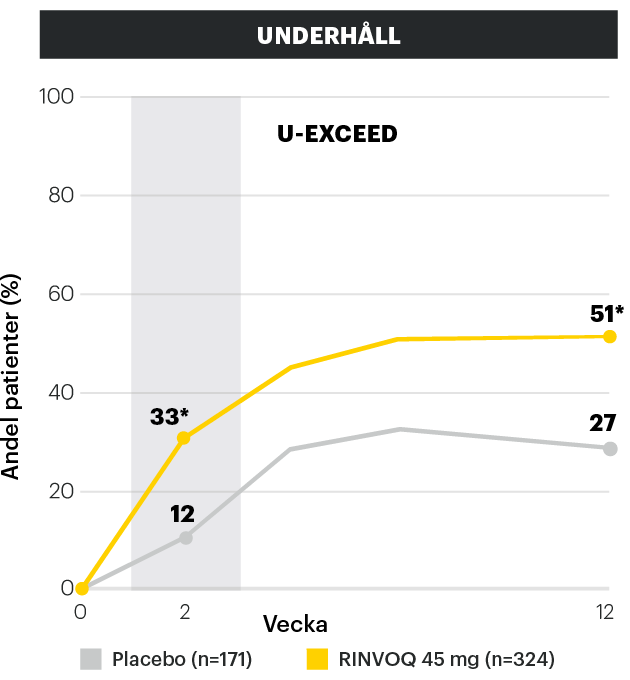
Adapted from Loftus et al. 2022
Klinisk respons definieras som en minskning av CDAI med minst 100 poäng från baseline (CR-100).
*p<0.001 RINVOQ vs placebo
**p<0.01 RINVOQ vs placebo
Slemhinneläkning (avsaknad av ulcerationer) vid vecka 12 och 521,2
En större andel patienter som behandlades med RINVOQ uppnådde slemhinneläkning vid vecka 12 och vecka 52, jämfört med placebo.1,2


Adapted from Loftus et al. 2023
*nominellt p<0,001 RINVOQ vs placebo.
Slemhinneläkning: SES-CD ulceration subscore 0 hos patienter med SES-CD ulceration subscore ≥1 vid baslinjen.
Vecka 12 utvärderades randomiserade patienter som fått minst en dos av studieläkemedlet under induktionsbehandlingen2 .
Vecka 52 utvärderades 502 patienter som nått klinisk respons (SF/APS) under 12 veckors induktion med RINVOQ 45 mg.
Måttlig till svår aktiv ulcerös kolit hos vuxna.
Måttlig till svår aktiv Crohns sjukdom hos vuxna.
Måttlig till svår aktiv reumatoid artrit hos vuxna.
Aktiv psoriasisartrit hos vuxna.
Aktiv icke-radiografisk axial spondylartrit (nr-axSpA) hos vuxna.
Aktiv ankyloserande spondylit (AS, radiografisk axial spondylartrit) hos vuxna.
Måttlig till svår atopisk dermatit hos vuxna och ungdomar 12 år och äldre.
Hos vuxna med jättecellsartrit (GCA).
I de placebokontrollerade kliniska induktions- och underhållsstudierna vid ulcerös kolit och Crohns sjukdom var de vanligaste rapporterade biverkningarna med upadacitinib 45 mg, 30 mg eller 15 mg övre luftvägsinfektion, pyrexi, förhöjt CK i blodet, anemi, huvudvärk, akne, herpes zoster, neutropeni och hudutslag. Den vanligaste allvarliga biverkningen var allvarliga infektioner.1
Behandlingsrelaterade biverkningar vecka 121,2
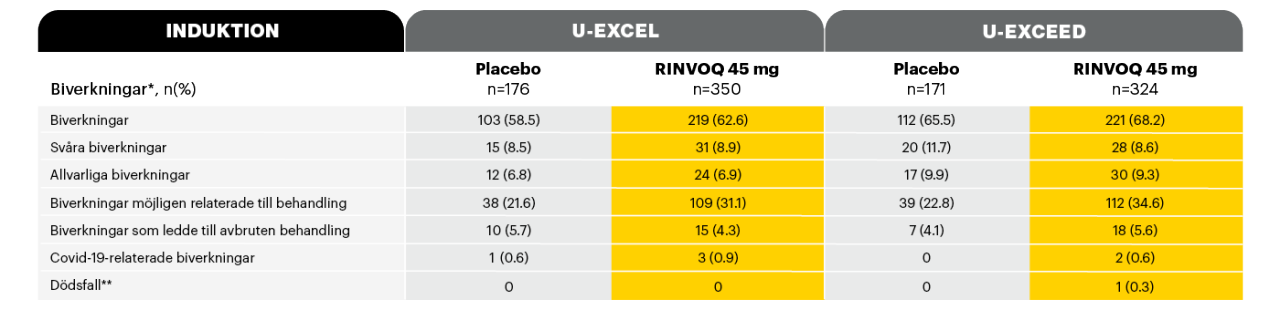
Adapted from Loftus et al. 2022
* Säkerhetstabellen inkluderar alla patienter som fått minst en dos av RINVOQ eller placebo som induktionsbehandling.
** Inklusive ej behandlingsrelaterad död. Det förekom ett dödsfall, (p g a septisk chock) i RINVOQ 45 mg-armen, 159 dagar efter att patienten i förtid avbrutit studien.
Biverkningar av särskilt intresse vecka 121,2
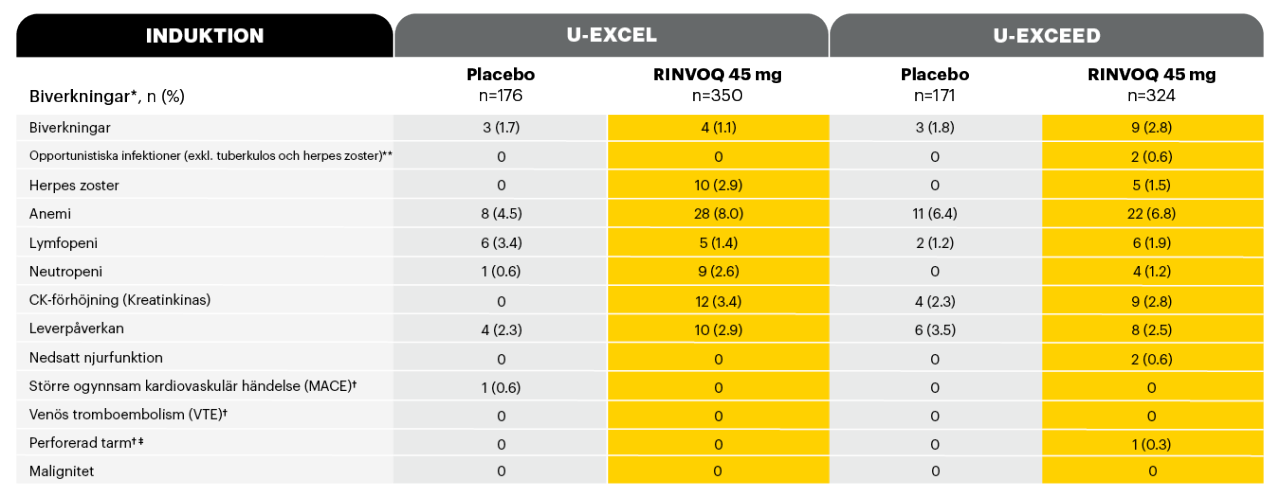
Adapted from Loftus et al. 2023
* Säkerhetstabellen inkluderar alla patienter som fått minst en dos av RINVOQ eller placebo som induktionsbehandling.
** Opportunistisk infektion i U-EXCEED inkluderade cytomegalovirusinfektion hos en patient och pneumocystis jirovecii hos en patient (båda med RINVOQ 45 mg).
† Dessa händelser fastställdes av externa bedömare.
‡ Gastrointestinal perforation utvecklades hos 3 patienter som fick RINVOQ 45 mg under den förlängda behandlingsperioden av U-EXCEED.
Behandlingsrelaterade biverkningar vecka 521,2
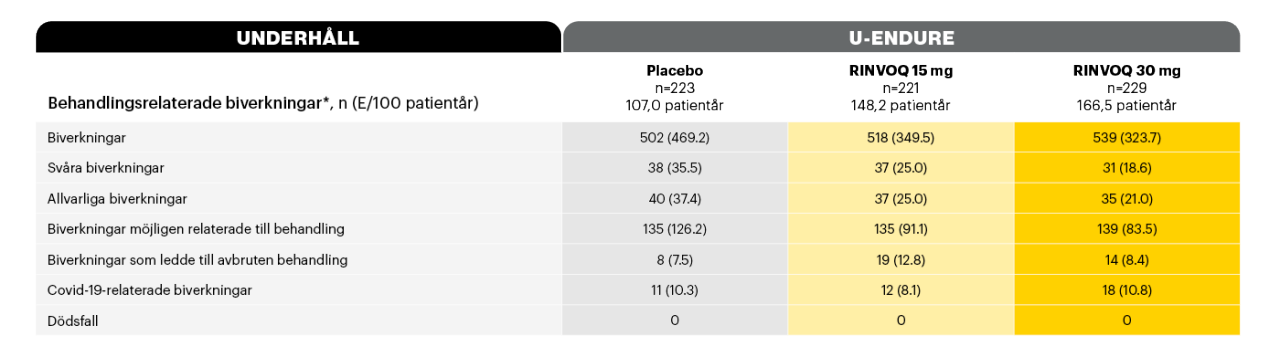
Adapted from Loftus et al. 2023
*Säkerhetstabellen inkluderar alla patienter som fått minst en dos av RINVOQ eller placebo som induktionsbehandling.
Biverkningar av särskilt intresse vecka 521,2

Adapted from Loftus et al. 2023
* Säkerhetstabellen inkluderar alla patienter som fått minst en dos av RINVOQ eller placebo som underhållsbehandling.
** Opportunistisk infektion i U-ENDURE rapporterades hos en patient på RINVOQ 15 mg (pneumocystis jirovecii) och hos en patient på RINVOQ 30 mg (esofagal candidiasis).
† Dessa händelser fastställdes av externa bedömare.
‡ Gastrointestinal perforation utvecklades hos 3 patienter som fick RINVOQ 45 mg under den förlängda behandlingsperioden av U-EXCEED. '
§ Metastaserad äggstockscancer hos en patient som behandlades med RINVOQ 15 mg; tjocktarmscancer samt invasiv lobulär bröstcancer hos en patient vardera som behandlades med RINVOQ 30 mg.
Vad säger experterna?
Ta del av intressanta föreläsningar om kliniska studier, nya behandlingsformer och aktuella debattämnen inom IBD. På AbbVie Gastro vill vi dela med oss av forskning som resulterar i nya verktyg för dig som hjälper patienter med IBD. Se våra filmade webbinarier här.
Får vi hålla dig uppdaterad?
Prenumerera på AbbVie Gastros nyhetsbrev. Då får du kontinuerlig information om nya produkter, indikationer och utbildningar för dig som möter patienter med IBD.

Referenser: 1. RINVOQ produktresumé, fass.se. 2. E.V. Loftus, JR., J. Panes, A.P. Lacerda, Upadacitinib Induction and Maintenance Therapy for Crohn's Disease, N Engl J Med 2023;388:1966–80.
RINVOQ® (upadacitinib), depottablett 15 mg, 30 mg, 45 mg (F), Rx, ATC-kod L04AF03 JAK-hämmare. Indikationer: måttlig till svår aktiv reumatoid artrit hos vuxna med otillräckligt behandlingssvar på eller intolerans mot ett eller flera DMARDs i monoterapi eller i kombination med metotrexat. Aktiv psoriasisartrit hos vuxna med otillräckligt behandlingssvar på eller intolerans mot ett eller flera DMARDs, i monoterapi eller i kombination med metotrexat. Axial spondylartrit: – Aktiv icke-radiografisk axial spondylartrit hos vuxna med objektiva tecken på inflammation som anges av förhöjda nivåer av CRP och/eller MRI, som har otillräckligt behandlingssvar på NSAID. – Aktiv ankyloserande spondylit (radiografisk axial spondylartrit) hos vuxna med otillräckligt behandlingssvar på konventionell behandling. Hos vuxna med jättecellsartrit (GCA) . Måttlig till svår atopisk dermatit hos vuxna och ungdomar 12 år och äldre vilka är aktuella för systemisk behandling. Måttlig till svår aktiv ulcerös kolit eller Crohns sjukdom hos vuxna med otillräckligt behandlingssvar, förlorat behandlingssvar eller som varit intoleranta mot konventionell behandling eller biologiska läkemedel. Kontraindikationer: Överkänslighet mot den aktiva substansen eller mot något hjälpämne. Aktiv tuberkulos (TB) eller aktiv allvarlig infektion. Gravt nedsatt leverfunktion. Graviditet. Effekter på förmågan att framföra fordon: RINVOQ kan ha en liten effekt på förmågan att framföra fordon och använda maskiner eftersom yrsel och vertigo kan inträffa under behandling. Varningar och försiktighet: RINVOQ ska endast användas om inga lämpliga behandlingsalternativ är tillgängliga för patienter: som är 65 år eller äldre; med en anamnes på aterosklerotisk hjärt-kärlsjukdom eller andra kardiovaskulära riskfaktorer (t.ex. nuvarande eller tidigare långtidsrökare); med riskfaktorer för malignitet (t.ex. nuvarande eller tidigare malignitet). RINVOQ ska inte påbörjas hos patienter med aktiva, allvarliga infektioner, inkl. lokala infektioner och TB. Virusreaktivering, inkl. fall av reaktivering av herpesvirus (t.ex. herpes zoster), har rapporterats i kliniska studier. Påbörja inte eller avbryt tillfälligt behandling om onormala lab-värden som anemi, neutropeni, lymfopeni och levertransaminaser påträffas. RINVOQ associerades med ökade lipidparametrar i kliniska studier. Divertikulit och gastrointestinal perforation har rapporteras i kliniska prövningar och från klinisk erfarenhet. Patienter med aktiv Crohns sjukdom löper ökad risk att utveckla tarmperforation. VTE har rapporterats hos patienter på RINVOQ. Hos patienter med kända VTE-riskfaktorer ska RINVOQ användas med försiktighet. Allvarliga överkänslighetsreaktioner har rapporterats med RINVOQ. Fertilitet, graviditet och amning: Fertila kvinnor ska rådas använda effektiv preventivmetod under behandling och i minst 4 veckor efter avslutad behandling. RINVOQ är kontraindicerat under graviditet och ska inte användas under amning. För ytterligare information samt priser se www.fass.se. För information: kontakta AbbVie AB, 08 684 44 600. Datum för översyn av produktresumén: 2 juni 2025.
Begränsning av läkemedelsförmån: RINVOQ subventioneras 1) när behandling med TNF-hämmare gett otillräcklig effekt eller inte är lämplig 2) för patienter med atopisk dermatit när konventionell topikal eller systemisk behandling gett otillräcklig effekt eller inte är lämplig 3) för patienter med jättecellsarterit.
SE-RNQG-230059 v3.0 september 2025



.png)
