Om Produodopa
En ny måte å administrere levodopa på.
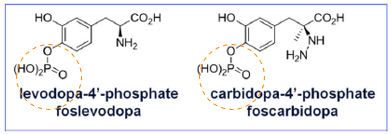
PRODUODOPA er en prodrug-kombinasjon av levodopamonofosfat og karbidopamonofosfat (forhold 20:1) i en oppløsning for kontinuerlig subkutan infusjon i 24 timer per dag.
Foslevodopa og foskarbidopa konverteres in vivo til levodopa og karbidopa. Levodopa lindrer symptomer på Parkinsons sykdom etter dekarboksylering til dopamin i hjernen. Karbidopa passerer ikke blod-hjernebarieren og hemmer ekstracerebral dekarboksylering av levodopa til dopamin, noe som medfører at en større mengde levodopa blir tilgjengelig for transport til hjernen og omdanning til dopamin.1,2

Foslevodopa og foskarbidopa konverteres in vivo til levodopa og karbidopa. Levodopa lindrer symptomer på Parkinsons sykdom etter dekarboksylering til dopamin i hjernen. Karbidopa som ikke passerer blod-hjernebarrieren, hemmer ekstracerebral dekarboksylering av levodopa til dopamin, noe som medfører at en større mengde levodopa blir tilgjengelig for transport til hjernen og omdanning til dopamin.1
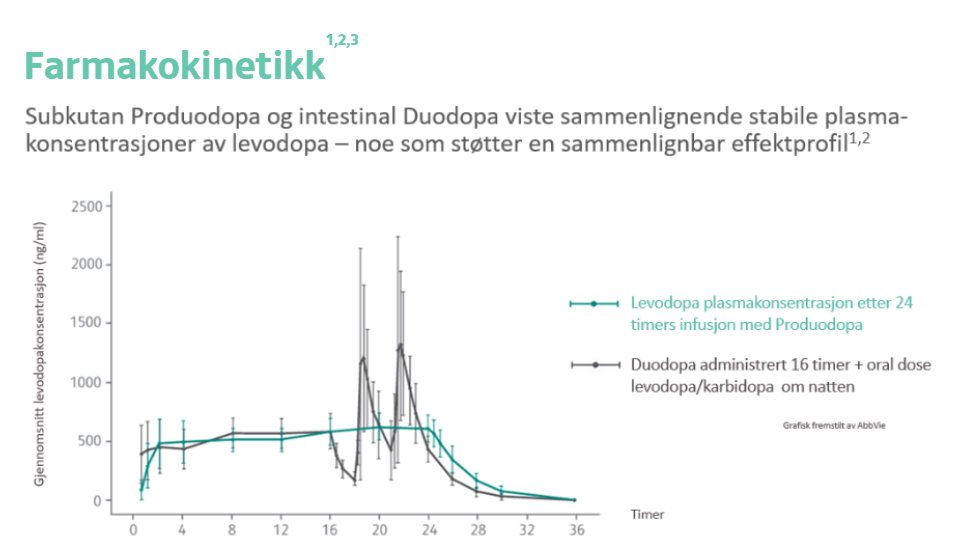
Subkutan Produodopa og intestinal Duodopa viste sammenlignende stabile plasmakonsentrasjon av levodopa – noe som støtter sammenlignbar effektprofil.2,3
Sammenlignbar effektprofil som Duodopa2
Reduksjon av motoriske fluktuasjoner som gir:
- Økt ON-tid uten plagsomme dyskinesier.
- Mindre OFF-tid.
KLINISKE DATA /Sikkerhet og effekt4

Fase 3, singel-arm, open-label studie.
Evaluering av sikkerhet og effekt med 24-timers daglig
kontinuerlig subkutan infusjon med Produodopa.
Utvalgte inklusjonskriterier
Levodopafølsom Parkinsons sykdom.
Minst 2,5 timer i OFF-tid/dag registrert ved hjelp av Parkinson-dagbok.
Uttalte motoriske symptomer på nåværende behandling.
Mindre OFF-tid med Produodopa
Ved uke 52 var gjennomsnittlig SD-endring fra baseline i normalisert OFF-tid — 3,5 timer (n=244, p<0,001- som representerer 59% reduksjon i OFF-tid fra baseline).

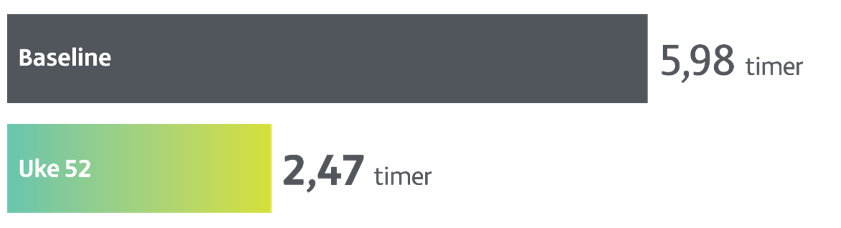
OFF-tid ble målt ved hjelp av Parkinson-dagbok (timer).
Forbedring i ON-tid uten plagsomme dyskinesier
Ved uke 52 var gjennomsnittlig SD-endring fra baseline i normalisert On-time uten plagsom dyskinesi — 3,8 timer — 41% økning fra baseline, n=244, p < 0,001.

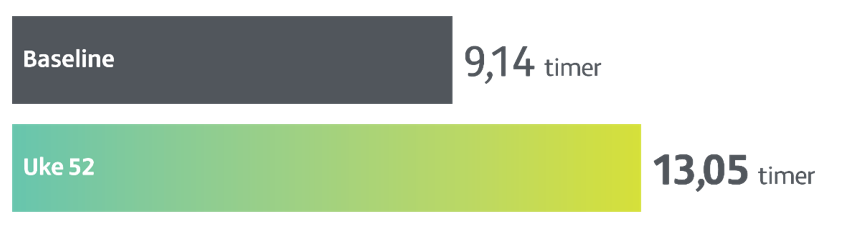
ON-tid uten plagsomme dyskinesier ble målt ved hjelp av Parkinson-dagbok (timer).
Primært endepunkt: Sikkerhet og bivirkninger4

De fleste hendelser relatert til infusjonsstedet var ikke alvorlige, men milde eller moderate i alvorlighetsgrad og ble løst spontant med behandling.
Hudens tolerabilitet ble vurdert ved hjelp av Infusion Site Evaluation Scale (uttalte hudreaksjoner: numerisk verdi på 5,6 eller 7 og en bokstavgrad på D, E, F eller G. 10,2 % hadde minst 1 observasjon med numerisk verdi ≥ 5 og en bokstavgrad ≥ D.
REFERANSER
1. Rosebraugh M, Voight EM, Moussa EM et al. Foslevodopa/Foscarbidopa: A New Subcutaneous Treatment for Parkinson's Disease. Ann Neurol. 2021 Jul;90(1):52-61.
2. Produodopa SPC, avsnitt 2, 4.2, 5.1, sist godkjent 23.11.2023.
3. Rosebraugh M, Sodtmann S, Liu W, Facheris MF. Foslevodopa/foscarbidopa subqutaneous infusion maintains eqvivalent levodopa exposure to levodopa. Parkin and Relat Dis 97 (2022) 68-72.
4. Aldred J, Freire-Alvarez E, Amelin AV et al. Foslevodopa/foscarbidopa in Parkinson’s disease: Safety and Efficacy Results from 12 –Month Neurol Ther (2023) 12:1937-1958.
NO-PRODD-230021 v8, Februar 2026