Note to affiliates: This update to the venetoclax CLL AbbVie Pro site includes a homepage headline, updated CLL14 6-year, CLL13 4-year, MURANO 7-year data sets, and other streamlined content updates. CLL 13 4-year update reflects the CLL13 data from the Lancet Oncology publication. The CLL14 6-year and MURANO 7-year data have been updated based on the EHA 2023 abstracts. For countries that cannot use these data sets, please follow local regulations and MRLO guidance, and revert to CLL14 5-year and MURANO 5-year published data from the product label.
Primary analysis in ITT population for VEN+O vs O+Clb1:
INV-assessed PFS†: Reduced risk of progression or death (HR=0.35; 95% CI: 0.23–0.53 [P<0.0001]).
| • | Median follow-up of 28 months |
Additional analyses:
6-year PFS estimate (INV-assessed)2‡: 53% vs 22% (HR=0.40; 95% CI: 0.31–0.52) after 5 years off treatment.
| • | Median PFS of 76.2 months with VEN+O vs 36.4 months with O+Clb |
INV-assessed complete remission (CR/CRi)1: 50% vs 23% (P<0.0001).
| • | ORR: 85% (95% CI: 79.2–89.2) vs 71% (95% CI: 64.8–77.2 [P=0.0007]) |
Primary analysis in ITT population for VEN+R vs BR1:
INV-assessed PFS†: Reduced risk of progression or death (HR=0.17; 95% CI: 0.11–0.25 [P<0.0001]).
| • | Median follow-up of 23.8 months |
Additional analyses:
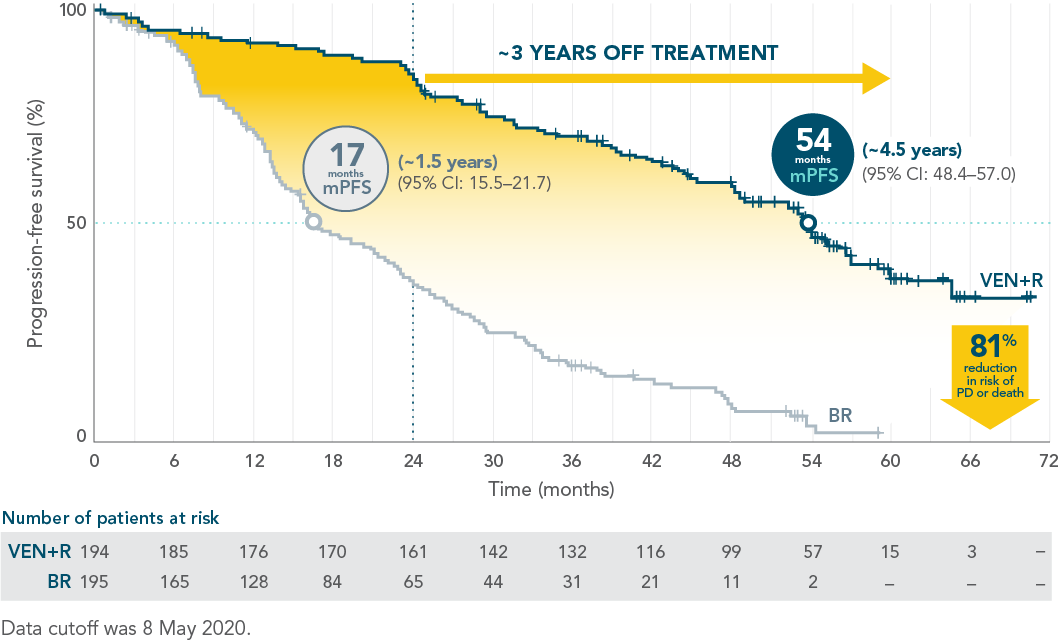
7-year PFS estimate (INV-assessed)3‡: 23% (HR=0.23; 95% CI: 0.18–0.29) vs NE after ~5 years off treatment.
| • | Median PFS of 54.7 months with VEN+R (95% CI: 52.3–59.9) vs 17.0 months with BR (95% CI: 15.5–21.7) |
INV-assessed complete remission (CR/CRi)1‡: 27% vs 8%.
| • | ORR: 93% (95% CI: 88.8–96.4) vs 68% (95% CI: 60.6–74.2) |
*See full dosing information for VEN+O and for VEN+R in the dosing and administration section.
†Primary endpoint.
‡Results are descriptive only.
1L=first line; CLL=chronic lymphocytic leukaemia; VEN+O=VENCLYXTO + obinutuzumab; ITT=intent to treat; O+Clb=obinutuzumab + chlorambucil; INV=investigator; PFS=progression-free survival; HR=hazard ratio; CI=confidence interval; CR=complete remission; CRi=complete remission with incomplete bone marrow recovery; ORR=overall response rate; 2L+=second line + later lines of therapy; VEN+R=VENCLYXTO + rituximab; BR=bendamustine + rituximab; NE=not evaluable.
test
Η ΜΕΛΕΤΗ MURANO ΣΧΕΔΙΑΣΤΗΚΕ ΓΙΑ ΝΑ ΕΠΙΤΡΕΠΕΙ ΣΤΟΥΣ ΑΣΘΕΝΕΙΣ ΝΑ ΟΛΟΚΛΗΡΩΝΟΥΝ ΤΗ ΘΕΡΑΠΕΙΑ VENCLYXTO® + RITUXIMAB ΜΕΣΑ ΣΕ ~2 ΕΤΗ1*
*Η MURANO ήταν μία πολυκεντρική, ανοιχτής επισήμανσης, μελέτη φάσης 3. Ολοκλήρωση της θεραπείας μετά από είκοσι τέσσερις κύκλους 28 ημερών.
†VENCLYXTO® 400mg ημερησίως μετά από την περίοδο τιτλοποίησης διάρκειας 5 εβδομάδων χωρίς εξέλιξη της νόσου ή μη αποδεκτή τοξικότητα.
‡Δοσολογία Rituximab: 375mg/m2 IV κατά την Ημέρα 1, Κύκλο 1 (που ξεκινά μετά από σχήμα τιτλοποίησης της δόσης διάρκειας 5 εβδομάδων), 500mg/m2 IV στους Κύκλους 2-6. Κάθε κύκλος ήταν 28 ημερών.
§Δοσολογία Bendamustin: 70mg/m2 IV κατά τις Ημέρες 1 και 2,στους Κύκλους 1-6. Κάθε κύκλος ήταν 28 ημερών.
||Με την έναρξη του Κύκλου 1, Ημέρας 1 του rituximab.
Επιλογή κριτηρίων για την ένταξη στη μελέτη9
| • | Ασθενείς που είχαν λάβει τουλάχιστον 1 προηγούμενη θεραπεία (συμπεριλαμβανομένου τουλάχιστον 1 σχήματος που να περιελάμβανε χημειοθεραπεία) |
| • | Ασθενείς που είχαν λάβει προηγούμενη θεραπεία με bendamustine, με την προϋπόθεση ότι η διάρκεια της ανταπόκρισης ήταν για ≥ 2 έτη |
Πρωτεύον καταληκτικό σημείο
| • | Εκτιμώμενη από τον ερευνητή PFS¶ |
Επιλογή δευτερευόντων καταληκτικών σημείων
| • | PFS εκτιμώμενη από IRC |
| • | ORR, CR, CRi, nPR και PR (ORR=CR+CRi+ nPR+PR) που αξιολογήθηκαν από τον ερευνητή και από IRC |
| • | Συνολική επιβίωση (OS) |
| • | Ποσοστά αρνητικοποίησης της MRD στο τέλος της θεραπείας# |
¶Υπολογίσθηκε με τη χρήση των αναθεωρημένων κατευθυντήριων οδηγιών iwCLL του NCI-WG (2008)
*Η ελάχιστη υπολλειματική νόσος (MRD) υπολογίσθηκε στο περιφερικό αίμα και/ή στο μυελό των οστών με τη χρήση της ASO-PCR και/ή της κυτταρομετρίας ροής. Το όριο αρνητικοποίησης (μη ανιχνεύσιμη MRD) ήταν <1 κύτταρο CLL ανά 104 λευκοκύτταρα..
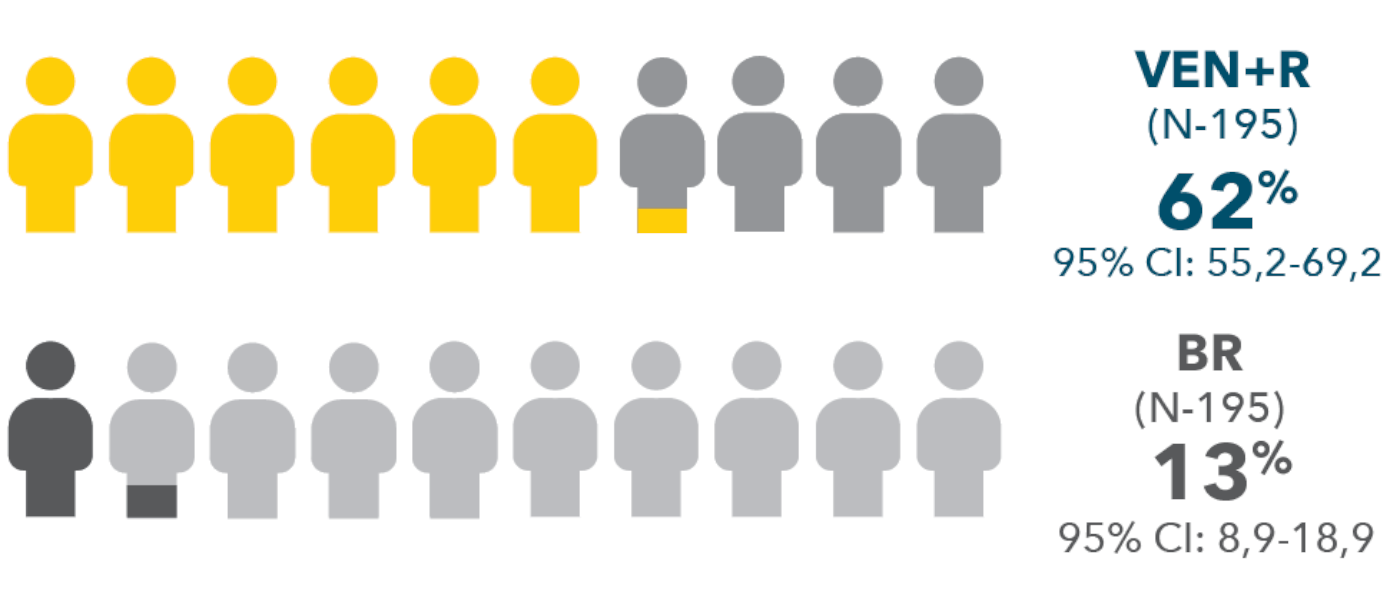
Ο ΣΥΝΔΥΑΣΜΟΣ VENCLYXTO® + RITUXIMAB ΟΔΗΓΕΙ ΣΕ ΕΠΙΤΕΥΞΗ ΜΗ ΑΝΙΧΝΕΥΣΙΜΗΣ ΕΛΑΧΙΣΤΗΣ ΥΠΟΛΕΙΠΟΜΕΝΗΣ ΝΟΣΟΥ (uMRD) ΣΤΟ ΠΕΡΙΦΕΡΙΚΟ ΑΙΜΑ ΚΑΙ ΠΛΗΡΕΙΣ ΥΦΕΣΕΙΣ ΣΤΗΝ 2Η ΓΡΑΜΜΗ ΘΕΡΑΠΕΙΑΣ ΓΙΑ ΤΗΝ ΧΛΛ1
ΣΤΟ ΠΕΡΙΦΕΡΙΚΟ ΑΙΜΑ
| • | Τα ποσοστά του uMRD στο μυελό των οστών κατά το τέλος της κλινικής μελέτης ήταν 16% (95% CI: 10,7-21,3) στο σκέλος του VEN+R και 1% (95% CI: 0,1-3,7) στο σκέλος του BR.1 |
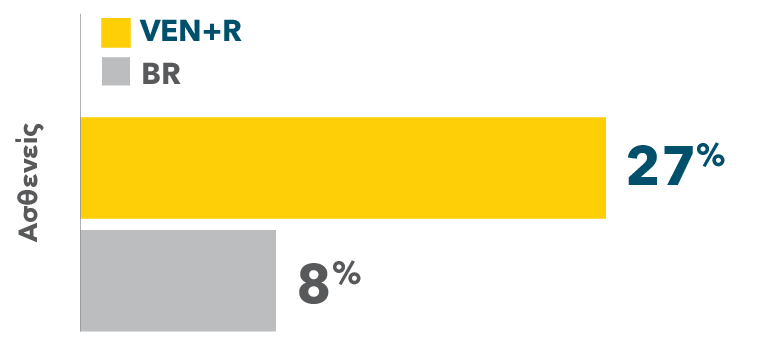
Πάνω από 3πλάσιοι ασθενείς πέτυχαν πλήρη ύφεση με VEN+R (27%) σε σχέση με BR (8%)1
ΠΟΣΟΣΤΟ ΠΛΗΡΟΥΣ ΥΦΕΣΗΣ (CR/CRi)
Προσαρμογή από: Venclyxto ΠΧΠ, Οκτώβριος 2022
††Παρουσιάζονται τα αποτελέσματα uMRD (δευτερεύον καταληκτικό σημείο) στον ΙΤΤ πληθυσμό.
Το καταλυτικό σημείο για μη ανιχνεύσιμο (αρνητικό) αποτέλεσμα ήταν <1 κύτταρο CLL ανά 104 λευκοκύτταρα.
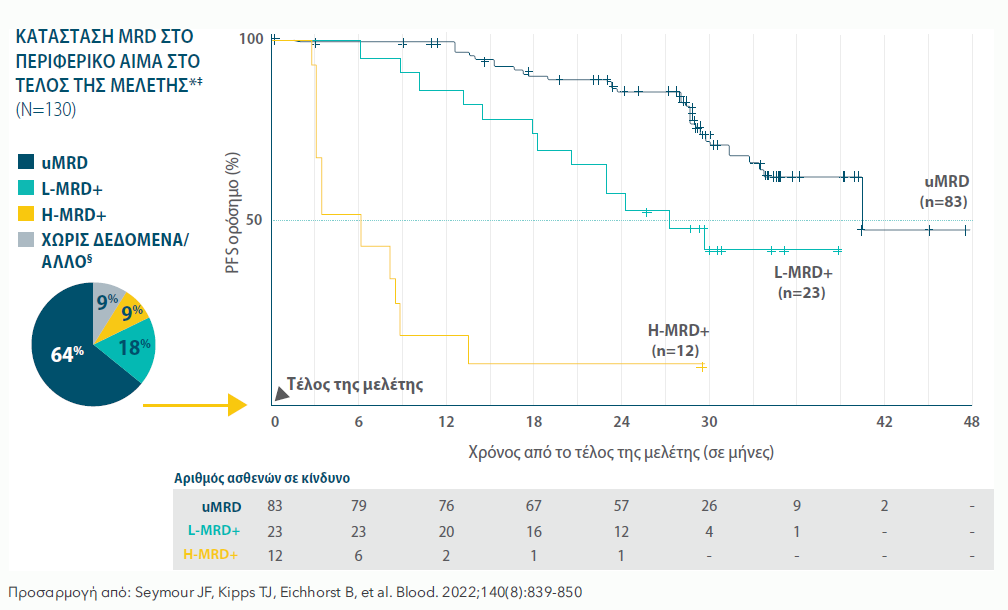
Η PFS ΕΚΤΙΜΗΘΗΚΕ ΣΕ ΑΞΙΟΛΟΓΗΣΙΜΟΥΣ ΑΣΘΕΝΕΙΣ ΠΟΥ ΠΕΤΥΧΑΝ uMRD ΣΤΟ ΠΕΡΙΦΕΡΙΚΟ ΑΙΜΑ ΚΑΤΑ ΤΟ ΤΕΛΟΣ ΤΗΣ ΜΕΛΕΤΗΣ14,15*†
Διάμεση διάρκεια παρακολούθησης 59 μήνες (εύρος 0-71,5 μήνες).15
VEN+R: ΠΟΣΟΣΤΑ PFS ΜΕ ΒΑΣΗ ΤΗΝ ΚΑΤΑΣΤΑΣΗ MRD* ΣΤΟ ΠΕΡΙΦΕΡΙΚΟ ΑΙΜΑ ΚΑΤΑ ΤΟ ΤΕΛΟΣ ΤΗΣ ΜΕΛΕΤΗΣ ΣΤΗΝ ΑΝΑΛΥΣΗ ΤΗΣ 5-ΕΤΙΑΣ† (N=130)‡
*Δεδομένα σε αξιολογήσιμους ασθενείς που ολοκλήρωσαν τη θεραπεία VEN+R χωρίς εξελισσόμενη νόσο. Δεν έγινε έλεγχος για στατιστική σημαντικότητα.1
†Η ASO-PCR και η κυτταρομετρία ροής χρησιμοποιήθηκαν στην κεντρική ανάλυση διαδοχικών δειγμάτων MRD περιφερικού αίματος.
‡uMRD=<10-4 κύτταρα ΧΛΛ; L-MRD+=10-4 έως <10-2 κύτταρα ΧΛΛ; H-MRD+=≥10-2 κύτταρα ΧΛΛ.15
§Χωρίς δεδομένα/Άλλο ορίζεται ως οι ασθενείς χωρίς κατάσταση MRD κατά το τέλος της μελέτης.
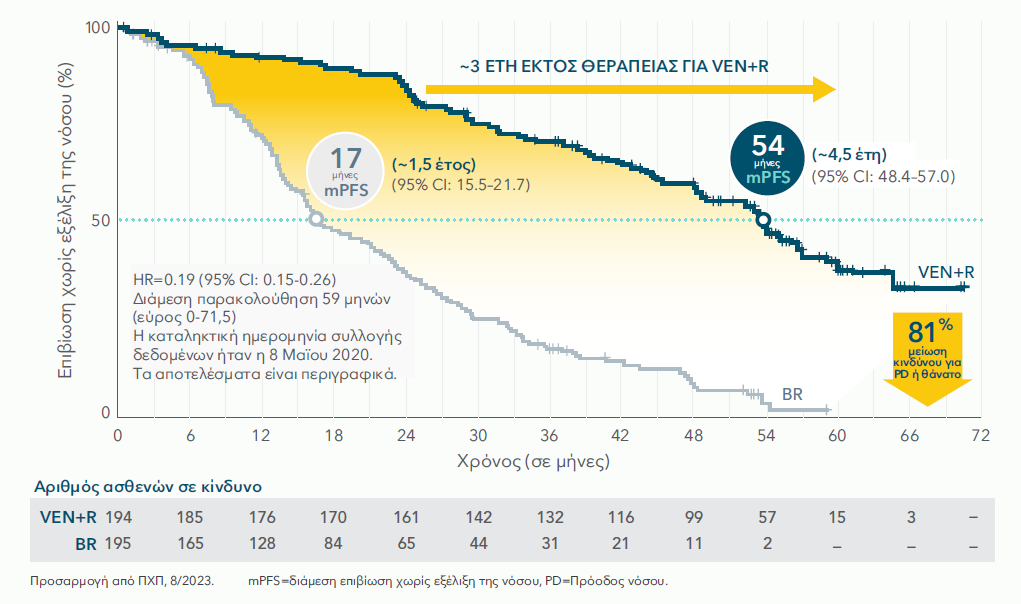
ΤΟ ΌΦΕΛΟΣ ΣΤΗΝ PFS ΤΟΥ ΣΥΝΔΥΑΣΜΟΎ VENCLYXTO® + RITUXIMAB ΈΝΑΝΤΙ ΤΟΥ BR ΔΙΑΤΗΡΉΘΗΚΕ ΚΑΤΆ ΤΗΝ 5ΕΤΗ & 7ΕΤΗ ΠΑΡΑΚΟΛΟΎΘΗΣΗ1,21
Αναθεωρημένη ανάλυση 7-ετίας
Αναθεωρημένη ανάλυση 7-ετίας Η διάμεση PFS επιτεύχθει στους 55 μήνες με VEN+R (95% CI: 52.3–59.9) έναντι 17 μήνες (95% CI: 15.5–21.7) με BR (HR=0.25). 21
Διάμεση επιβίωση χωρίς εξέλιξη της νόσου (mPFS) κατά τον ερευνητή (επικαιροποιημένη ανάλυση 5 ετών - πληθυσμός ITT)1
Προσαρμογή από ΠΧΠ, 8/2023.
mPFS=διάμεση επιβίωση χωρίς εξέλιξη της νόσου, PD=Πρόοδος νόσου.
Το όφελος της PFS διατηρήθηκε για περίπου 5 χρόνια εκτός θεραπείας21
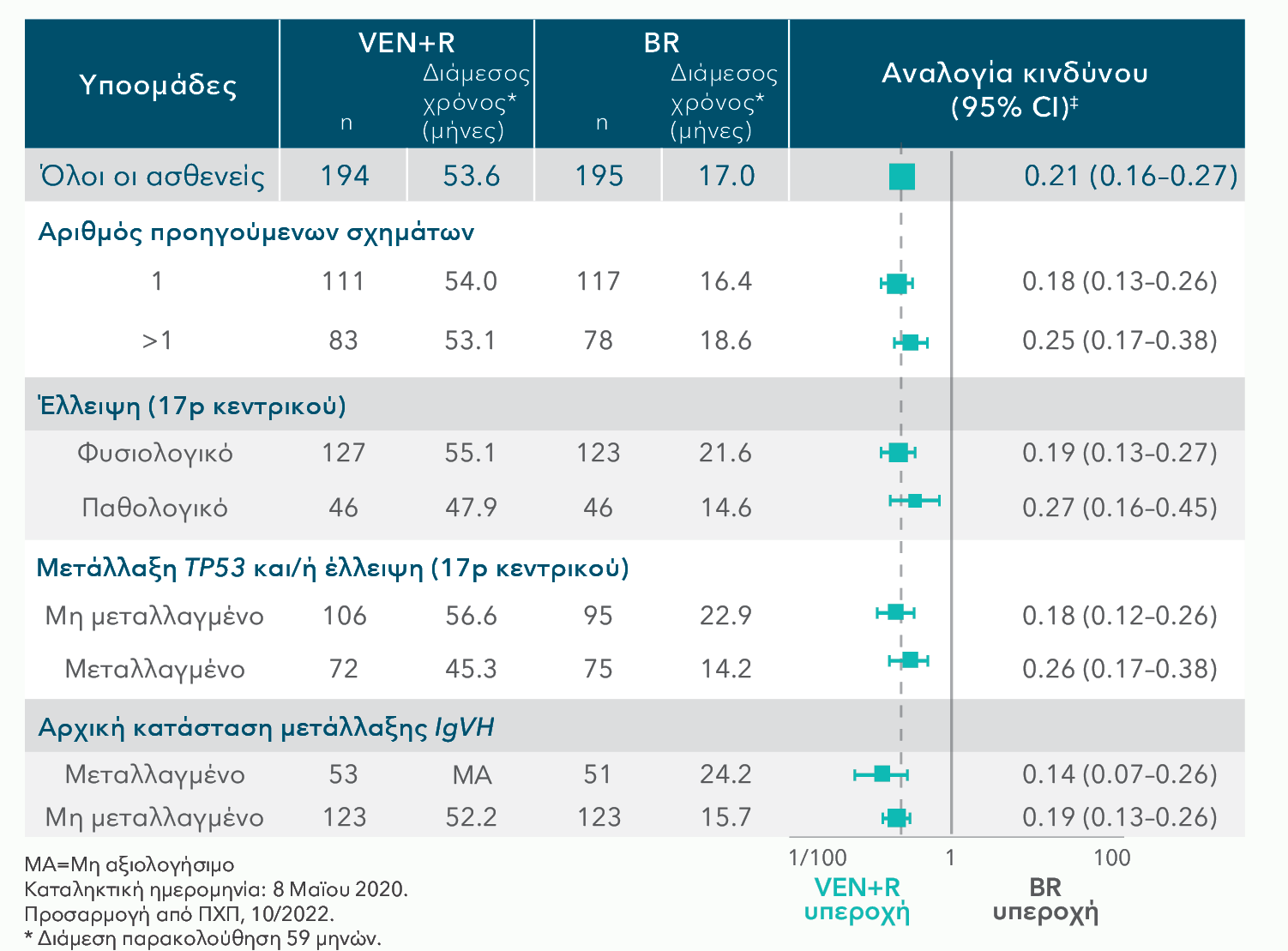
ΤΟ ΟΦΕΛΟΣ ΣΤΗΝ PFS ΜΕ ΤΟ ΣΥΝΔΥΑΣΜΟ VENCLYXTO® + RITUXIMAB ΗΤΑΝ ΣΤΑΘΕΡΟ ΣΕ ΟΛΕΣ ΤΙΣ ΥΠΟΟΜΑΔΕΣ, ΣΥΜΠΕΡΙΛΑΜΒΑΝΟΜΕΝΩΝ ΚΑΙ ΤΩΝ ΑΣΘΕΝΩΝ ΥΨΗΛΟΥ ΚΙΝΔΥΝΟΥ1*†
PFS εκτιμώμενη από τον ερευνητή στον πληθυσμο ΙΤΤ (πρωταρχική ανάλυση)
| • | Εκτίμηση PFS 2-ετίας: 85% (95% CI: 79.1-90.6) με VEN+R έναντι 36% (95% CI: 28.5-44.0) με BR |
Διάμεση παρακολούθηση 23.8 μηνών (εύρος: 0-37.4 μήνες, VEN+R: n=194, BR: n=195) (HR=0.17.95% CI: 0.11-0.25 [P<0,0001]). Η διάμεση PFS δεν επετεύχθη με VEN+R έναντι 17 μηνών (95% CI: 15.5- 21.6) με BR στην πρωταρχική ανάλυση.
5-ΕΤΗΣ ΑΝΑΛΥΣΗ ΥΠΟΟΜΑΔΩΝ ΜΕ ΕΚΤΙΜΩΜΕΝΗ ΑΠΟ ΤΟΝ ΕΡΕΥΝΗΤΗ PFS
Τα αποτελέσματα της PFS σε αυτές τις ομάδες υψηλού κινδύνου διατηρήθηκαν πέραν των 2 ετών με τη θεραπεία συνδυασμού VEN+R
†Τα αποτελέσματα είναι περιγραφικά.
Η χωρίς διαστρωμάτωση αναλογία κινδύνου παρουσιάζεται στον άξονα των Χ με λογαριθμική κλίμακα
Ο ΣΥΝΔΥΑΣΜΟΣ VENCLYXTO® + RITUXIMAB ΜΕΙΩΣΕ ΤΟΝ ΚΙΝΔΥΝΟ ΘΑΝΑΤΟΥ ΣΕ ΣΥΓΚΡΙΣΗ ΜΕ ΤΟ BR1,12
Στην πρωταρχική ανάλυση OS (πληθυσμός ΙΤΤ, διάμεση παρακολούθηση 23.8 μήνες) το HR για VEN+R έναντι BR ήταν 0.48 (95%CI: 0.25-0.90). Η διάμεση OS δεν επετεύχθη για καμία ομάδα θεραπείας.1
(εύρος: 0-71,5 μήνες). Η ημερομηνία διακοπής για τη συλλογή των δεδομένων ήταν η 8 Μαίου 2020. Τα αποτελέσματα είναι περιγραφικά..
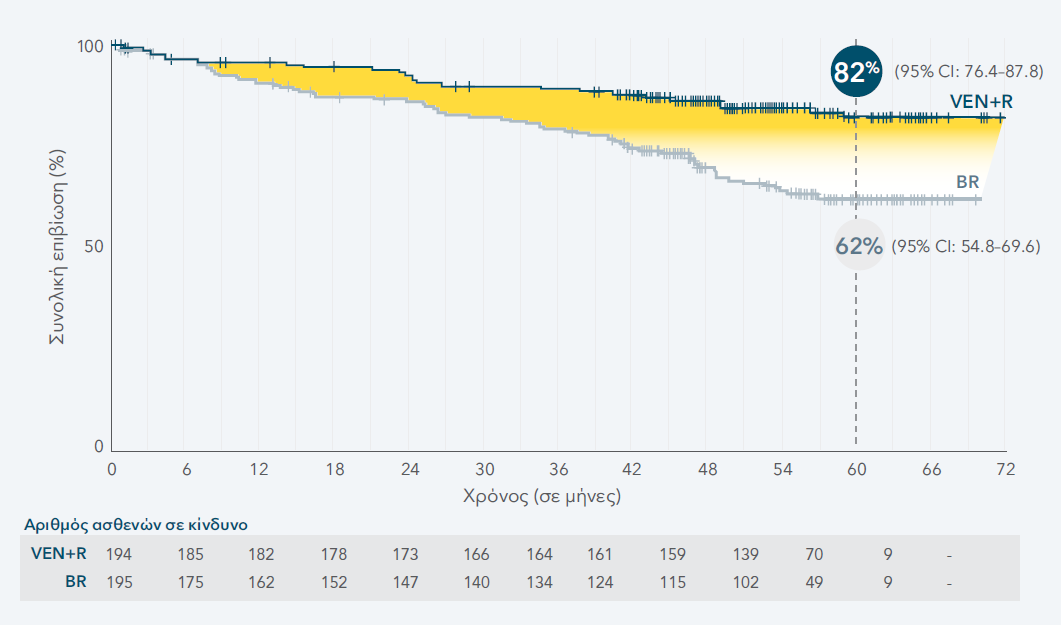
ΑΝΑΘΕΩΡΗΜΕΝΗ ΑΝΑΛΥΣΗ OS 5-ΕΤΙΑΣ
HR= 0,40 (95% CI: 0.26-0.62). Η διάμεση OS δεν επετεύχθη σε καμία ομάδα θεραπείας.
Διάμεση παρακολούθηση 59 μηνών
(εύρος: 0-71,5 μήνες). Η ημερομηνία διακοπής για τη συλλογή των δεδομένων ήταν η 8 Μαίου 2020. Τα αποτελέσματα είναι περιγραφικά..
Αναθεωρημένη ανάλυση 7-ετίας
Το ποσοστό συνολικής επιβίωσης ήταν 70% για το συνδυασμό VEN+R (95% CI: 62.8–76.5), έναντι 51% για το συνδυασμό BR (95% CI: 43.3–58.7) (HR=0.53).21
ΑΝΑΘΕΩΡΗΜΕΝΗ ΑΝΑΛΥΣΗ 5-ΕΤΙΑΣ: OS ΣΤΟΝ ΠΛΗΘΥΣΜΟ ΙΤΤ1
*OS = Συνολική επιβίωση
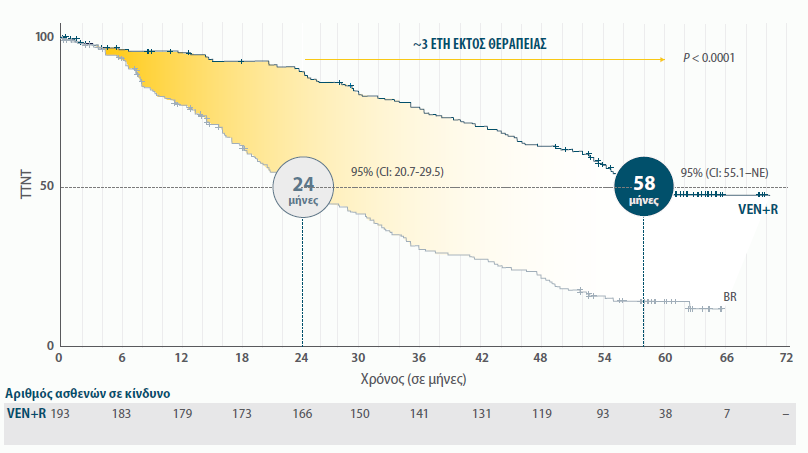
ΧΡΟΝΟΣ ΕΩΣ ΤΗΝ ΕΠΟΜΕΝΗ ΘΕΡΑΠΕΙΑ ΓΙΑ ΑΣΘΕΝΕΙΣ ΠΟΥ ΛΑΜΒΑΝΟΥΝ ΣΥΝΔΥΑΣΜΟ VENCLYXTO® + RITUXIMAB ΚΑΤΑ ΤΗΝ 5-ΕΤΗ ΠΑΡΑΚΟΛΟΥΘΗΣΗ15*
Αναθεωρημένη ανάλυση 7-ετίας
| • | Ο διάμεσος χρόνος εως την επόμενη θεραπεία για τους ασθενέις που έλαβαν το συνδυασμό VΕΝ+R είναι 63 μήνες, έναντι 24 μηνών στους ασθενείς με BR (HR 0.30)21 |
ΔΙΑΜΕΣΟΣ ΧΡΟΝΟΣ ΕΩΣ ΤΗΝ ΕΠΟΜΕΝΗ ΘΕΡΑΠΕΙΑ CLL
HR=0.26 (95% CI: 0.20–0.35 [P<0.0001]).
Βέλτιστη ORR=CR/CRi+PR/nPR.
Προσαρμογή από: Seymour JF, Kipps TJ, Eichhorst B, et al. Blood. 2022;140(8):839-850
ΔΙΑΜΕΣΟΣ ΧΡΟΝΟΣ ΕΩΣ ΤΗΝ ΕΠΟΜΕΝΗ ΘΕΡΑΠΕΙΑ CLL
| • | Μετά από ένα διάμεσο διάστημα 23,7 μηνών (εύρος 3,3-43,8 μήνες), 67 (77%) από τους 87ασθενείς που έλαβαν VEN+R έλαβαν επόμενη θεραπεία |
| • | Από αυτούς τους ασθενείς σε VEN+R, οι 32 (47,8%) έλαβαν ξανά θεραπεία που βασιζότανστο VENCLYXTO® |
| • | 18 από τους 31 ασθενείς είχαν μία αξιολογήσιμη ανταπόκριση |
ORR ΣΕ ΕΠΟΜΕΝΗ ΘΕΡΑΠΕΙΑ ΠΟΥ ΒΑΣΙΖΕΤΑΙ ΣΕ VENCLYXTO®15
| • | Διάμεση διάρκεια θεραπείας: 11.4 μήνες (εύρος: 0.7–37.6)† |
*Τα αποτελέσματα είναι περιγραφικά.
†Με βάση τις κατευθυντήριες οδηγίες του 2008 από την iwCLL σχετικά με τη διάγνωση, τις ενδείξεις για θεραπεία, την αξιολόγηση της ανταπόκρισης και την υποστηρικτική διαχείριση της ΧΛΛ.15
‡Από τους 32 αξιολογήσιμους ασθενείς. Οι ανταποκρίσεις σε ασθενείς που έλαβαν την επόμενη σε σειρά θεραπεία για μη επαρκή χρόνο ώστε να αξιολογηθεί η ανταπόκρισή τους ή αυτοί οι ασθενείς για τους οποίους δεν αναφέρθηκε η αξιολόγηση της ανταπόκρισης, θεωρήθηκαν μη αξιολογήσιμοι.15
Με ενδιαφέρει η βελτιωμένη
πρόγνωση ασθενών
Με ενδιαφέρει να προσφέρω
θεραπείες πεπερασμένης διάρκειας
ΠΑΡΑΠΟΜΠΕΣ 1. VENCLYXTO® Περίληψη Χαρακτηριστικών του Προϊόντος (ΠΧΠ), Αύγουστος 2023. 9. Al-Sawaf O, Zhang C, Tandon M, et al. Minimal residual disease dynamics after venetoclax-obinutuzumab treatment: extended oŸ-treatment follow-up from the randomized CLL14 study. J Clin Oncol. 2021;39(36):4049-4060(suppl appendix). 12. Eichhorst B, Niemann C, Kater A, et al. LB2365 Time-Limited Venetoclax-Obinutuzumab +/- Ibrutinib Is Superior to Chemoimmunotherapy In Frontline Chronic Lymphocytic Leukemia (CLL): PFS Co-Primary Endpoint Of The Randomized Phase 3 Gaia/CLL13 TRIAL. HemaSphere. 2022;6:S3. 14. Kater AP, Wu JQ, Kipps T, et al. Venetoclax plus rituximab in relapsed chronic lymphocytic leukemia: 4-year results and evaluation of impact of genomic complexity and gene mutations from the MURANO phase III study. J Clin Oncol. 2020;38(34):4042-4054. 15. Seymour JF, Kipps TJ, Eichhorst B, et al. Enduring undetectable MRD and updated outcomes in relapsed/ refractory CLL after fixed-duration venetoclax-rituximab. Blood. 2022;140(8):839-850. 16. Eichhorst B. et al. Chronic lymphocytic leukaemia ESMO Clinical Practice Guidelines for diagnosis. Ann Oncol. 2021 Vol.32. 21 Kater A, Harrup R, Kipps TJ, et al. Final 7-year (yr) follow up and retreatment substudy analysis of MURANO: venetoclax-rituximab (VENR)-treated patients with relapsed/refractory chronic lymphocytic leukemia (R/R CLL). Abstract presented at the European Hematology Association Congress 2023; June 8-11, 2023.