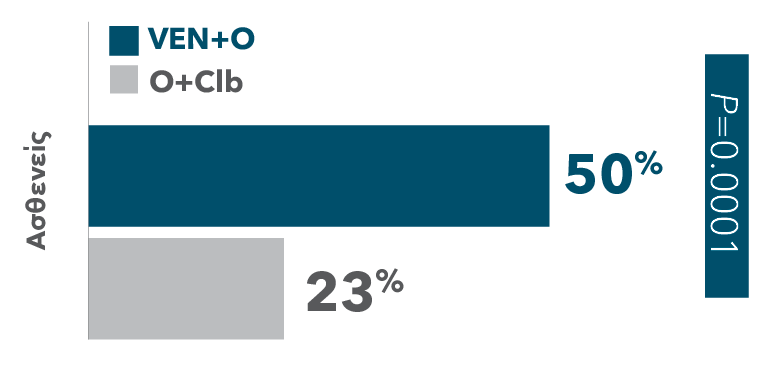Note to affiliates: This update to the venetoclax CLL AbbVie Pro site includes a homepage headline, updated CLL14 6-year, CLL13 4-year, MURANO 7-year data sets, and other streamlined content updates. CLL 13 4-year update reflects the CLL13 data from the Lancet Oncology publication. The CLL14 6-year and MURANO 7-year data have been updated based on the EHA 2023 abstracts. For countries that cannot use these data sets, please follow local regulations and MRLO guidance, and revert to CLL14 5-year and MURANO 5-year published data from the product label.
Primary analysis in ITT population for VEN+O vs O+Clb1:
INV-assessed PFS†: Reduced risk of progression or death (HR=0.35; 95% CI: 0.23–0.53 [P<0.0001]).
| • | Median follow-up of 28 months |
Additional analyses:
6-year PFS estimate (INV-assessed)2‡: 53% vs 22% (HR=0.40; 95% CI: 0.31–0.52) after 5 years off treatment.
| • | Median PFS of 76.2 months with VEN+O vs 36.4 months with O+Clb |
INV-assessed complete remission (CR/CRi)1: 50% vs 23% (P<0.0001).
| • | ORR: 85% (95% CI: 79.2–89.2) vs 71% (95% CI: 64.8–77.2 [P=0.0007]) |
Primary analysis in ITT population for VEN+R vs BR1:
INV-assessed PFS†: Reduced risk of progression or death (HR=0.17; 95% CI: 0.11–0.25 [P<0.0001]).
| • | Median follow-up of 23.8 months |
Additional analyses:
7-year PFS estimate (INV-assessed)3‡: 23% (HR=0.23; 95% CI: 0.18–0.29) vs NE after ~5 years off treatment.
| • | Median PFS of 54.7 months with VEN+R (95% CI: 52.3–59.9) vs 17.0 months with BR (95% CI: 15.5–21.7) |
INV-assessed complete remission (CR/CRi)1‡: 27% vs 8%.
| • | ORR: 93% (95% CI: 88.8–96.4) vs 68% (95% CI: 60.6–74.2) |
*See full dosing information for VEN+O and for VEN+R in the dosing and administration section.
†Primary endpoint.
‡Results are descriptive only.
1L=first line; CLL=chronic lymphocytic leukaemia; VEN+O=VENCLYXTO + obinutuzumab; ITT=intent to treat; O+Clb=obinutuzumab + chlorambucil; INV=investigator; PFS=progression-free survival; HR=hazard ratio; CI=confidence interval; CR=complete remission; CRi=complete remission with incomplete bone marrow recovery; ORR=overall response rate; 2L+=second line + later lines of therapy; VEN+R=VENCLYXTO + rituximab; BR=bendamustine + rituximab; NE=not evaluable.
test
Ο ΣΧΕΔΙΑΣΜΟΣ ΤΗΣ ΜΕΛΕΤΗΣ CLL14 ΕΠΕΤΡΕΨΕ ΣΤΟΥΣ ΑΣΘΕΝΕΙΣ ΝΑ
ΟΛΟΚΛΗΡΩΝΟΥΝ ΤΗ ΘΕΡΑΠΕΙΑ ΜΕΣΑ ΣΕ 1 ΕΤΟΣ1*
Η μελέτη CLL14 αξιολόγησε τον συνδυασμό VENCLYXTO + obinutuzumab έναντι του καθιερωμένου θεραπευτικού σχήματος CIT (obinutuzumab + chlorambucil)
*Η μελέτη CLL14 ήταν μια πολυκεντρική, ανοιχτής επισήμανσης μελέτη φάσης 3. Ολοκληρώση της θεραπείας μετά απο δώδεκα κύκλους 28 ημερών.
†VENCLYXTO® 400mg ημερησίως μετά την περίοδο τιτλοποιήσης διάρκειας 5 εβδομάδων.
‡Δοσολογία Οbinutuzumab: 100mg στον κύκλο 1, Ημέρα 1, και στη συνέχεια 900mg στις Ημέρες 1 or 2; 1000mg στις Ημέρες 8 και 15 και στην Ημέρα 1 κάθε επόμενου κύκλου.
§Δοσολογία Chlorambucil : 0.5mg/kg τις Ημέρες 1 και 15 κάθε κύκλου 28 ημερών.
Επιλογή κριτηρίων για την ένταξη
| • | CLL χωρίς προηγούμενη θεραπεία, συνοδά νοσήματα (συνολικό CIRS>6 ή CrCl<70mL/min), ηλικία≥18 ετών |
Επιλογή κλινικών καταληκτικών σημείων
| • | Πρωταρχικό καταληκτικό σημείο: PFS εκτιμώμενη από τον ερευνητήΙΙ |
| • | Επιλογή δευτερευόντων καταληκτικών σημείων: IRC-asPFS εκτιμώμενη από IRC,ΙΙ ORR‡, CR+CRi,ΙΙ PRΙΙ και αρνητικοποίηση MRD¶ κατά το τέλος της θεραπείας17 |
||Αξιολογημένο με τη χρήση των αναθεωρημένων κατευθυντήριων οδηγιών του International Workshop for Chronic Lymphocytic Leukemia (iwCLL).
¶Η μέτρηση της ελάχιστης υπολειμματικής νόσου (MRD) εκτιμήθηκε στο τέλος της θεραπείας με τη χρήση αλληλουχίας αλληλόμορφου ολιγονουκλεοτιδίου πολυμεράσης (ASO-PCR). Το όριο για αρνητική (μη ανιχνεύσιμη) κατάσταση ήταν <1 κύτταρο CLL ανά 104 λευκοκύτταρα..
‡ORR=CR+CRi+PR=συνολικό ποσοστό επιβίωσης
CIT=χημειο-ανοσοθεραπεία, IV=ενδοφλεβίως, CIRS=Cumulative Ilness Rating Scale, CrCl=κάθαρση κρεατινίνης, IRC=ανεξάρτητη επιτροπή αξιολόγησης.
CR=πλήρης ύφεση, CRi=πλήρης ύφεση με ατελή ανάκτηση μυελού, PR=μερική ανταπόκριση
Ο ΣΥΝΔΥΑΣΜΟΣ VENCLYXTO® + OBINUTUZUMAB ΕΠΙΤΥΓΧΑΝΕΙ ΒΑΘΙΕΣ ΑΝΤΑΠΟΚΡΙΣΕΙΣ,*ΣΥΜΠΕΡΙΛΑΜΒΑΝΟΜΕΝΗΣ ΤΗΣ uMRD, ΣΤΗΝ
ΠΛΕΙΟΝΟΤΗΤΑ ΤΩΝ ΑΣΘΕΝΩΝ1
Απαράμιλλα ποσοστά στην uMRD για VEN+O έναντι O+Clb σε 1L CLL
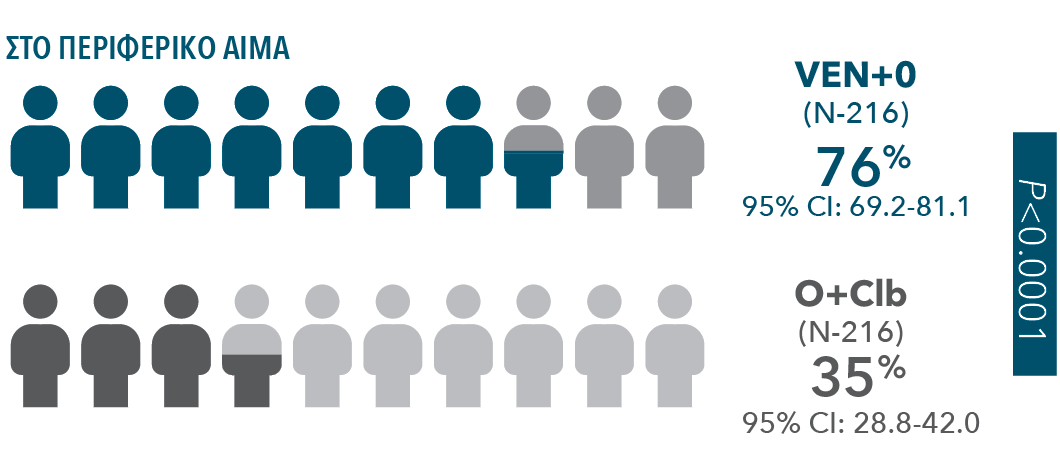
| • | Τα ποσοστά της uMRD στο περιφερικό αίμα κατά την ολοκλήρωση της θεραπείας ήταν 2 φορές υψηλότερα στο σκέλος VEN+O από ό,τι στο σκέλος O+Clb |
| • | Τα ποσοστά της uMRD στο μυελό των οστών κατά την ολοκλήρωση της θεραπείας ήταν 3 φορές υψηλότερα στο σκέλος VEN+O (57% [95% CI: 50.1-63.6]) από ό,τι στο σκέλος O+Clb (17% [95% CI: 12,4,-22,8]) (P<0,0001). |
uMRD (secondary endpoint) results in ITT population are presented. The cutoff for an undetectable (negative) status was <1 CLL cell per 104 leukocytes.
Πάνω από τους διπλάσιους ασθενείς πέτυχαν πλήρη ύφεση με συνδυασμό VEN+O (50%) έναντι αυτών με συνδυασμό O+Clb (23%)
ΣΤΟ ΠΕΡΙΦΕΡΙΚΟ ΑΙΜΑ ΠΟΣΟΣΤΑ ΠΛΗΡΟΥΣ ΥΦΕΣΗΣ (CR/CRi)†
| • | Το ORR‡ Το ORR† ήταν 85% (95% CI: 79.2-89.2) στο σκέλος VEN+O έναντι 71% (95% CI: 64.8-77.2) στο σκέλος O+Clb (P=0.0007) |
Προσαρμογή από: Venclyxto ΠΧΠ, Οκτώβριος 2022
*Βαθιές ανταποκρίσεις όπως ορίζονται από την uMRD ή τη CR.
†Οι CR/CRi αξιολογήθηκαν στον πληθυσμό ΙΤΤ.7
‡ORR=CR/CRi+PR=συνολικό ποσοστό επιβίωσης (δευτερεύον καταληκτικό σημείο)
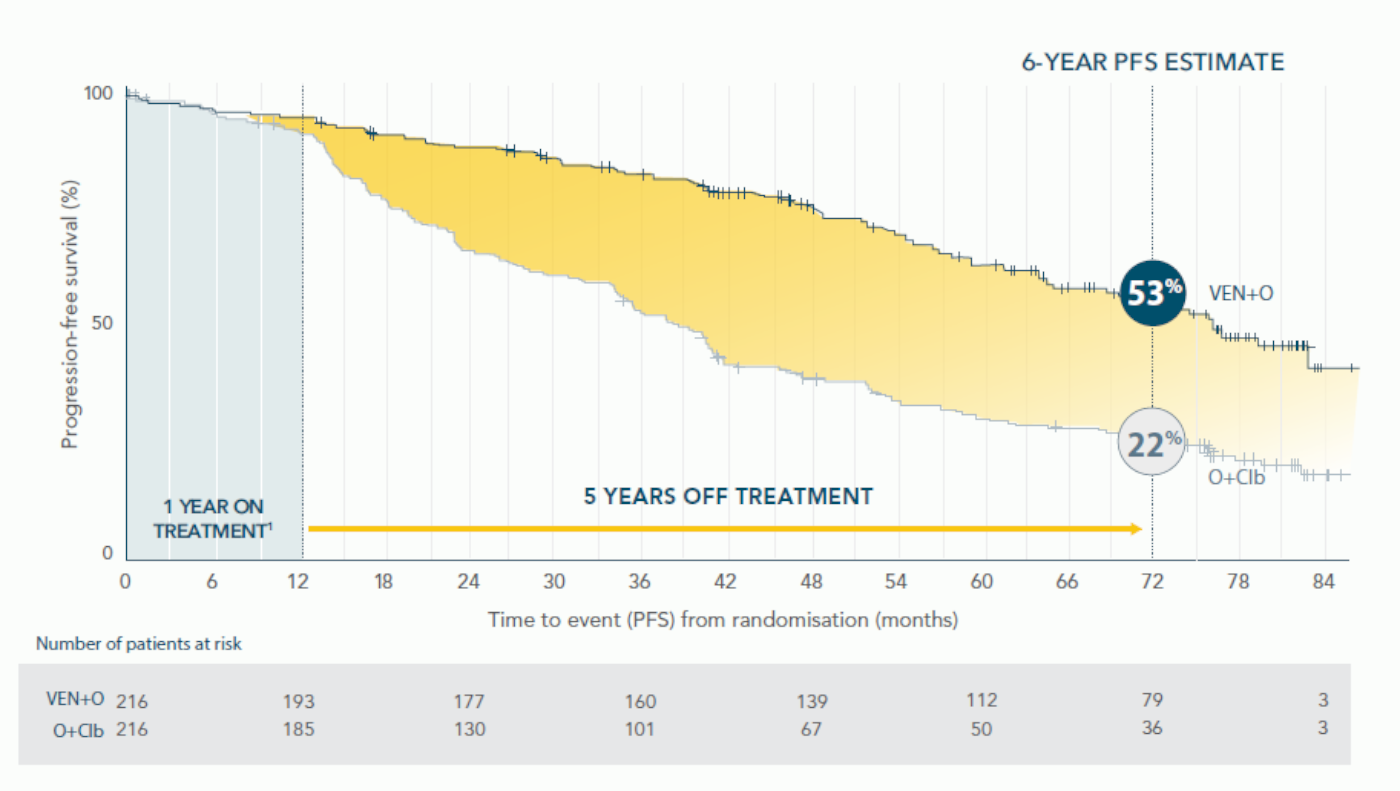
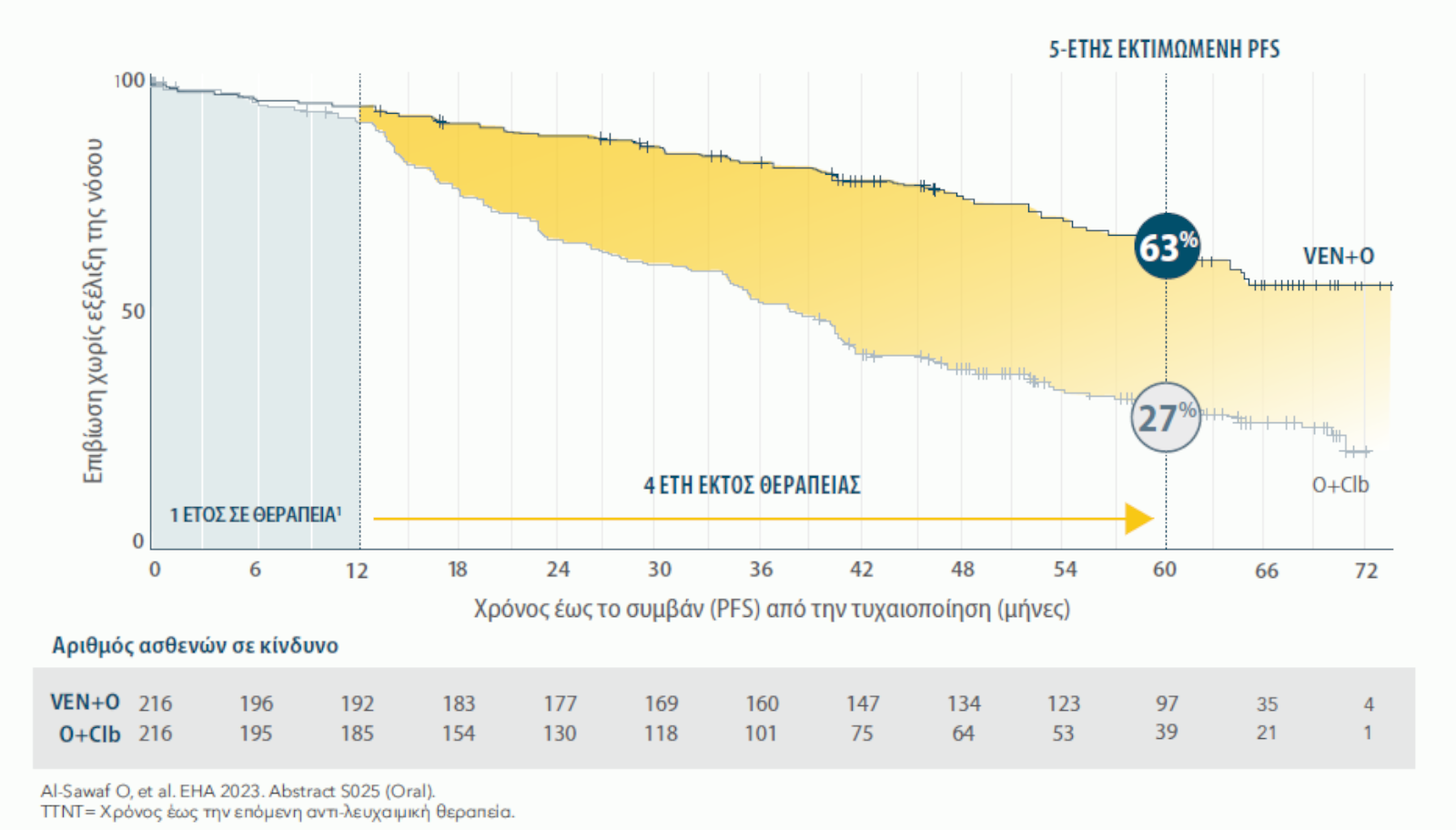
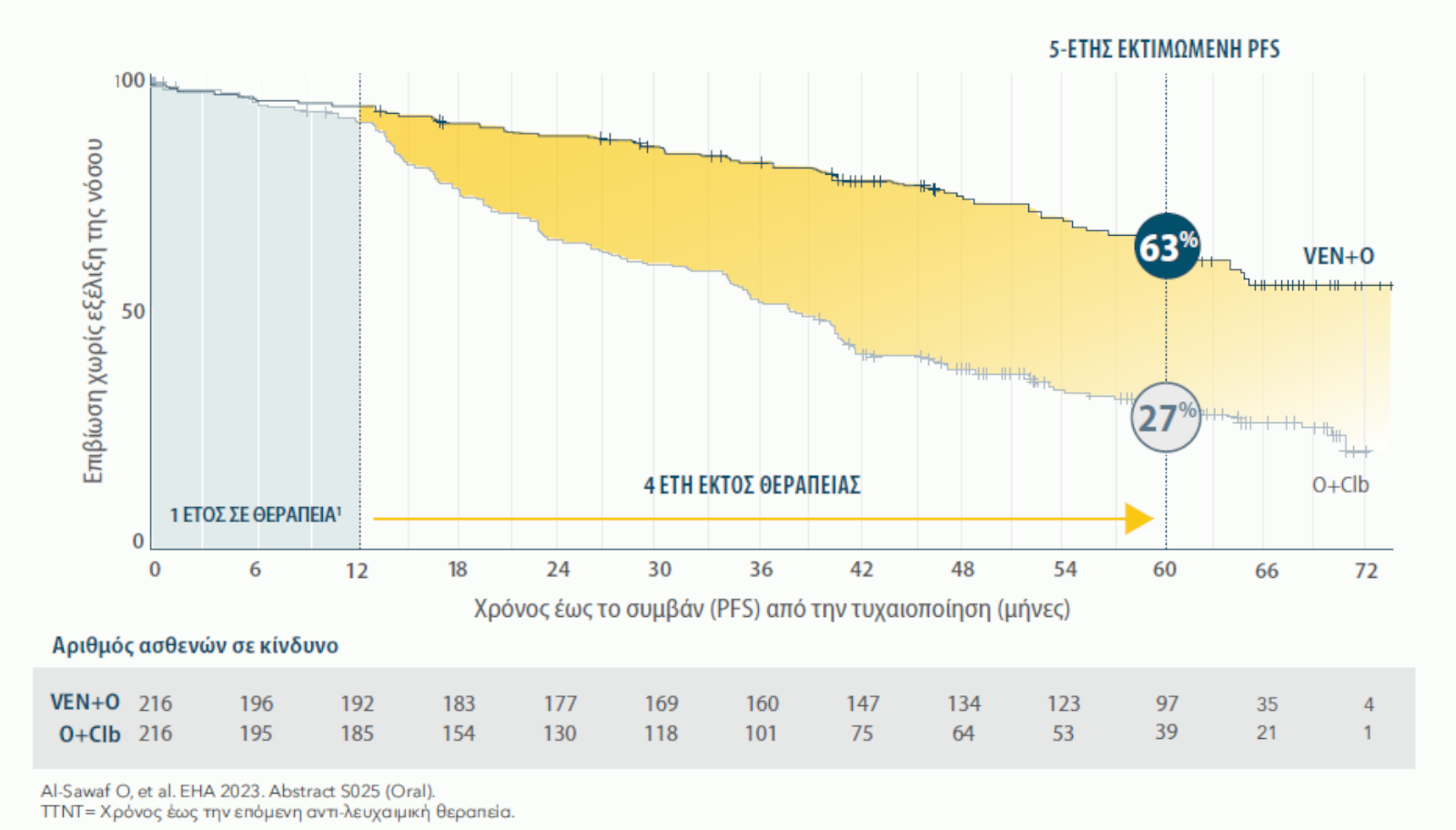
ΜΕΓΑΛΥΤΕΡΗΣ ΔΙΑΡΚΕΙΑΣ PFS: ΕΚΤΙΜΩΜΕΝΗ PFS 53% ΓΙΑ ΤΟ ΣΥΝΔΥΑΣΜΟ VENCLYXTO® + OBINUTUZUMAB ΕΝΑΝΤΙ 22% ΓΙΑ ΤΟ ΣΥΝΔΥΑΣΜΟ O+Clb ΣΤΑ 6 ΕΤΗ19*
Αναθεωρημένη ανάλυση 6-ετίας
Διάμεση παρακολούθηση 76.4 μηνών (ενδοτεταρτημοριακό εύρος: 52.5-80.5).
Η διάμεση PFS επετεύχθη στους 76.2 μήνες με το συνδυασμό VEN+O έναντι των 36.4 μηνών με O+Clb (HR=0.40, 95% CI: 0.31-0.52)(P<0.0001).
ΑΞΙΟΛΟΓΗΣΗ ΚΑΤΑ ΤΗΝ ΕΚΤΙΜΗΣΗ ΤΟΥ ΕΡΕΥΝΗΤΗ ΤΗΣ PFS ΣΤΟΝ ΠΛΗΘΥΣΜΟ ΙΤΤ19
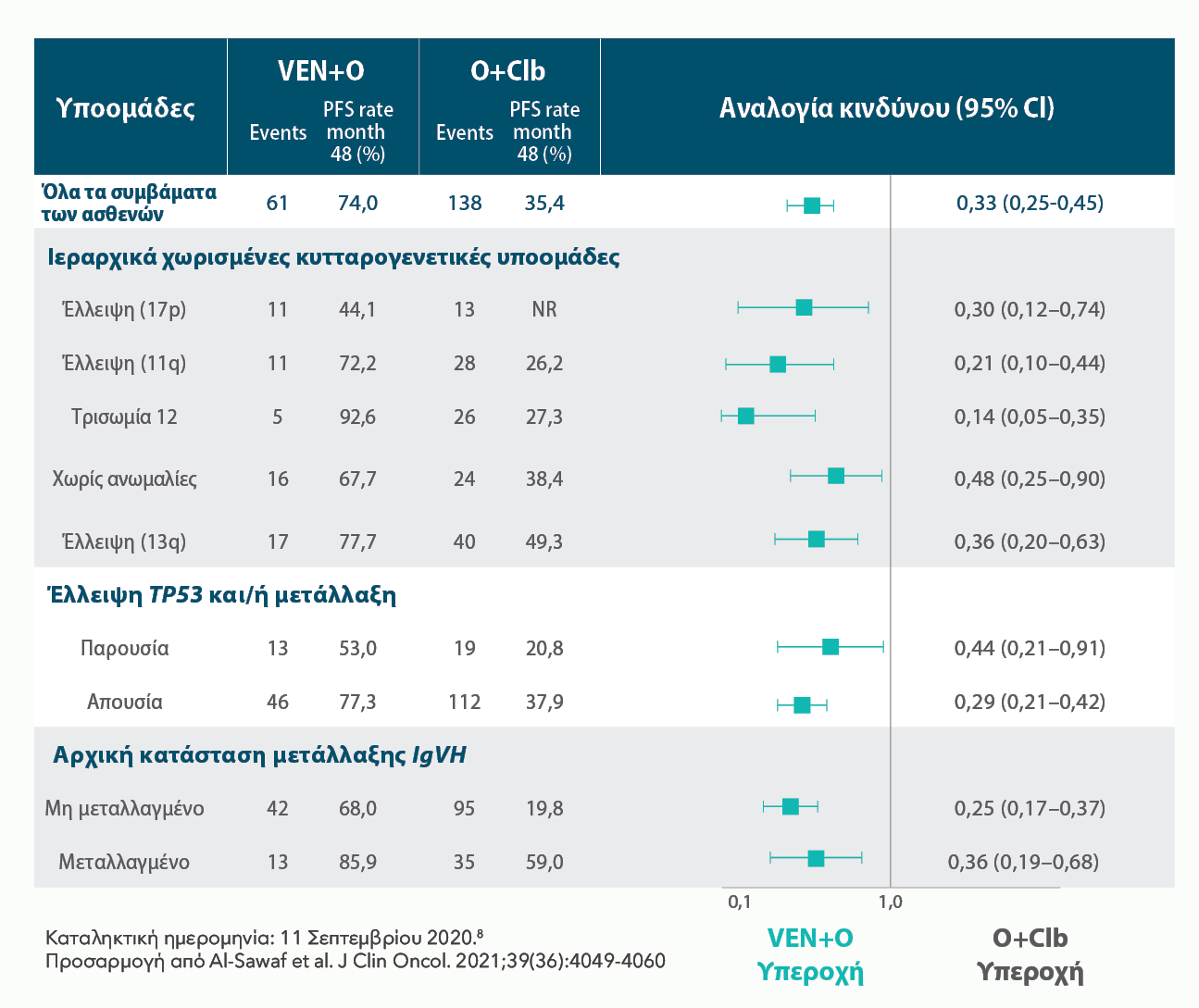
ΤΟ ΟΦΕΛΟΣ ΣΤΗΝ PFS ΜΕ ΤΟ ΣΥΝΔΥΑΣΜΟ VENCLYXTO® + OBINUTUZUMAB ΠΑΡΑΤΗΡΗΘΗΚΕ ΣΤΑΘΕΡΑ ΣΕ ΟΛΕΣ ΤΙΣ ΥΠΟΟΜΑΔΕΣ ΥΨΗΛΟΥ ΚΙΝΔΥΝΟΥ ΚΑΤΑ ΤΗΝ ΠΑΡΑΚΟΛΟΥΘΗΣΗ ΤΩΝ 4 ΕΤΩΝ8*†
Ανάλυση 4-ετίας
Διάμεση παρακολούθηση 52 μηνών (ενδοτεταρτημοριακό εύρος: 49,5-56,2). Η διάμεση PFS δεν επετεύχθη για το σκέλος VEN+O, έναντι 36,4 μηνών στο σκέλος O+Clb. (HR=0.33; 95% CI: 0.25–0.45 [P<0,0001]).
| • | Εκτιμώμενη PFS 4-ετίας: 74% με VEN+O έναντι 35% με O+Clb. |
Οι ομάδες υψηλού κινδύνου περιλαμβάνουν την έλλειψη (17p), την έλλειψη και/ή την παρουσία μετάλλαξης TP53 καθώς και το μη μεταλλαγμένο IgVH. †Τα αποτελέσματα είναι περιγραφικά.
Del=έλλειψη; TP53=πρωτεϊνη του όγκου 53; IgVH=μεταβλητό γονίδιο της βαρέως αλυσίδας ανοσοσφαιρίνης.
ΕΚΤΙΜΩΜΕΝΗ PFS ΚΑΤΑ ΤΟΝ ΕΡΕΥΝΗΤΗ ΑΝΑ ΥΠΟΟΜΑΔΑ ΣΤΑ 4 ΕΤΗ8
5 ΕΤΗ ΜΕΤΑ ΤΗΝ ΟΛΟΚΛΗΡΩΣΗ ΤΗΣ ΘΕΡΑΠΕΙΑΣ, ΤΟ 65% ΤΩΝ ΑΣΘΕΝΩΝ ΣΕ ΣΥΝΔΥΑΣΜΟ VENCLYXTO® + OBINUTUMAB ΔΕΝ ΧΡΕΙΑΣΤΗΚΕ ΕΠΟΜΕΝΗ ΘΕΡΑΠΕΙΑ19,20
Αναθεωρημένη ανάλυση 6-ετίας
5 έτη μετά την ολοκλήρωση της θεραπείας, το 65% των ασθενών σε συνδυασμό VEN+O δεν χρειάστηκαν επόμενη θεραπεία, έναντι 37% των ασθενών σε συνδυασμό O+Clb. (HR 0.44, 95% CI 0.33-0.58, p<0.0001)19
ΠΟΣΟΣΤΟ ΑΣΘΕΝΩΝ ΠΟΥ ΔΕΝ ΧΡΕΙΑΣΤΗΚΑΝ ΕΠΟΜΕΝΗ ΘΕΡΑΠΕΙΑ CLL
ΝΕΟΤΕΡΑ ΑΠΟΤΕΛΕΣΜΑΤΑ ΤΗΣ ΜΕΛΕΤΗΣ CLL13
ΣΤΗΝ 1η ΓΡΑΜΜΗ ΘΕΡΑΠΕΙΑΣ ΓΙΑ ΤΗ ΧΛΛ10,11
VENCLYXTO + obinutuzumab έναντι χημειοθεραπείας CIT (FCR/BR) arms
Η CLL13 ήταν μία πολυκεντρική, ανοιχτή, μελέτη φάσης 3, με πολλαπλά σκέλη σε μη προθεραπευμένους ασθενείς με CLL και καλή φυσική κατάσταση (CIRS≤6, φυσιολογική κάθαρση κρεατινίνης ≥70mL/min). Οι ασθενείς τυχαιοποιήθηκαν να λάβουν θεραπείας για τη CLL, συμπεριλαμβανομένης της χημειοθεραπείας (FCR για ασθενείς ≤ 65 ετών, BR για ασθενείς >65 ετών) ή ένα σχήμα με VENCLYXTO®, συμπεριλαμβανομένου του VENCLYXTO® + Οbinutuzumab (περισσότερες λεπτομέρειες για τη μελέτη NCT02950051 είναι διαθέσιμες στο clinicaltrials.gov).
ΔΟΣΟΛΟΓΙΚΟ ΣΧΗΜΑ ΓΙΑ ΤΑ ΣΚΕΛΗ ΤΟΥ VENCLYXTO + OBINUTUZUMAB ΚΑΙ ΧΗΜΕΙΟΘΕΡΑΠΕΙΑ
*VENCLYXTO 400mg ημερησίως μετά το αρχικό πρόγραμμα τιτλοποίησης δόσης, για 12 κύκλους. Ο κάθε κύκλος ήταν 28 ημερών.
†Δοσολογία Obinutuzumab: 1000mg κατά τις Ημέρες 1,8 και 15 του Κύκλου 1 και κατά την Ημέρα 1 των Κύκλων 2-6. Ο κάθε κύκλος ήταν 28 ημερών.
††Δοσολογία Fludarabine: 25mg/m2 κατά τις Ημέρες 1-3 των Κύκλων 1-6. Ο κάθε κύκλος ήταν 28 ημερών.
§Δοσολογία Κυκλοφωσφαμίδης: 250mg/m2 κατά τις Ημέρες 1-3 των Κύκλων 1-6. Ο κάθε κύκλος ήταν 28 ημερών.
IIΔοσολογία Rityximab: 375mg/m2 κατά την Ημέρα 1 του Κύκλου 1 και 500mg/m2 κατά την Ημέρα 1 των Κύκλων 2-6. Ο κάθε κύκλος ήταν 28 ημερών.
##Δοσολογία Bendamustine: 90mg/m2 κατά τις Ημέρες 1-2 των Κύκλων 1-6. Ο κάθε κύκλος ήταν 28 ημερών.
*H ελάχιστη υπολειπόμενη νόσος (MRD) ορίσθηκε ως <1 κύτταρο CLL ανά 104 λευκοκύτταρα.
#Αξιολογήθηκε το Μήνα 15, σύμφωνα με τις κατευθυντήριες οδηγίες iwCLL 2008.
Επιπρόσθετα πρωτεύοντα καταληκτικά σημεία
| • | Ανίχνευση ελάχιστης υπολειμματικής νόσου (MRD) στο περιφερικό αίμα κατά τον Μήνα 15, αξιολογούμενη με κυτταρομετρία ροής (VEN+O έναντι CIT).* |
| • | Επιβίωση χωρίς εξέλιξη της νόσου (PFS) (προς αξιολόγηση σε μεταγενέστερη ημερομηνία). |
Επιλεγμένα δευτερεύοντα καταληκτικά σημεία
| • | ORR# καιCR+CRi# |
| • | Η ανίχνευση της ελάχιστης υπολειμματικής νόσου (MRD) στο μυελό των οστών αξιολογήθηκε 3 μήνες μετά το τέλος της θεραπείας σε ασθενείς με κλινική πλήρη ανταπόκριση (CR). |
Επιλεγμένα κριτήρια εισαγωγής στη μελέτη
| • | Κάθαρση κρεατινίνης ≥70mL/min |
Επιλεγμένα κριτήρια αποκλεισμού
| • | del(17p) ή μετάλλαξη TP53 |
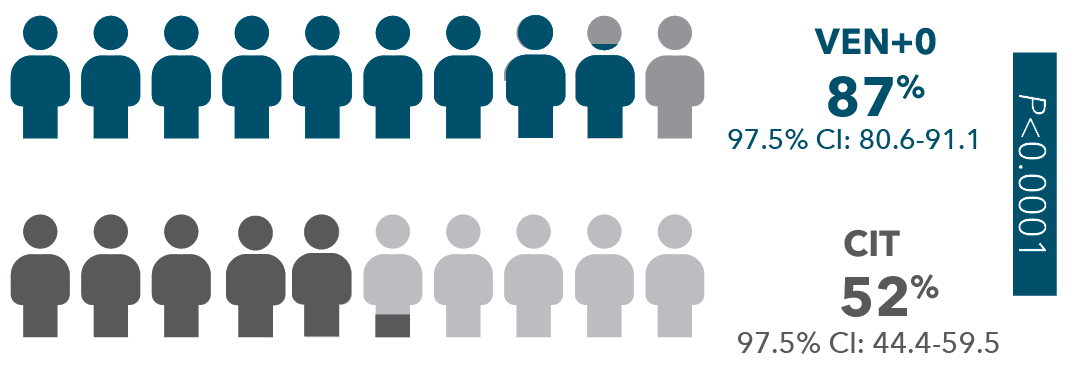
ΤΟ 87% ΤΩΝ ΑΣΘΕΝΩΝ ΠΟΥ ΕΛΑΒΑΝ ΘΕΡΑΠΕΙΑ ΜΕ ΣΥΝΔΥΑΣΜΟ VENCLYXTO® + OBINUTUZUMAB ΠΕΤΥΧΑΝ uMRD ΣΤΟ ΠΕΡΙΦΕΡΙΚΟ ΑΙΜΑ ΕΝΑΝΤΙ 52% ΣΕ CIT*1,12
Ο διάμεσος χρόνος παρατήρησης ήταν 27.9 μήνες..
ΣΤΟ ΠΕΡΙΦΕΡΙΚΟ ΑΙΜΑ
| • | Τα ποσοστά του uMRD στο μυελό των οστών ήταν 73% στο σκέλος του VEN+O έναντι 37% στο σκέλος της CIT |
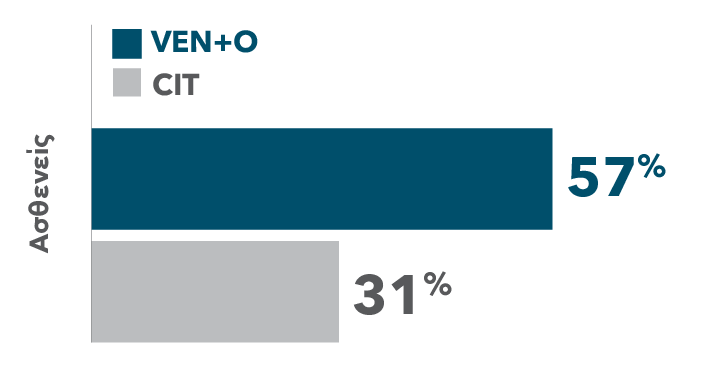
ΠΟΣΟΣΤΑ CR/CRi ΣΕ VEN+O ΕΝΑΝΤΙ CIT
| • | Η εκτιμώμενη κατά τον ερευνητή ORR (CR/CRi+PR) ήταν 96% στο σκέλος VEN+O έναντι 81% στο σκέλος CIT |
Προσαρμογή από Eichhorst B, Niemann C, Kater AP, et al. Blood. 2021;138(Supplement 1):71
FCR=fludarabine + cyclophosphamide + rituximab; INV=ερευνητής
* Τα αποτελέσματα αφορούν το μήνα 15, σε ITT (Intention To Treat) πληθυσμό
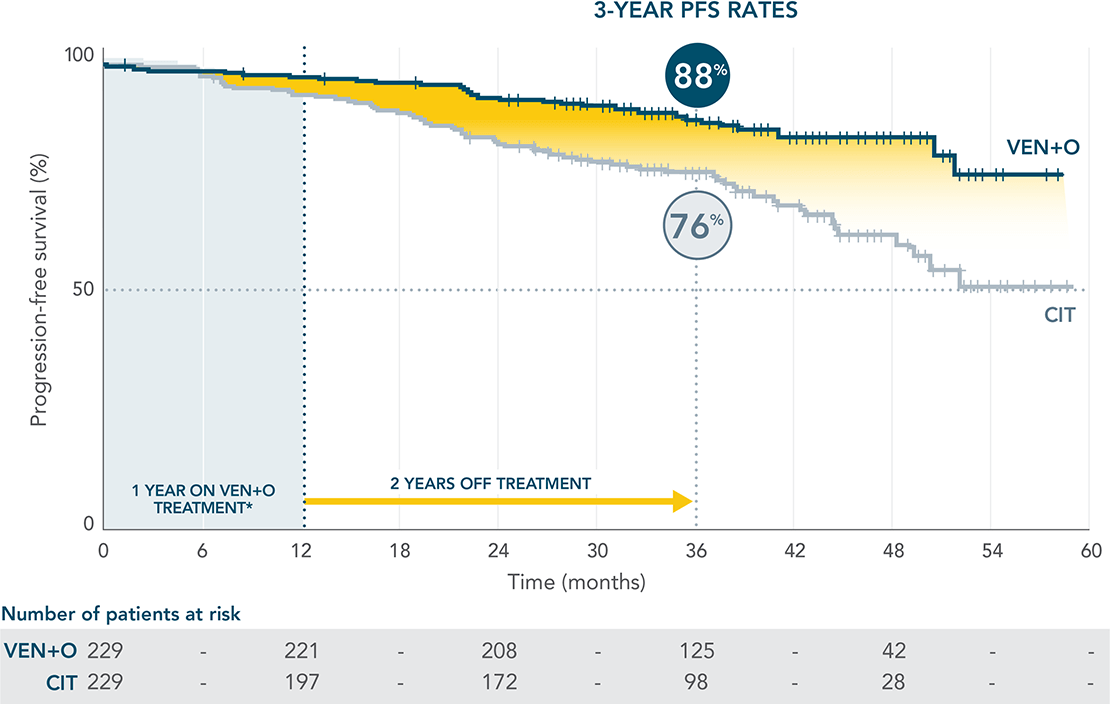
ΑΠΟΤΕΛΕΣΜΑΤΑ PFS ΜΕ ΤΟ ΣΥΝΔΥΑΣΜΟ VENCLYXTO® + OBINUTUZUMAB ΣΤΗΝ ΠΡΩΤΗ ΓΡΑΜΜΗ ΘΕΡΑΠΕΙΑΣ ΓΙΑ ΤΗ ΧΛΛ11-13
Μία προκαθορισμένη ενδιάμεση ανάλυση της PFS πραγματοποιήθηκε το Μήνα 61. Κατά την καταληκτική ημερομηνία (20 Ιανουαρίου 2022), ο διάμεσος χρόνος παρακολούθησης ήταν 38.8 μήνες. Καθώς το συν-πρωτεύον καταληκτικό σημείο της PFS περιλαμβάνει ένα μη εγκεκριμένο σχήμα, αυτά τα αποτελέσματα δεν παρουσιάζονται.
Δευτερεύον καταληκτικό σημείο: PFS για VEN+O έναντι CIT
Διάμεση παρακολούθηση 38,8 μήνες. Η διάμεση PFS δεν επετεύχθη σε κανένα σκέλος (HR=0.42; 97.5% CI: 0.26–0.68, P<0.0001).
ΑΝΑΛΥΣΗ ΤΗΣ ΕΚΤΙΜΩΜΕΝΗΣ ΚΑΤΑ ΤΟΝ ΕΡΕΥΝΗΤΗ PFS
ΠΛΗΡΟΦΟΡΙΕΣ ΑΣΦΑΛΕΙΑΣ ΑΠΟ ΤΗ ΜΕΛΕΤΗ CLL13
| • | Στη μελέτη CLL13, οι πιο συχνές προκαλούμενες από τη θεραπεία, Βαθμού 3-5, ανεπιθύμητες ενέργειες ήταν, η ουδετεροπενία (51% όλων των ασθενών), η θρομβοκυττοπενία (12%), το TLS (8%), οι αντιδράσεις που σχετίζονται με την έγχυση (7%), η εμπύρετη ουδετεροπενία (7%) και η πνευμονία (5%). Δεν υπήρξαν θανατηφόρες περιπτώσεις TLS και δεν υπήρξαν ασθενείς που να χρειάστηκαν αιμοκάθαρση λόγω του TLS |
| • | Για τα σκέλη VEN+O και CIT, η δευτεροπαθής νεοπλασία εμφανίσθηκε σε 23 και 36 ασθενείς αντίστοιχα. Η επίπτωση των λοιμώξεων CTC Βαθμού 3-4 ήταν13.2% και 18.5% αντίστοιχα. Θανατηφόρες ανεπιθύμητες ενέργειες εμφανίσθηκαν σε 9 και 10 ασθενείς σε θεραπεία με VEN+O και CIT αντίστοιχα |
Η θεραπεία CIT χορηγήθηκε σε σύνολο 6 κύκλων.
ΑΕ=ανεπιθύμητη ενέργεια, TLS=σύνδρομο λύσης του όγκου, CTC=κοινά κριτήρια τοξικότητας.
Με ενδιαφέρει η βελτιωμένη
πρόγνωση ασθενών
Με ενδιαφέρει να προσφέρω
θεραπείες πεπερασμένης διάρκειας
References: 1. VENCLYXTO® Περίληψη Χαρακτηριστικών του Προϊόντος (ΠΧΠ), Αύγουστος 2023. 7. Al-Sawaf O, Zhang C, Robrecht S, et al. Venetoclax-obinutuzumab for previously untreated chronic lymphocytic leukemia: 5-year results of the randomized CLL14 study. EHA 2022; Abstract S148 8. Al-Sawaf O, Zhang C, Lu T, et al. Minimal residual disease dynamics after venetoclax-obinutuzumab treatment: extended oŸ-treatment follow-up from the randomized CLL14 study. J Clin Oncol. 2021;39(36):4049-4060. 10. Standard chemoimmunotherapy (FCR/BR) versus rituximab + venetoclax (RVe) versus obinutuzumab (GA101) + venetoclax (GVe) versus obinutuzumab + ibrutinib + venetoclax (GIVe) in fit patients with previously untreated chronic lymphocytic leukemia (CLL) without del (17p) or TP53 mutation (GAIA). NCT0295005. ClinicalTrials.gov. Published October 31, 2016. Updated September 30, 2021. Accessed February 28, 2023. https://clinicaltrials.gov/ct2/show/NCT02950051?term=NCT02950051&draw=2&rank=1.. 11. Eichhorst B, Niemann C, Kater AP, et al. A randomized Phase III study of venetoclax-based time-limited combination treatments (RVe, GVe, GIVe) vs standard chemoimmunotherapy (CIT: FCR/BR) in frontline chronic lymphocytic leukemia (CLL) of fit patients: first co-primary endpoint analysis of the international intergroup GAIA (CLL13) trial. Blood. 2021;138(Supplement 1):71. doi: https://doi.org/10.1182/blood-2021-146161. 12. Eichhorst B, Niemann C, Kater A, et al. LB2365 Time-Limited Venetoclax-Obinutuzumab +/- Ibrutinib Is Superior to Chemoimmunotherapy In Frontline Chronic Lymphocytic Leukemia (CLL): PFS Co-Primary Endpoint Of The Randomized Phase 3 Gaia/CLL13 TRIAL. HemaSphere. 2022;6:S3. 13. Fürstenau M, Robrecht S, Zhang C, et al. Comparison of tumor lysis syndrome (TLS) risk reduction and incidence in dižerent venetoclax-based combinations within the randomized phase 3 GAIA (CLL13) trial. Blood. 2021;138(Supplement 1):2639. doi: https://doi.org/10.1182/blood-2021-147790. 17. Fischer K, Al-Sawaf O, Bahlo J, et al. Venetoclax and obinutuzumab in patients with CLL and coexisting conditions. N Engl J Med. 2019;380(23):2225-2236. 19. Al-Sawaf O., S145 Venetoclax-Obinutuzumab for previously untreated chronic lymphocytic leukemia: 6-year results of the randomized CLL14 study. HemaSphere | 2023;7(S3) 20. Al-Sawaf O., et al. 025 Venetoclax-Obinutuzumab for previously untreated chronic lymphocytic leukemia: 6-year results of the randomized CLL14 study. Hematological Oncology, 41: 58-60. https://doi.org/10.1002/hon.3163_25