Αξονική σπονδυλοαρθρίτιδα
Το RINVOQ ενδείκνυται για τη θεραπεία της ενεργού μη ακτινολογικά επιβεβαιωμένης αξονικής σπονδυλοαρθρίτιδας σε ενήλικες ασθενείς με αντικειμενικά σημεία φλεγμονής, όπως υποδεικνύεται από τα αυξημένα επίπεδα της C-αντιδρώσας πρωτεΐνης (CRP) ή/και την απεικόνιση μαγνητικού συντονισμού (MRI), οι οποίοι έχουν ανταποκριθεί ανεπαρκώς σε μη στεροειδή αντιφλεγμονώδη φάρμακα (ΜΣΑΦ).1
Το RINVOQ ενδείκνυται για τη θεραπεία της ενεργού αγκυλοποιητικής σπονδυλίτιδας σε ενήλικες ασθενείς, οι οποίοι έχουν ανταποκριθεί ανεπαρκώς στη συμβατική θεραπεία.1
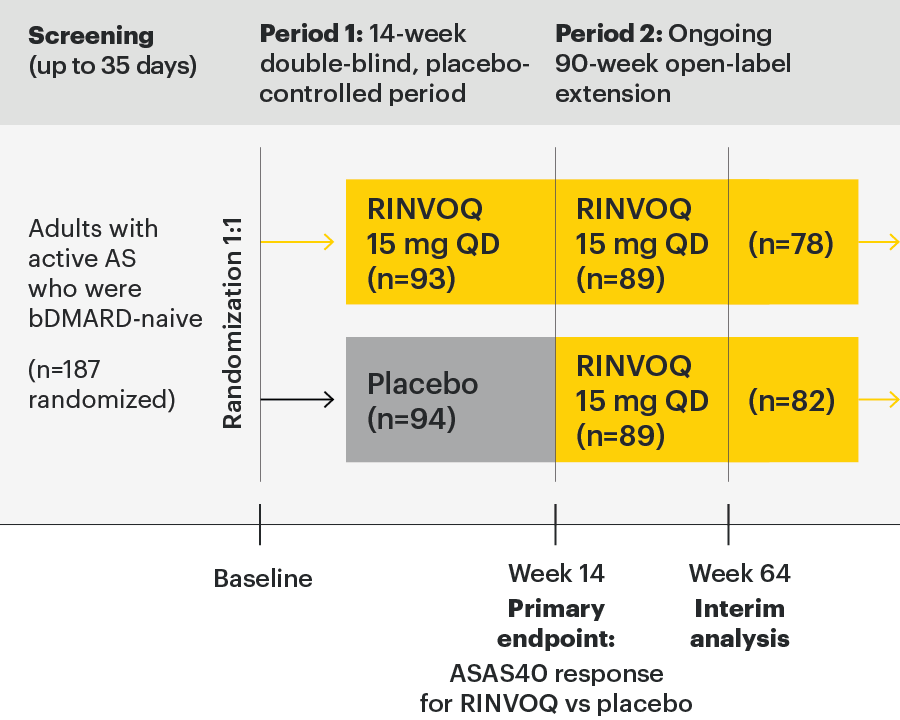
Σε ενήλικες ασθενείς με ενεργό Αγκυλοποιητική Σπονδυλίτιδα και ανεπαρκή ανταπόκριση στη συμβατική θεραπεία
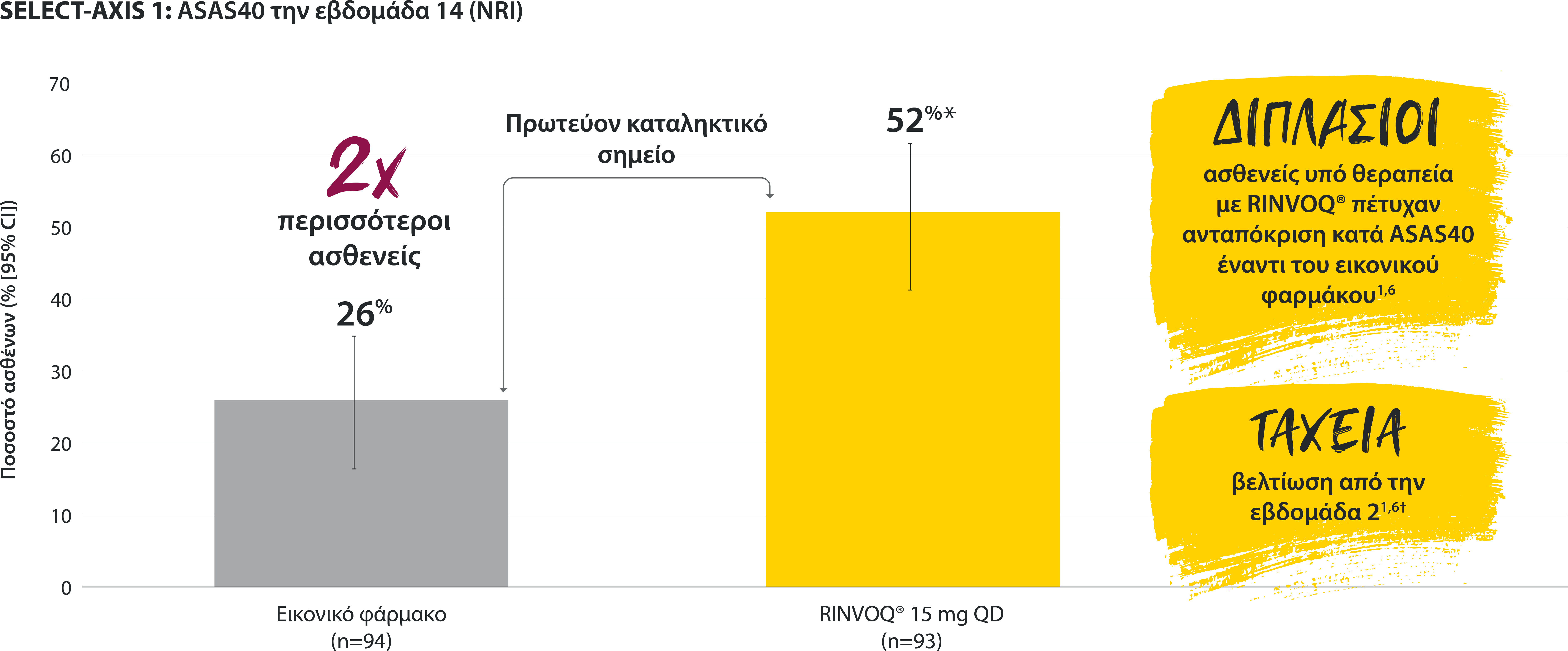
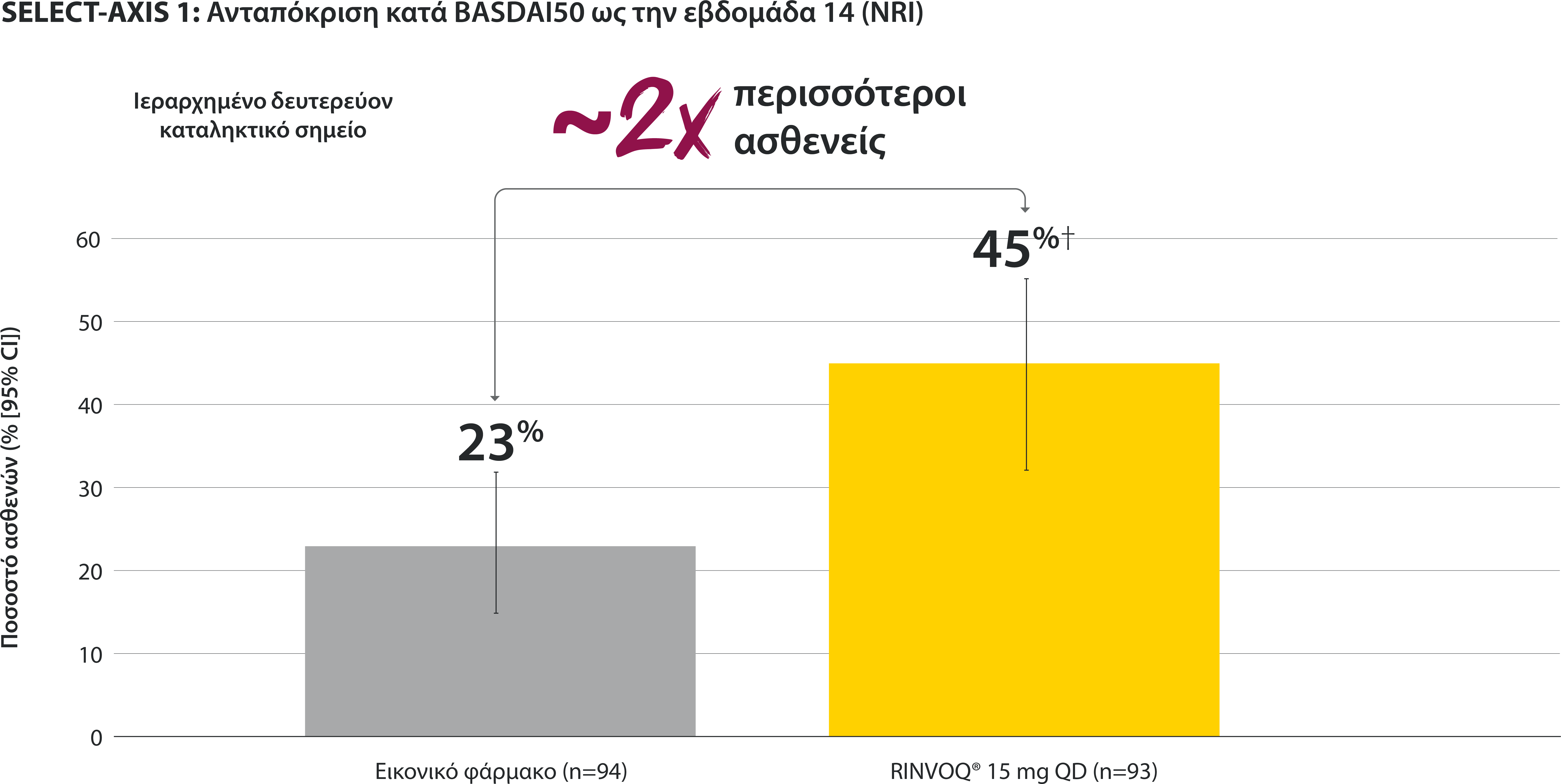
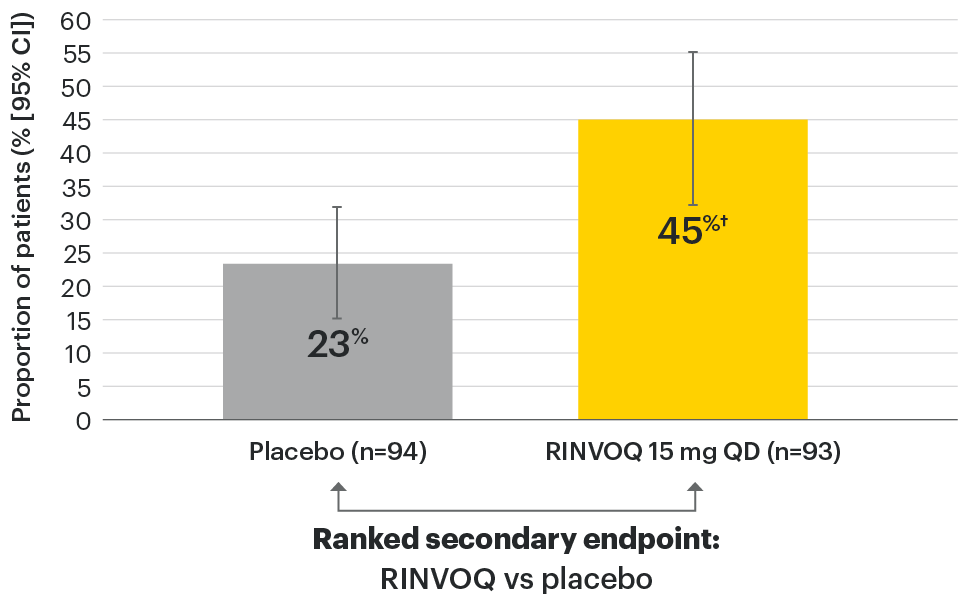
‡Nominal P≤0.001 vs placebo, not multiplicity-controlled. No clinical inferences can be drawn.
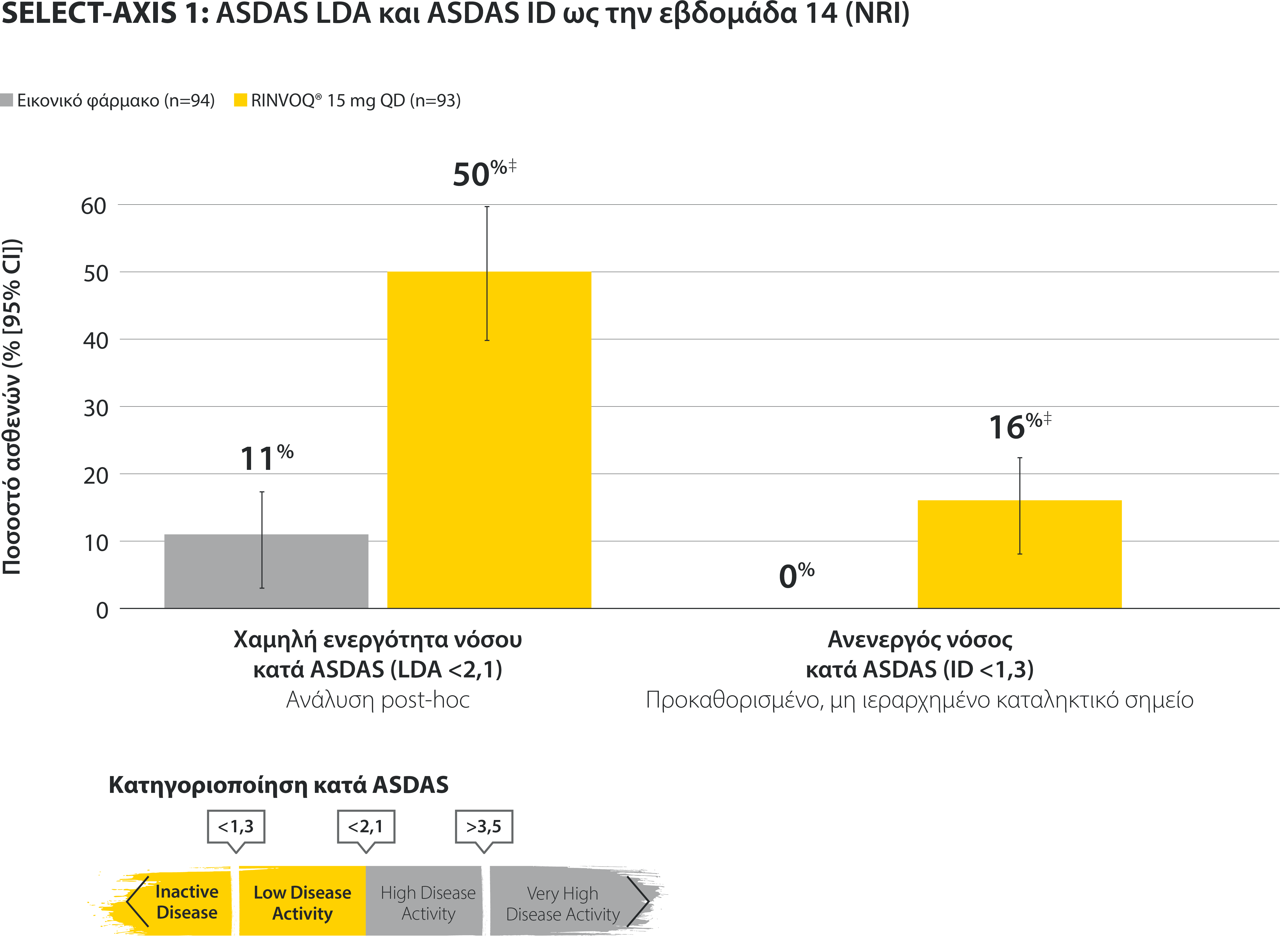
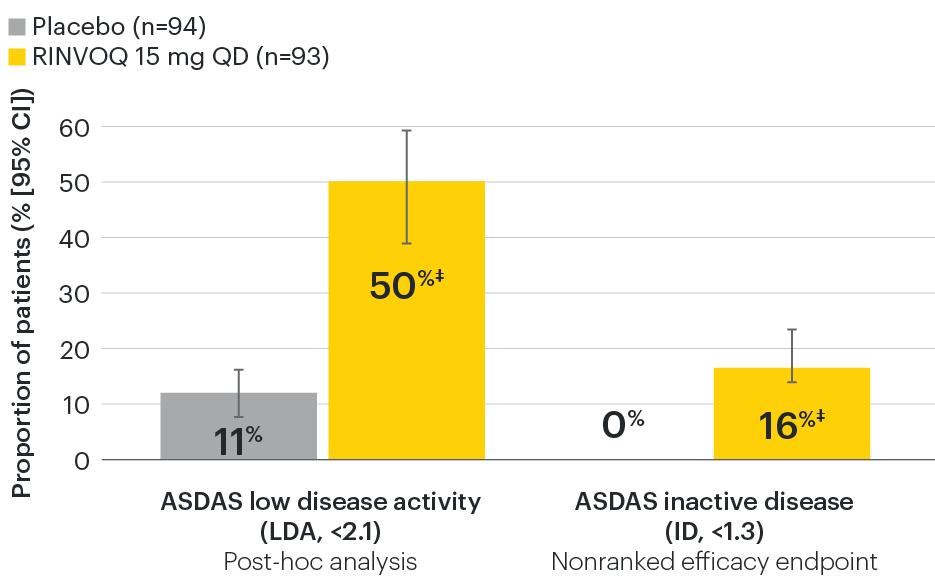
ASDAS ID at Week 14 was a prespecified, nonranked endpoint.
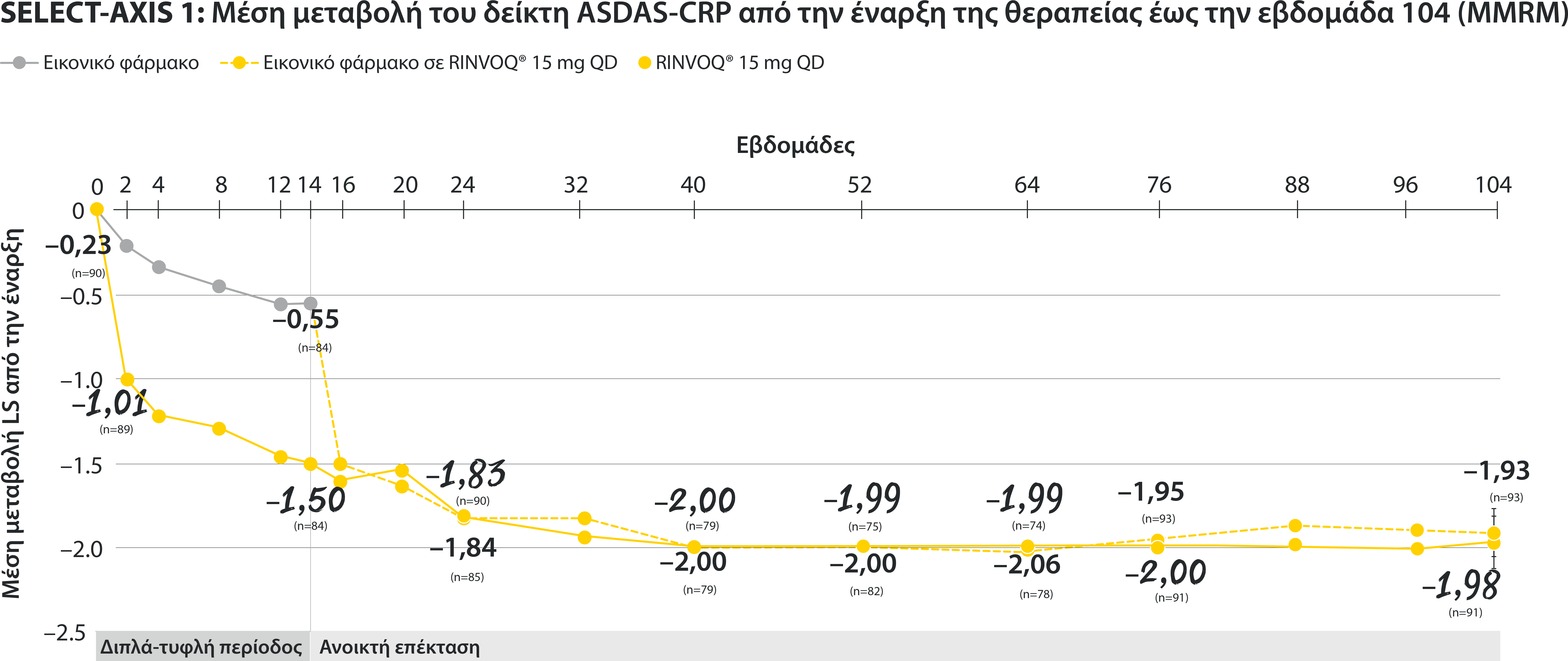
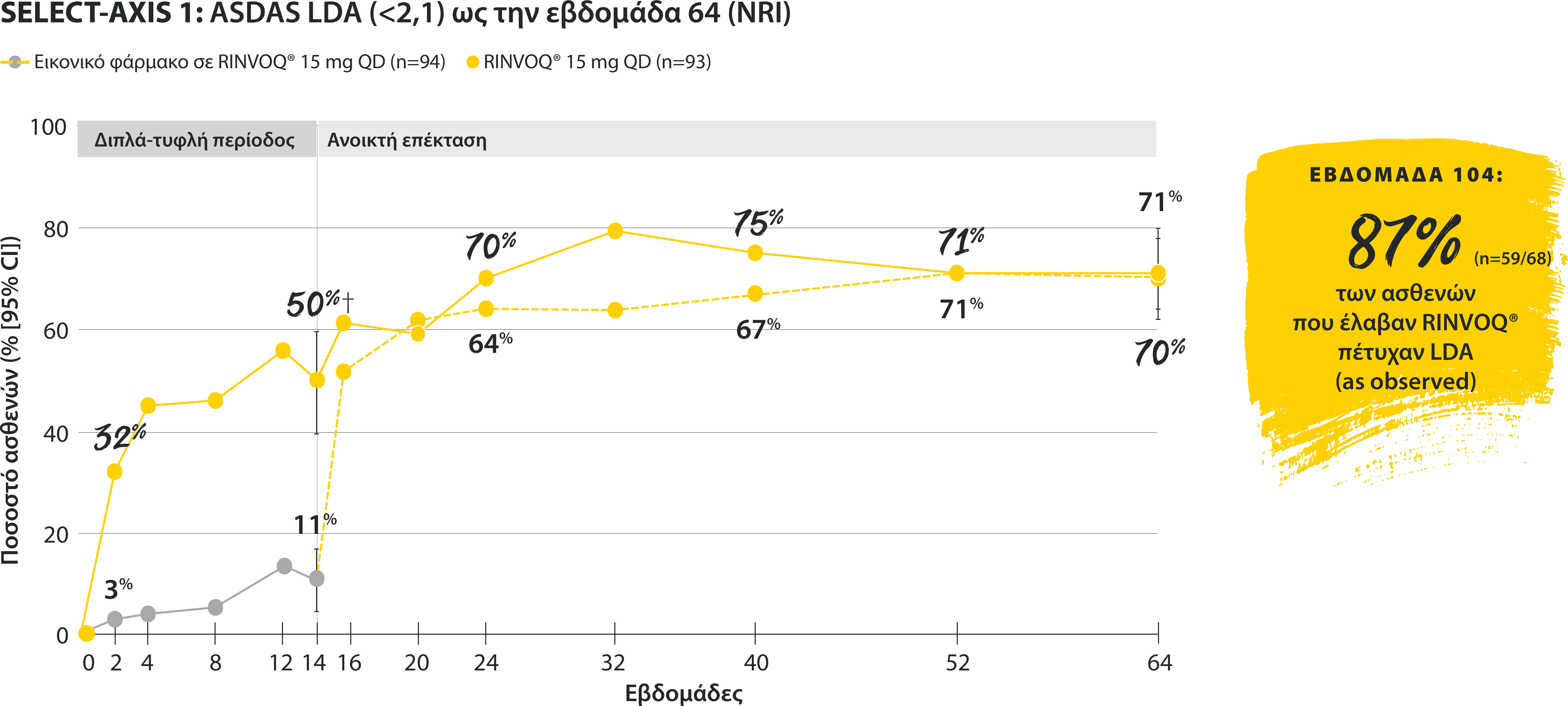
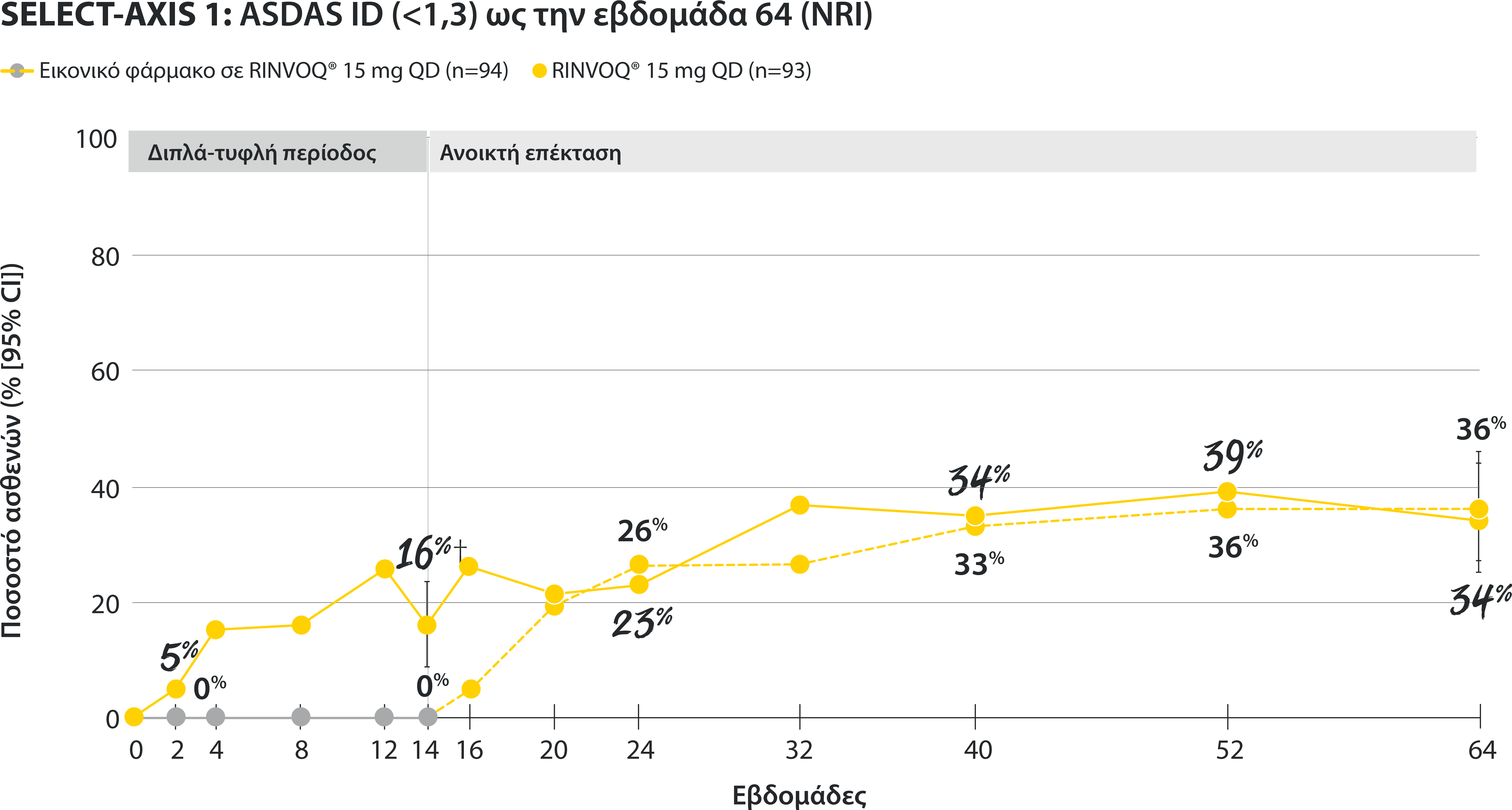
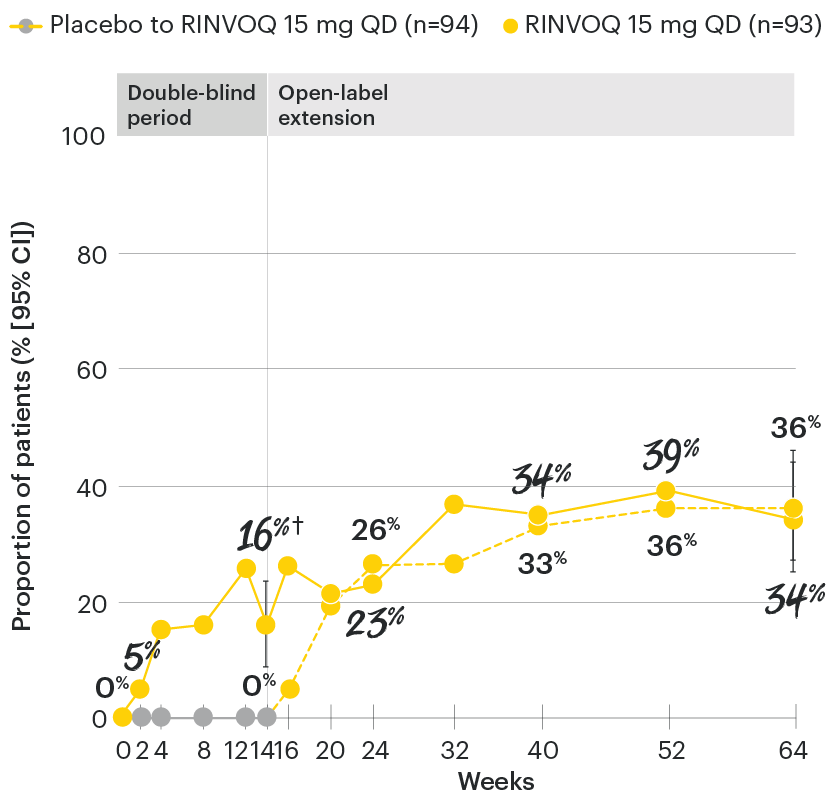
All patients randomized to placebo received open-label RINVOQ 15 mg QD starting from Week 14. Data shown are from the 64-week analysis of SELECT-AXIS 1.
95% confidence intervals are displayed as error bars in the chart, where available. Missing data were handled using NRI.
DATA LIMITATIONS: Data not labeled as a ranked primary or secondary endpoint were prespecified, however they were not ranked or controlled for multiplicity; therefore, treatment differences could represent chance findings. No conclusions regarding these comparisons can be made.
ASDAS: Ankylosing Spondylitis Disease Activity Index; ASDAS-ID: Ankylosing Spondylitis Disease Activity inactive disease; NRI: nonresponder imputation; QD: once daily.
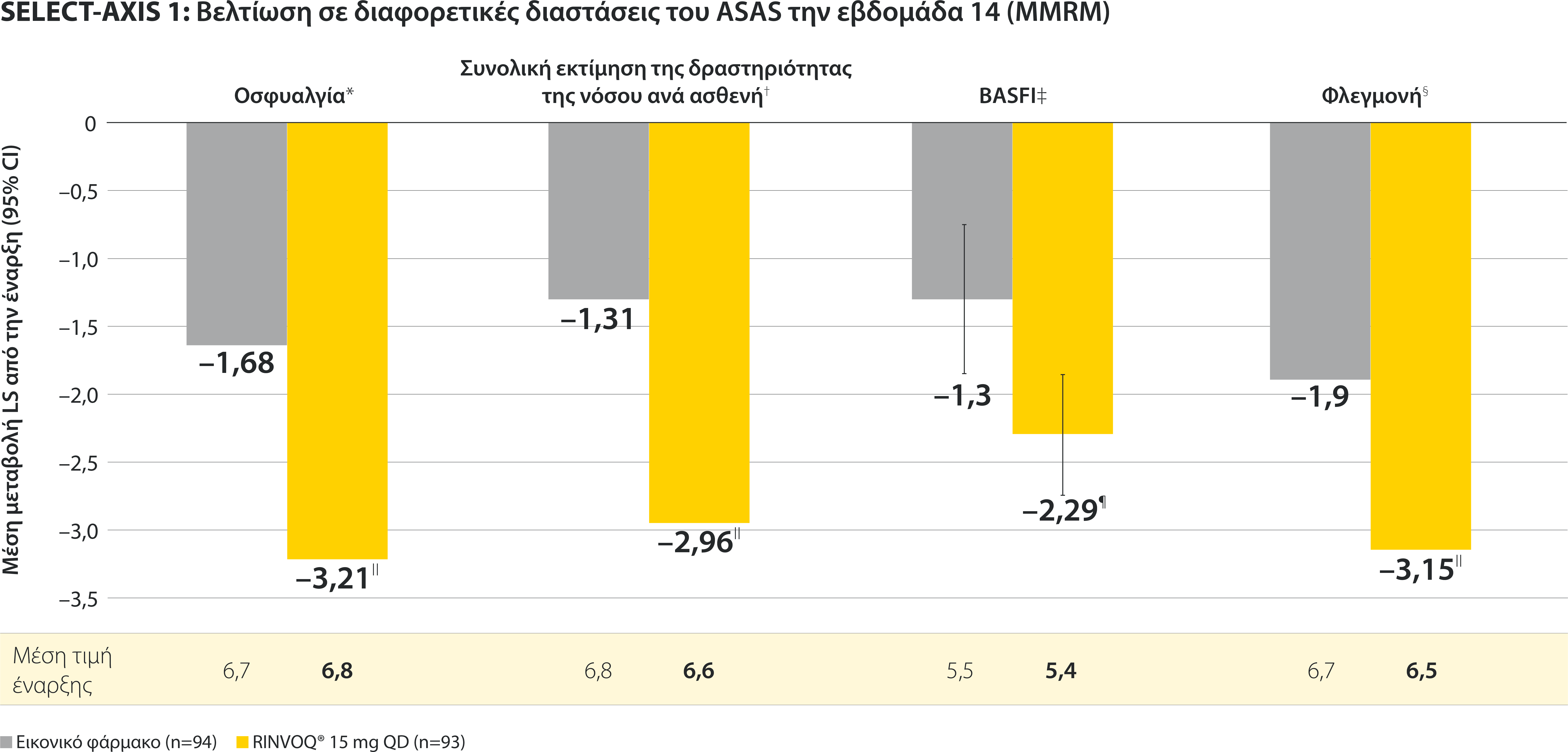
Σε ενήλικες ασθενείς με ενεργό Αγκυλοποιητική Σπονδυλίτιδα και ανεπαρκή ανταπόκριση στη συμβατική θεραπεία
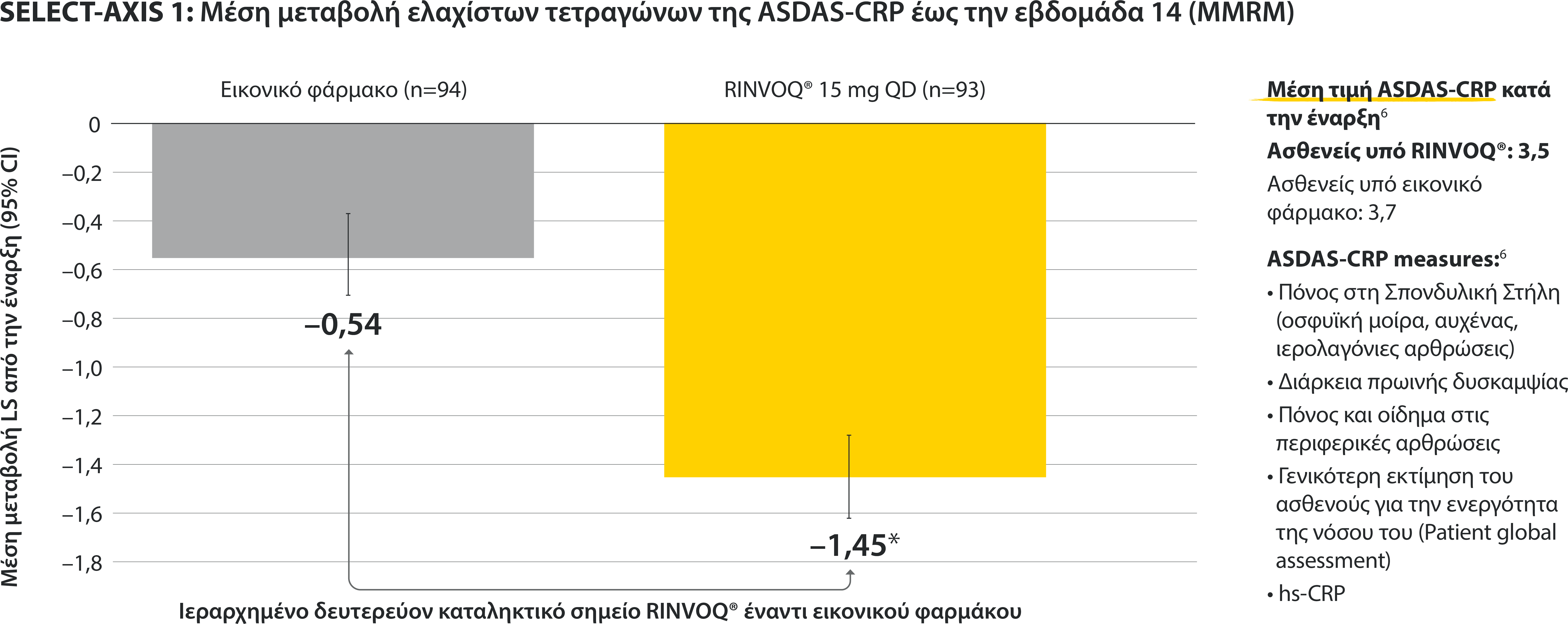
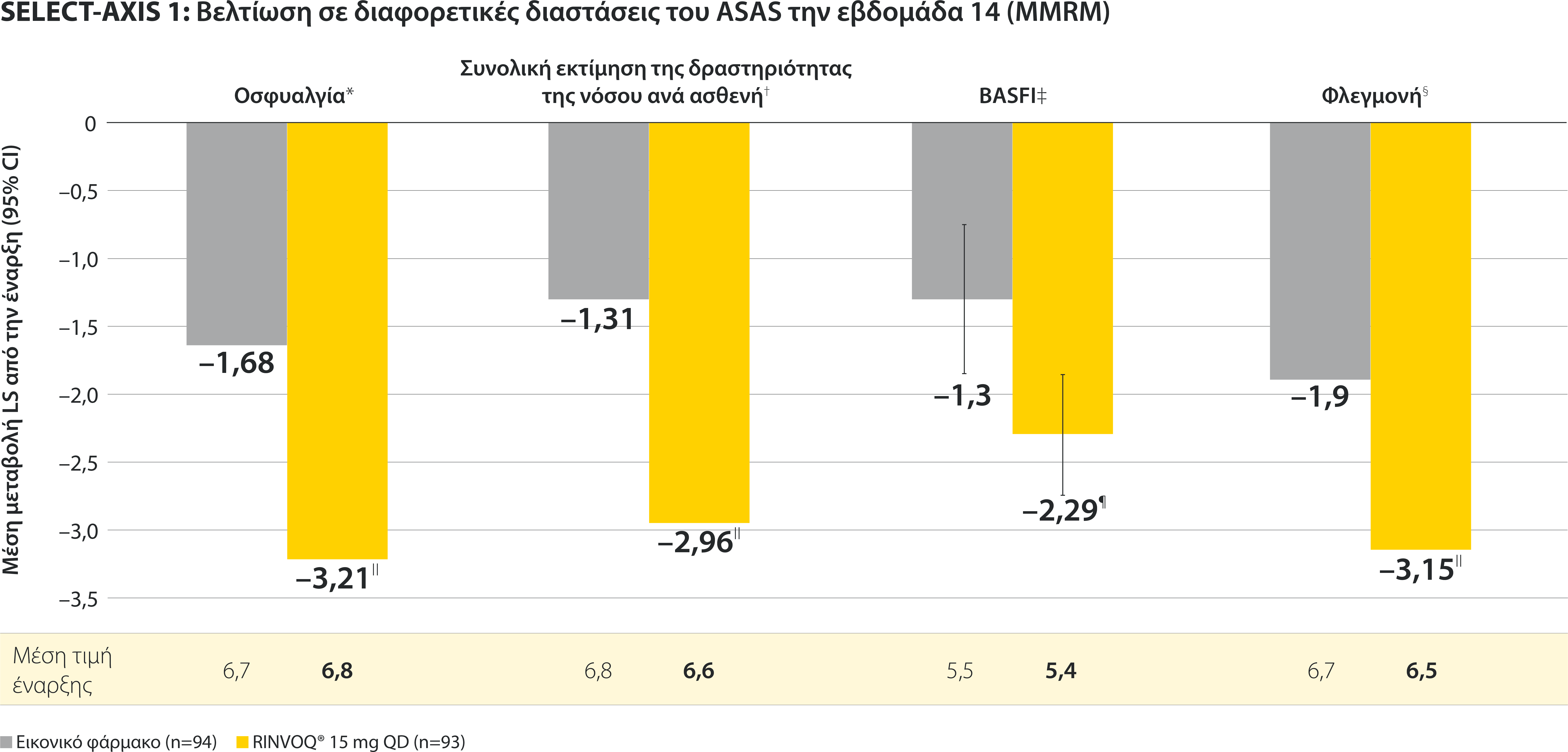
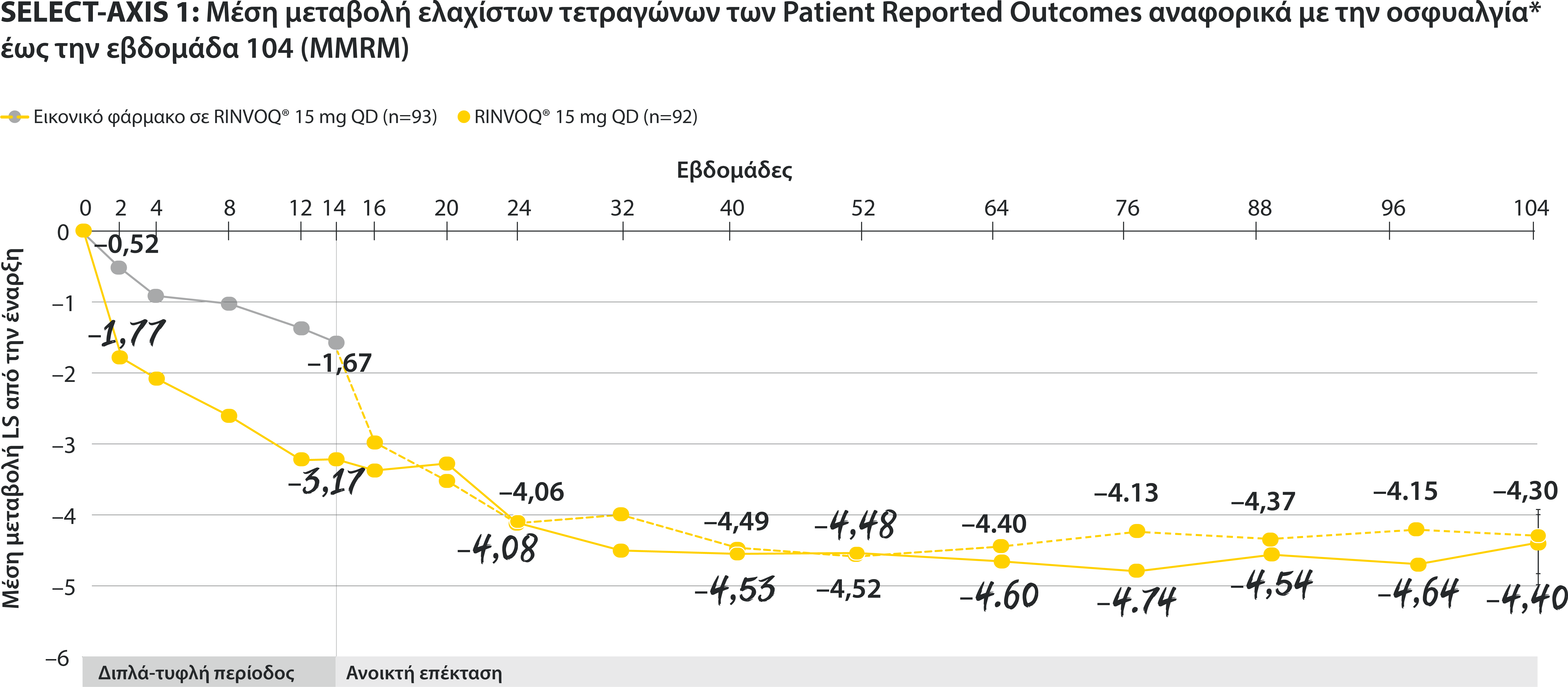
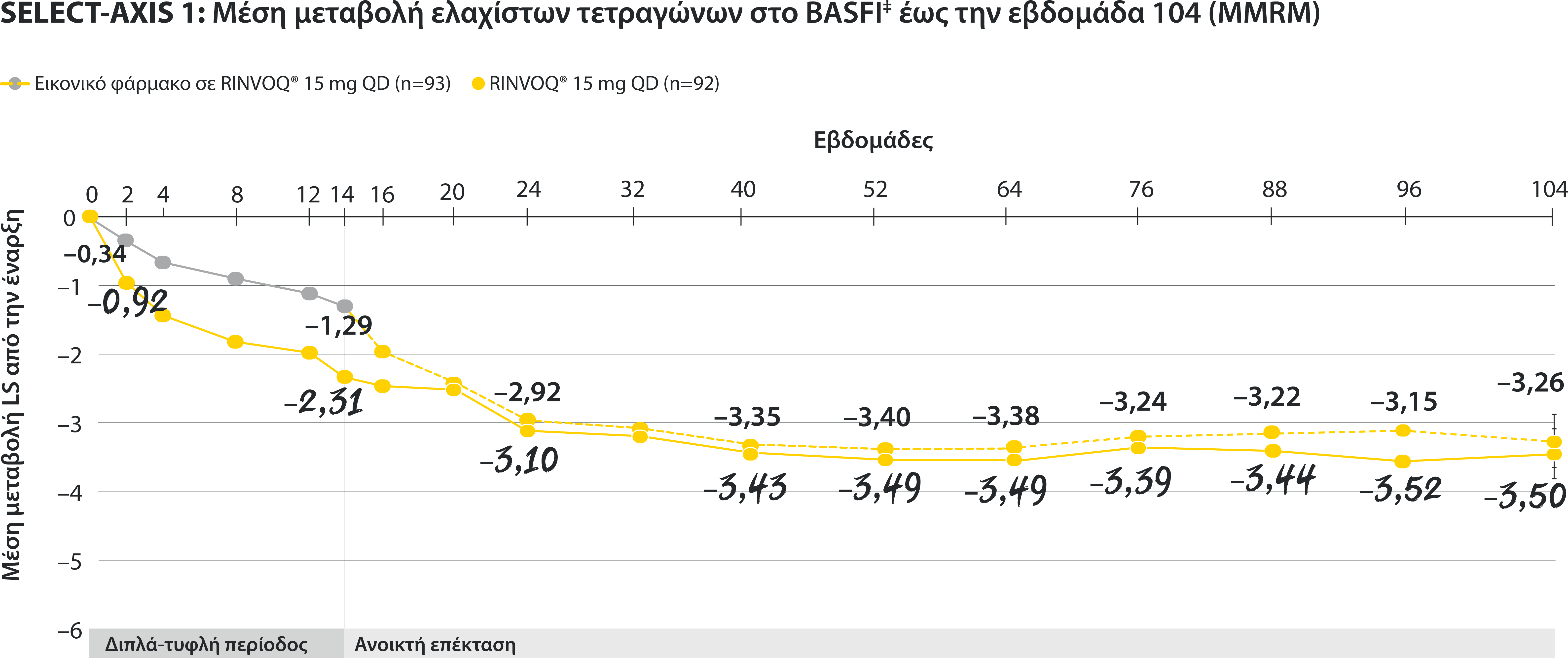
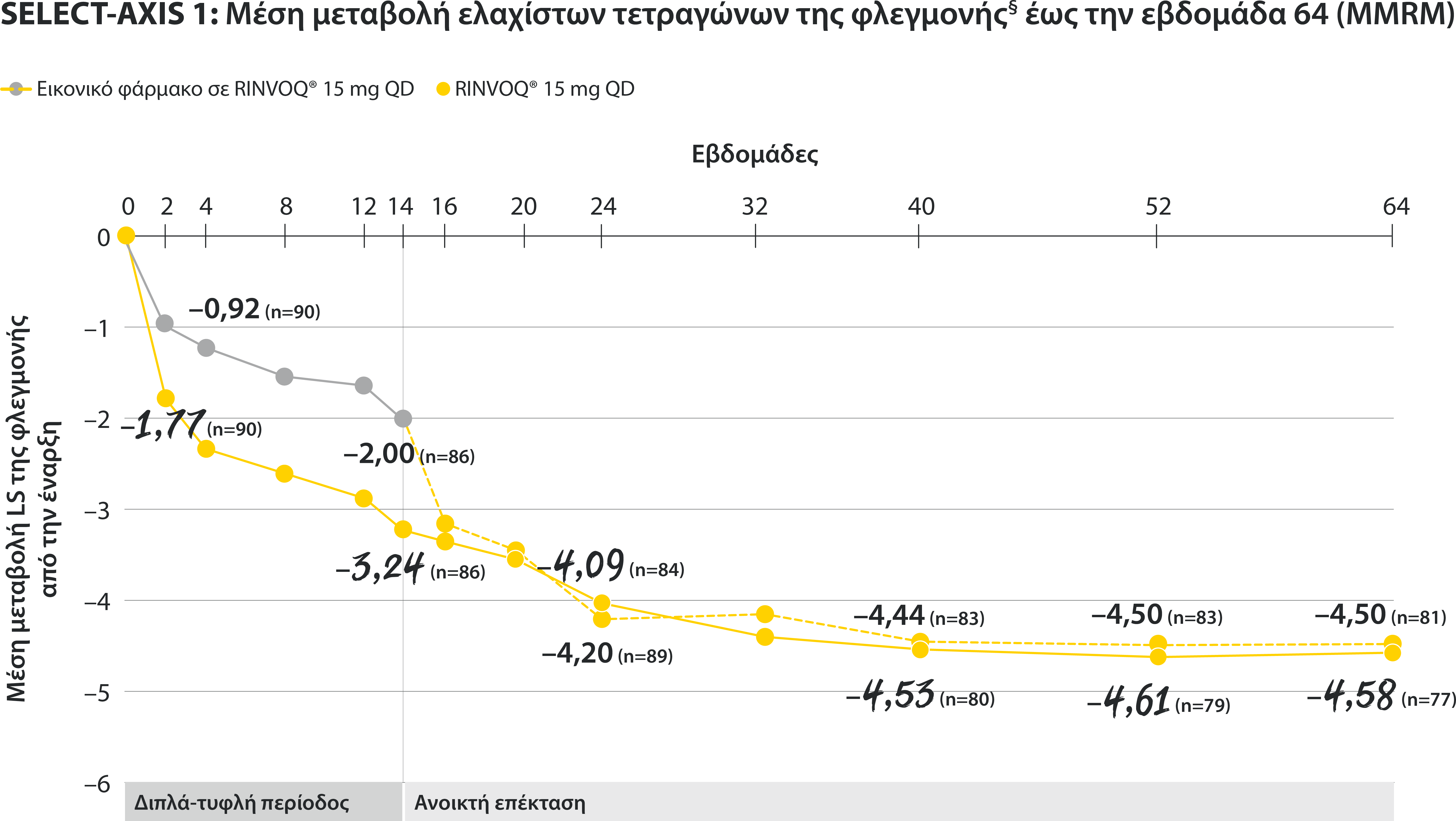
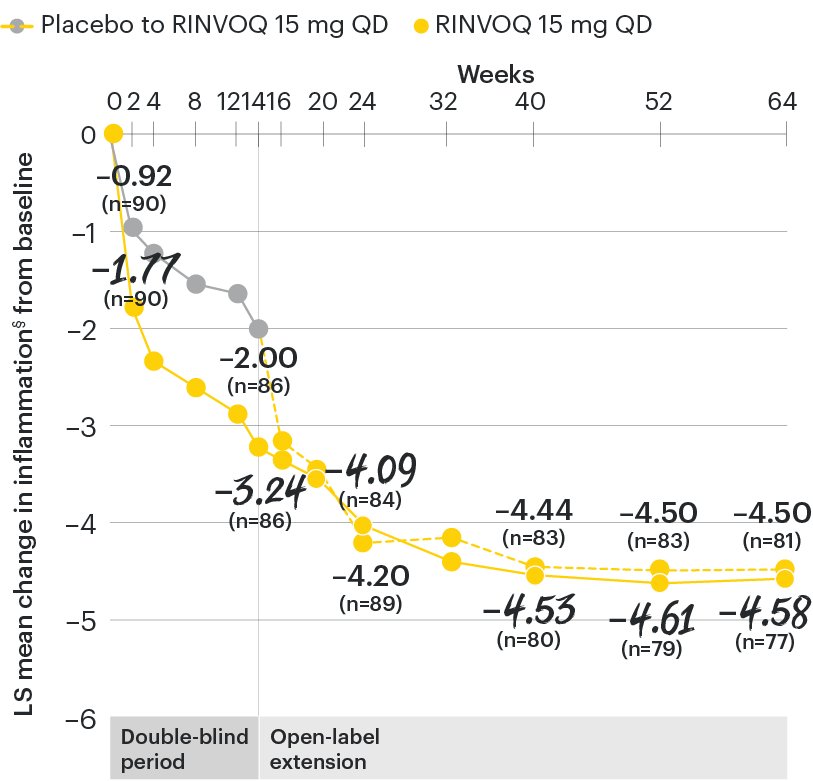
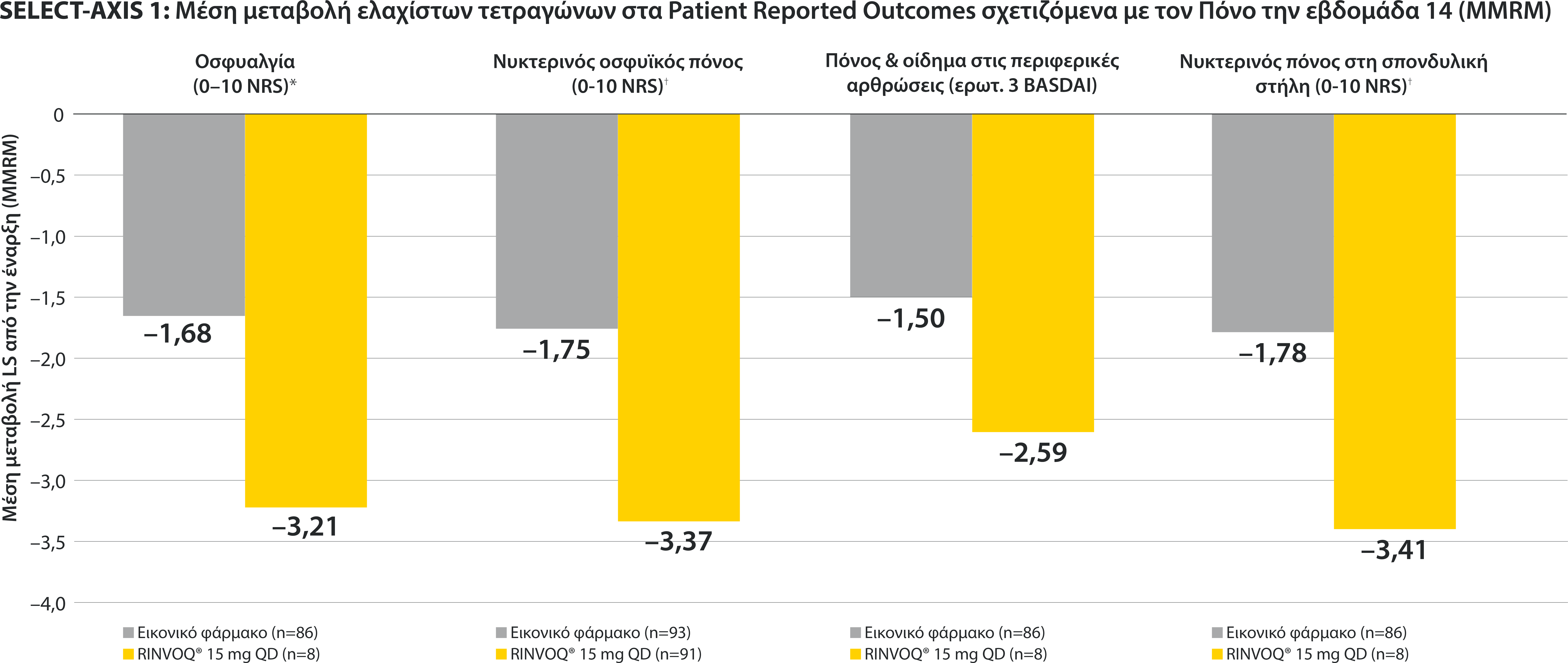
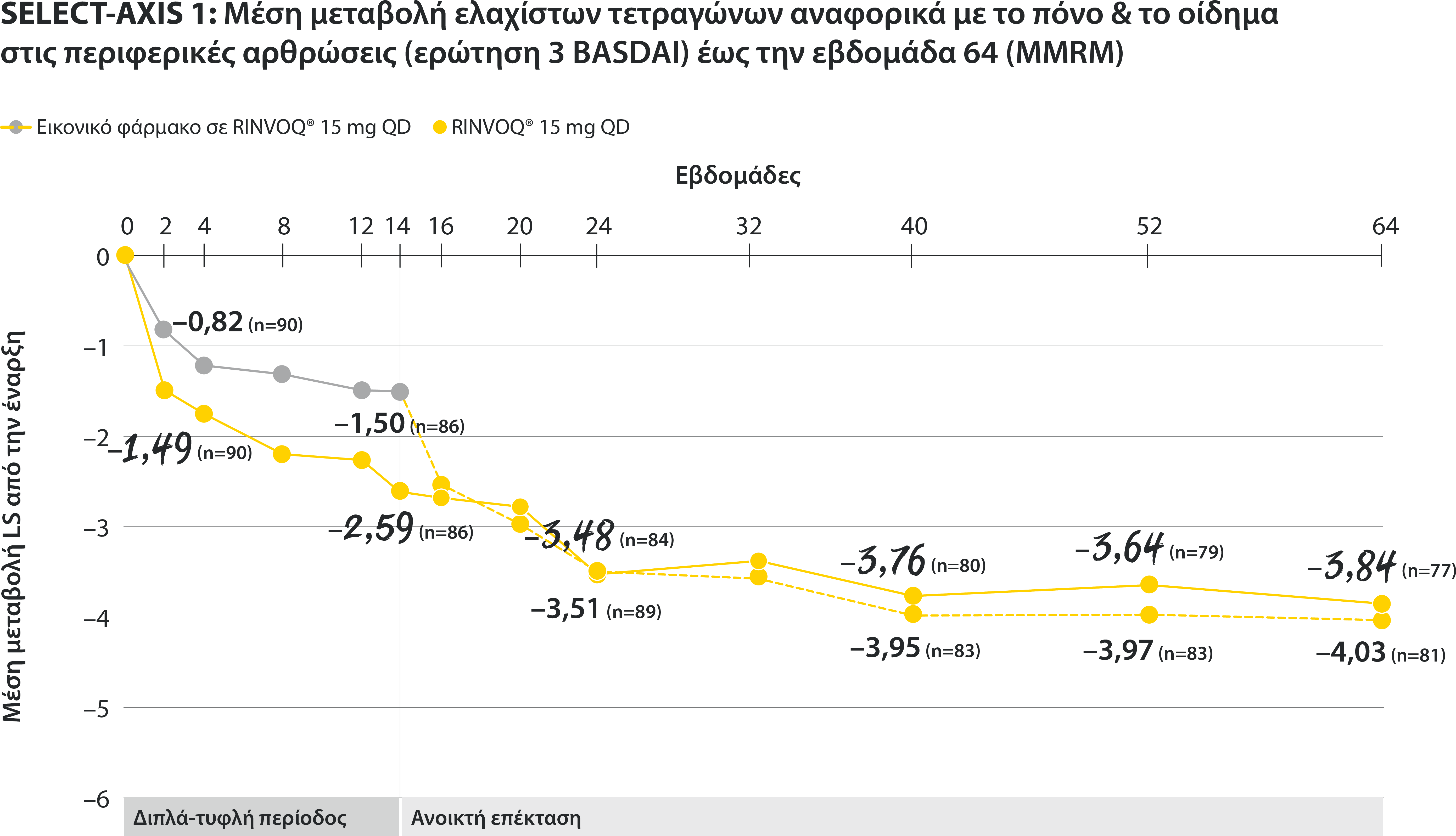
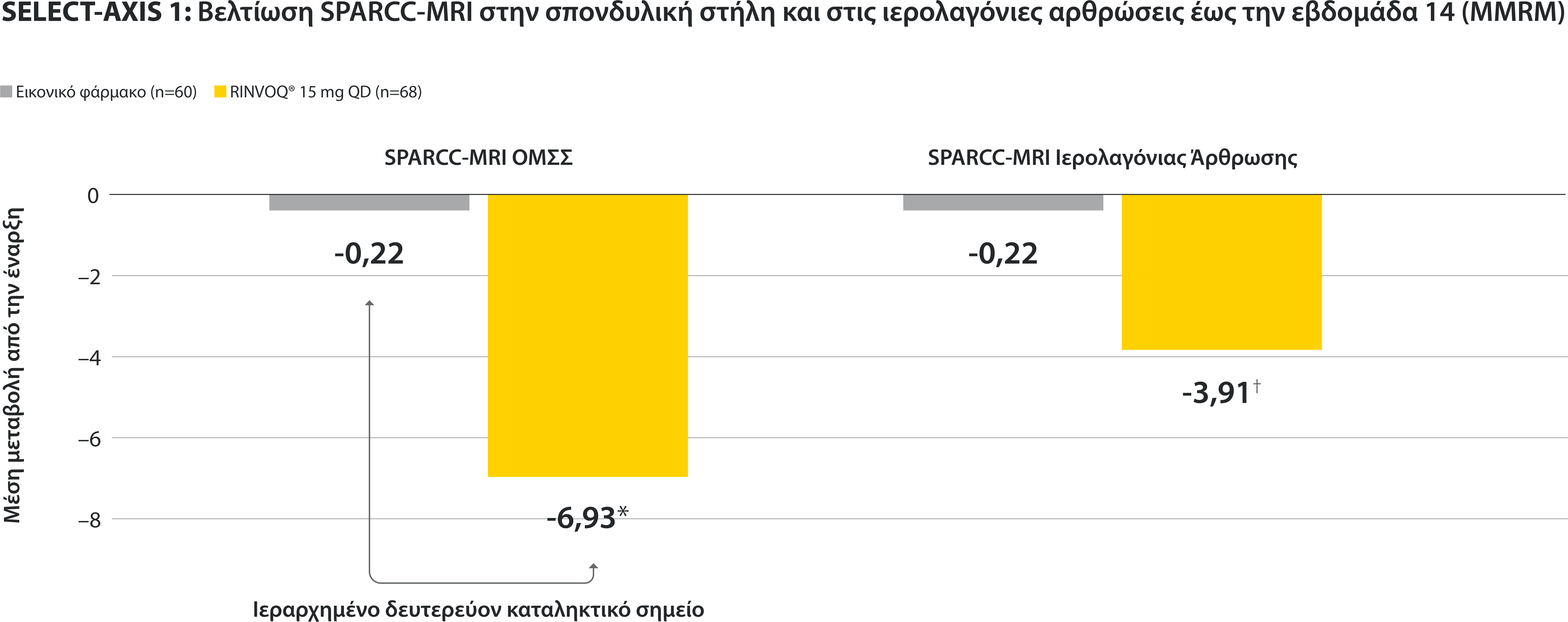
ΠΕΡΙΟΡΙΣΜΟΙ ΔΕΔΟΜΕΝΩΝ: Τα δεδομένα τα οποία δεν χαρακτηρίζονταν ως πρωτεύον ή δευτερεύον ιεραρχημένο καταληκτικό σημείο ήταν προκαθορισμένα, αλλά δεν ελέγχθηκαν για πολλαπλότητα. II Αριθμητική διαφορά P≤0,001 έναντι εικονικού φαρμάκου, χωρίς έλεγχο για πολλαπλότητα.¶ Στατιστικά σημαντική διαφορά P≤0,01 έναντι εικονικού φαρμάκου, μετά από έλεγχο για πολλαπλότητα. * Η οσφυαλγία ορίστηκε σε κλίμακα (0–10) με βάση την εξής ερώτηση: “What is the amount of back pain that you experienced at any time during the last week?” † Η γενικότερη εκτίμηση του ασθενούς για την ενεργότητα της νόσου του μετρήθηκε σε δεκαβάθμια κλίμακα από 0 (χωρίς ενεργότητα) έως 10 (severe activity).‡ H μεταβολή κατά BASFI από την έναρξη έως την εβδομάδα 14 για τους ασθενείς υπό RINVOQ® έναντι εικονικού φαρμάκου ήταν δευτερεύον ιεραρχημένο καταληκτικό σημείο για την εβδομάδα 14. Η κινητικότητα μετρήθηκε με την χρήση του Bath Ankylosing Spondylitis Functional Index (BASFI), το οποίο αποτελείται από 10 ερωτήσεις που αξιολογούν την ικανότητα του ασθενούς να εκτελεί συγκεκριμένες λειτουργίες σε μια αριθμητική κλίμακα από 0 (εύκολα) έως 10 (αδύνατον). § Η μέτρηση της φλεγμονής προκύπτει από τον μ.ο των απαντήσεων (NRS Scores) στις 2 ερωτήσεις του BASDAI που σχετίζονται με τη πρωινή δυσκαμψία (μ.ο. των ερωτήσεων 5 και 6 του BASDAI): Ερώτηση 5: “How would you describe the overall level of morning stiꄀness you have had from the time you woke up?” και ερώτηση 6: “How long does your morning stiꄀness last from the time you wake up?”Οι μπάρες απεικονίζουν το 95% διάστημα εμπιστοσύνης. Η ανάλυση έγινε με τη χρήση MMRM για τα ελλιπή δεδομένα.
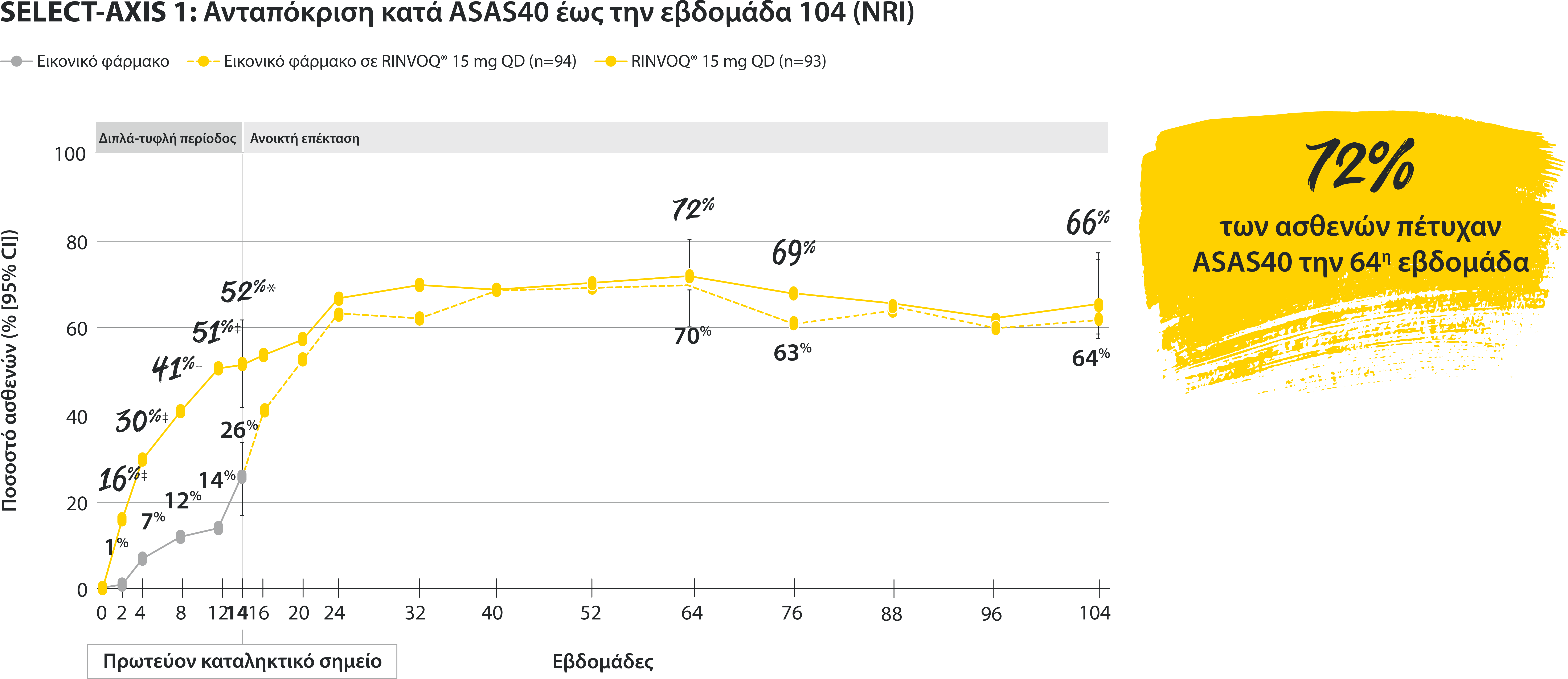
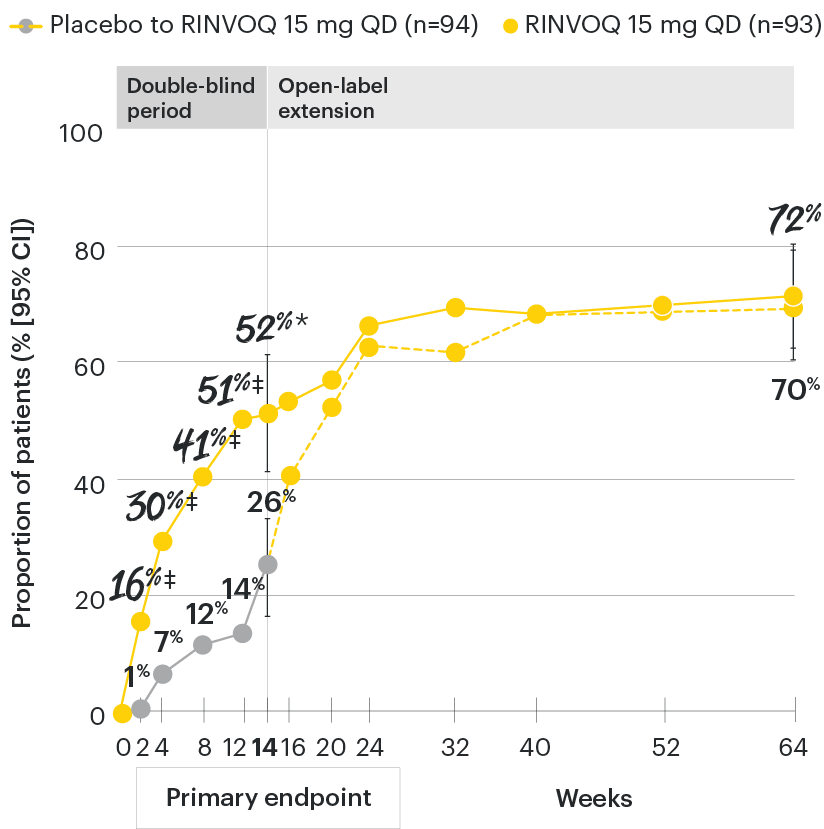
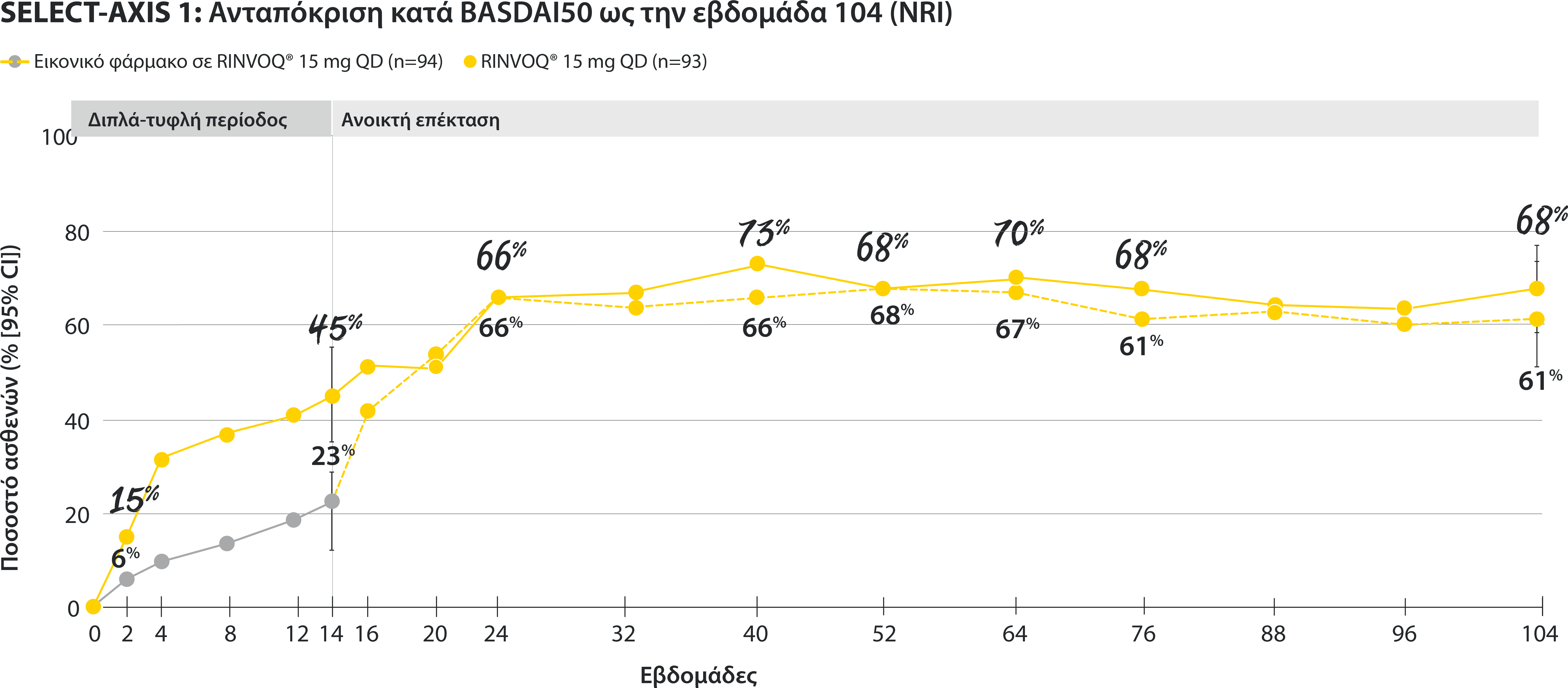
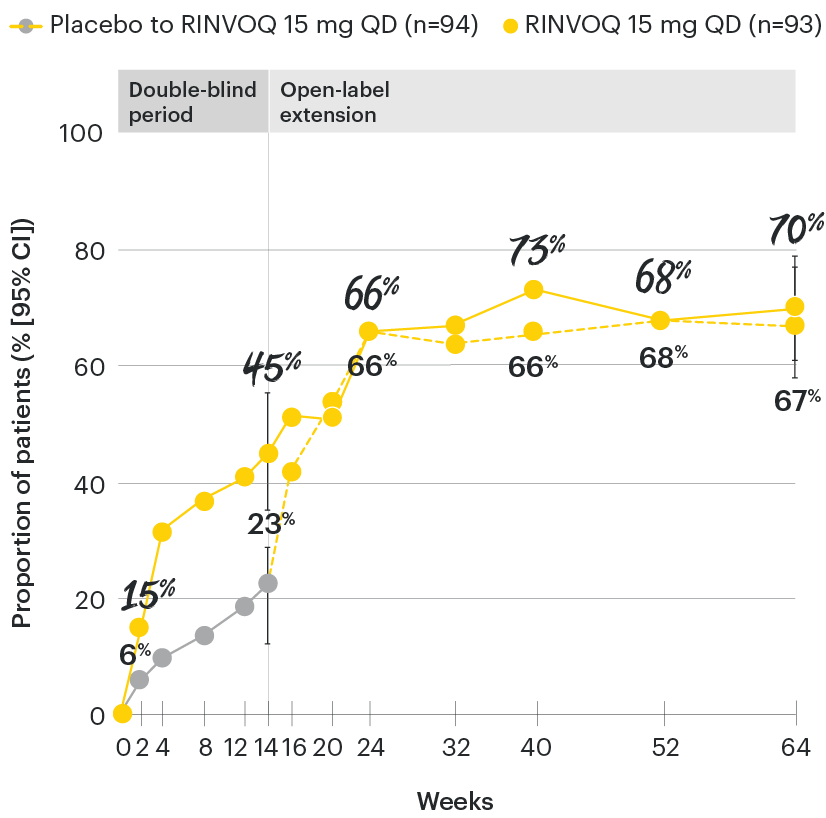
All patients randomized to placebo received open-label RINVOQ 15 mg QD starting from Week 14. Data shown are from the 64-week analysis of SELECT-AXIS 1.
95% confidence intervals are displayed as error bars in the chart, where available. Missing data were handled using NRI.
DATA LIMITATIONS: Data not labeled as a ranked primary or secondary endpoint were prespecified, however they were not ranked or controlled for multiplicity; therefore, treatment differences could represent chance findings. No conclusions regarding these comparisons can be made.
BASDAI50: at least 50% improvement in Bath Ankylosing Spondylitis Disease Activity Index; CI: confidence interval; NRI: nonresponder imputation; QD: once daily.
In patients with active AS and an inadequate response to conventional therapy
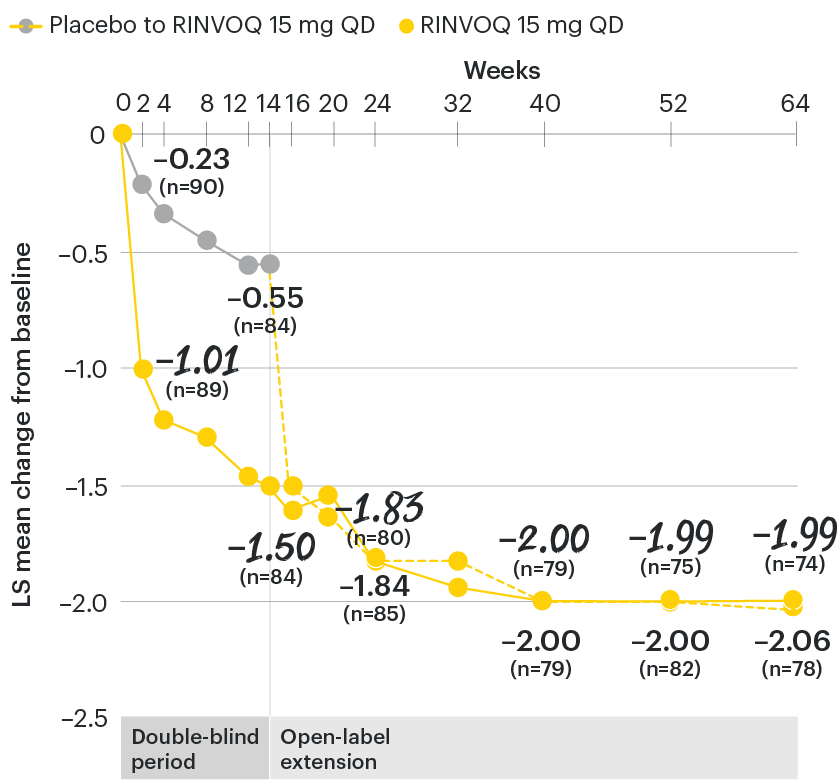
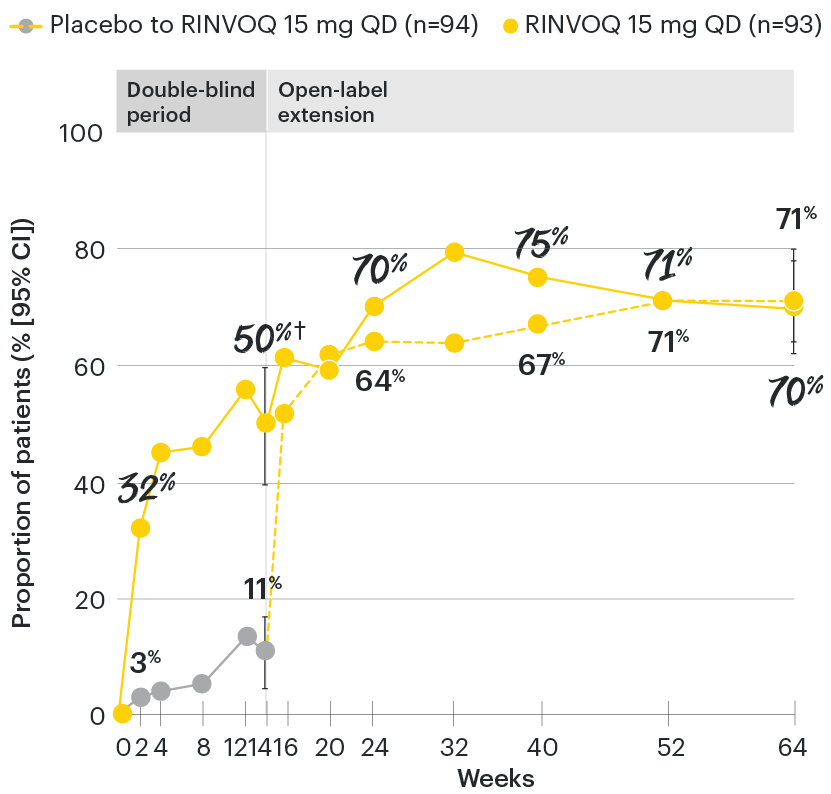
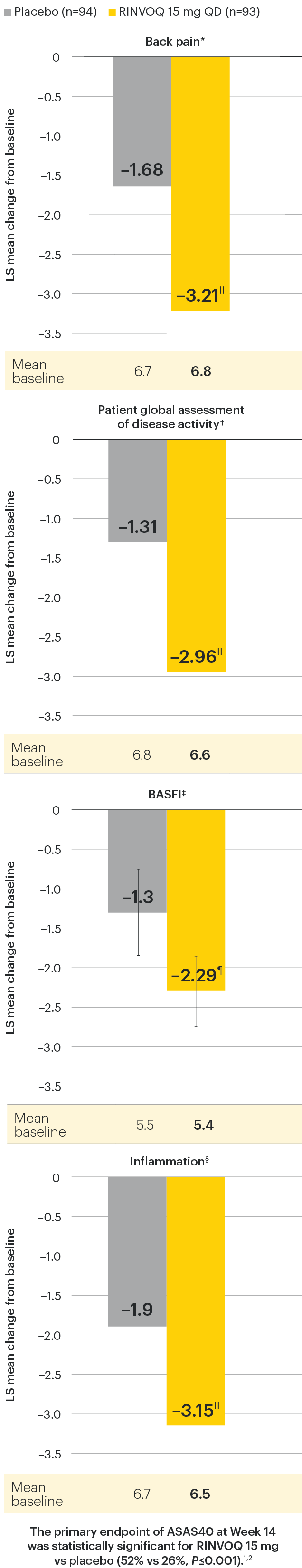
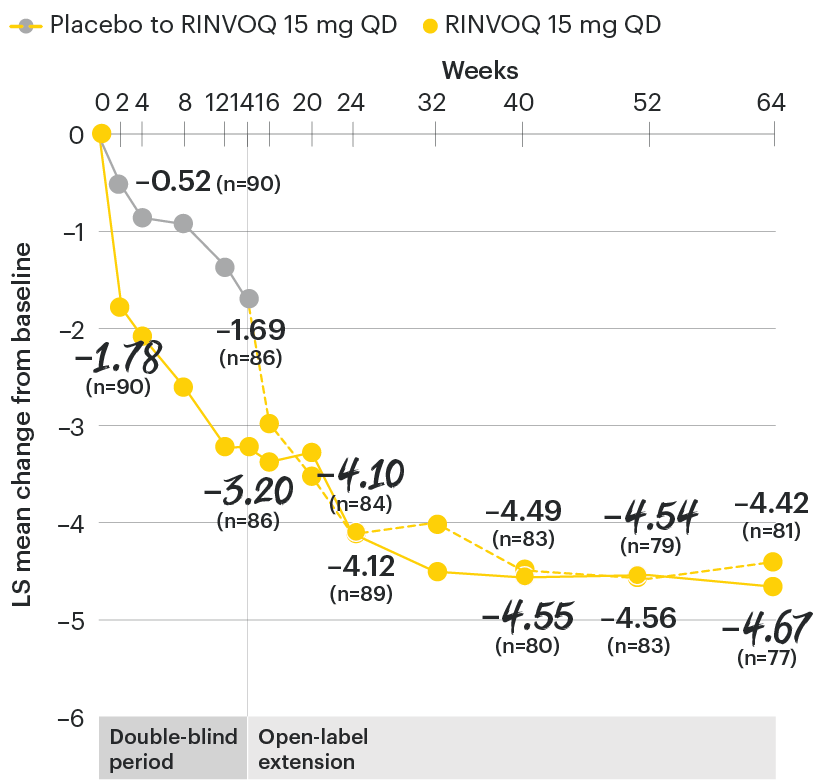
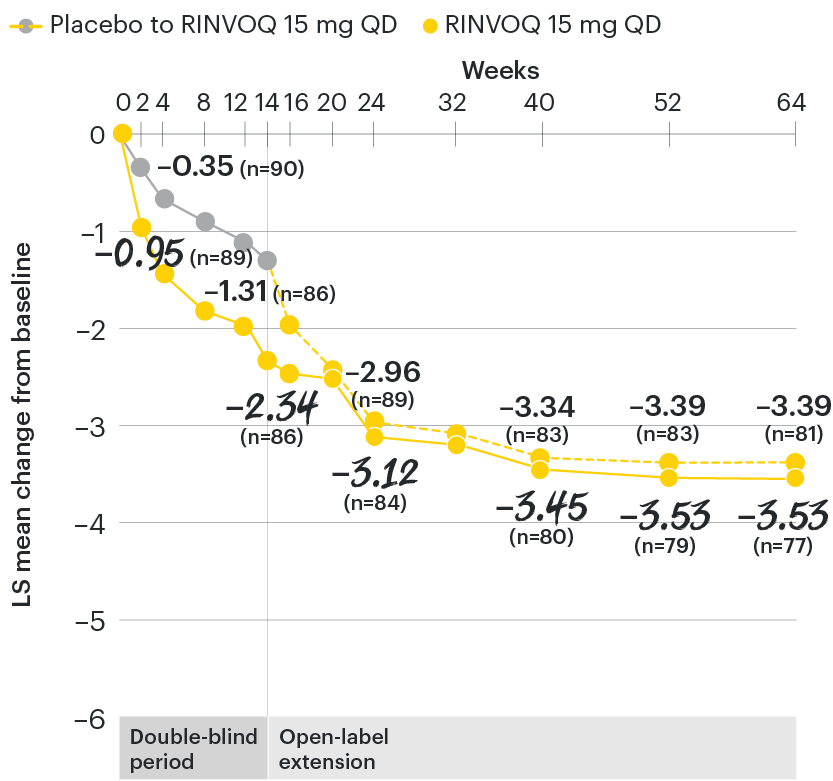
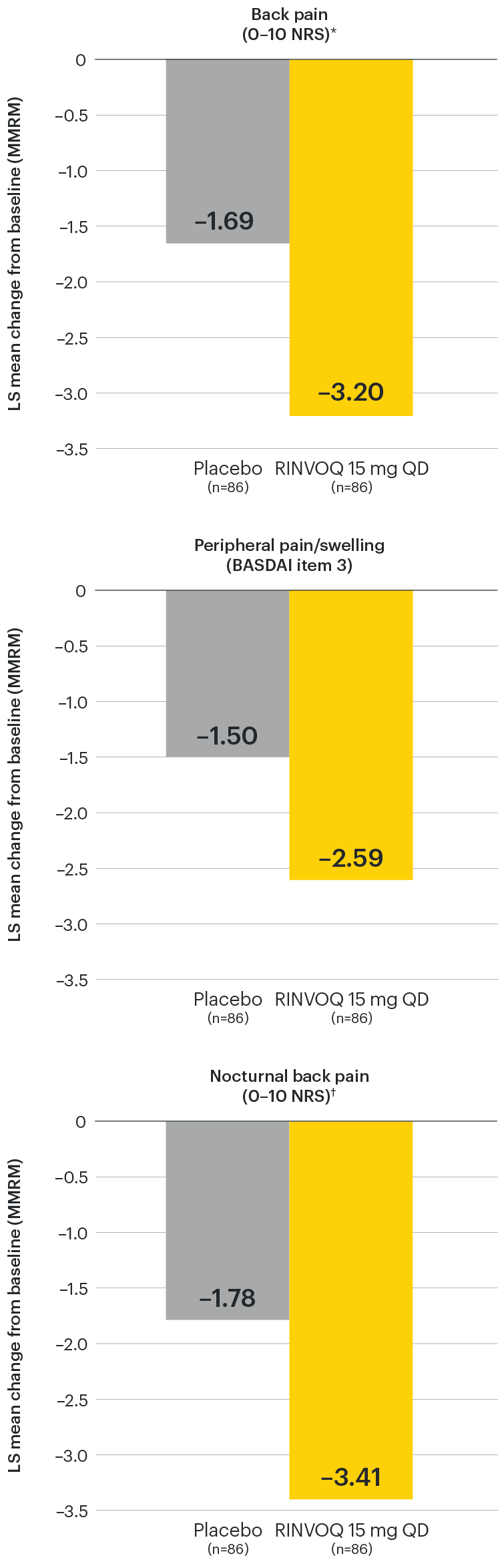
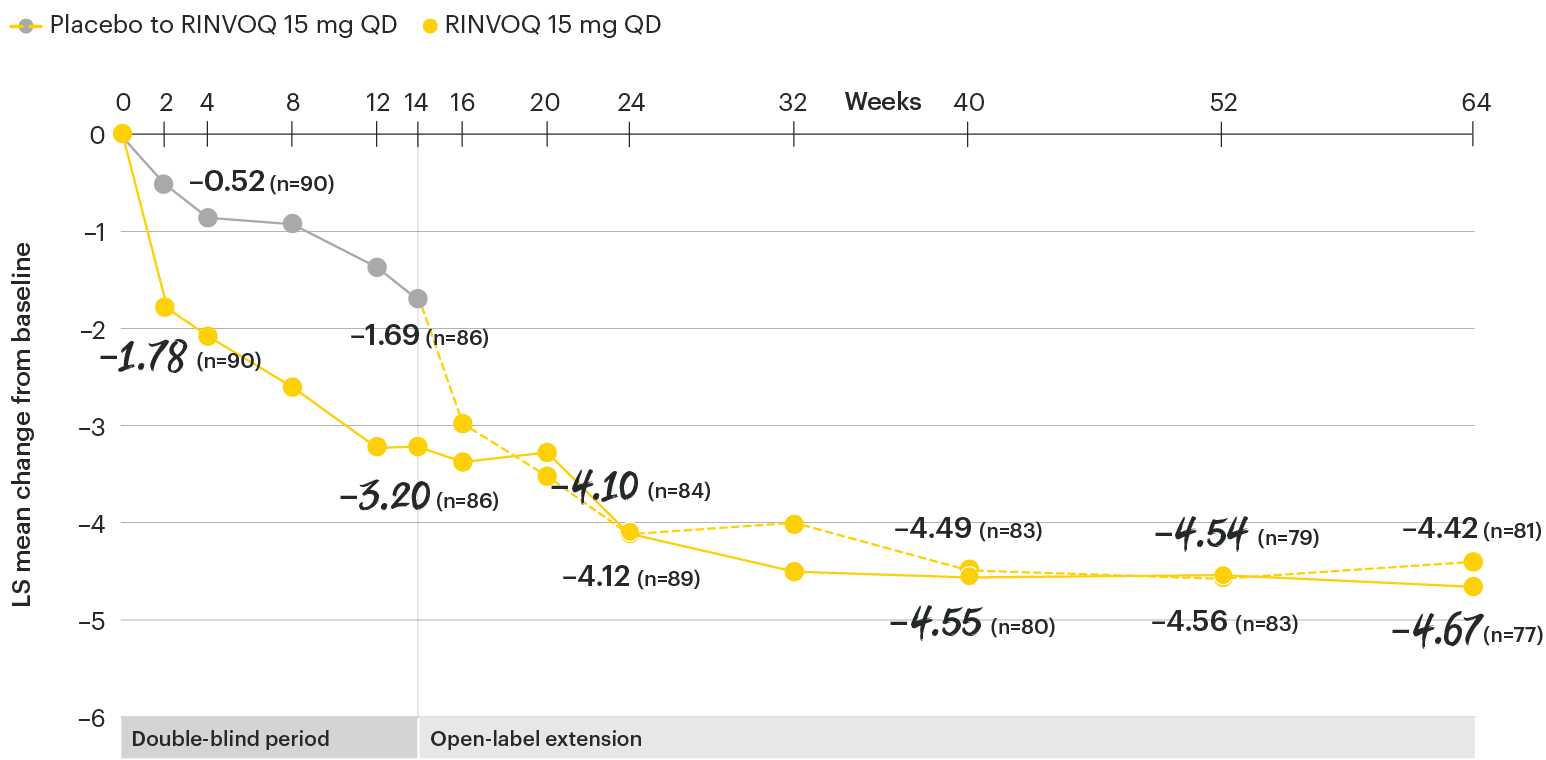
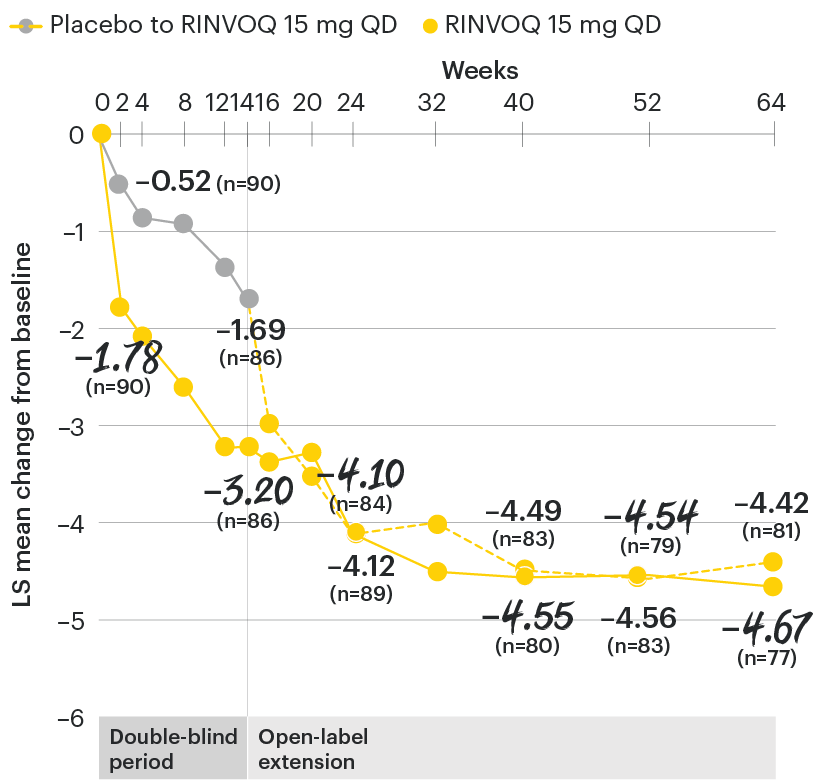
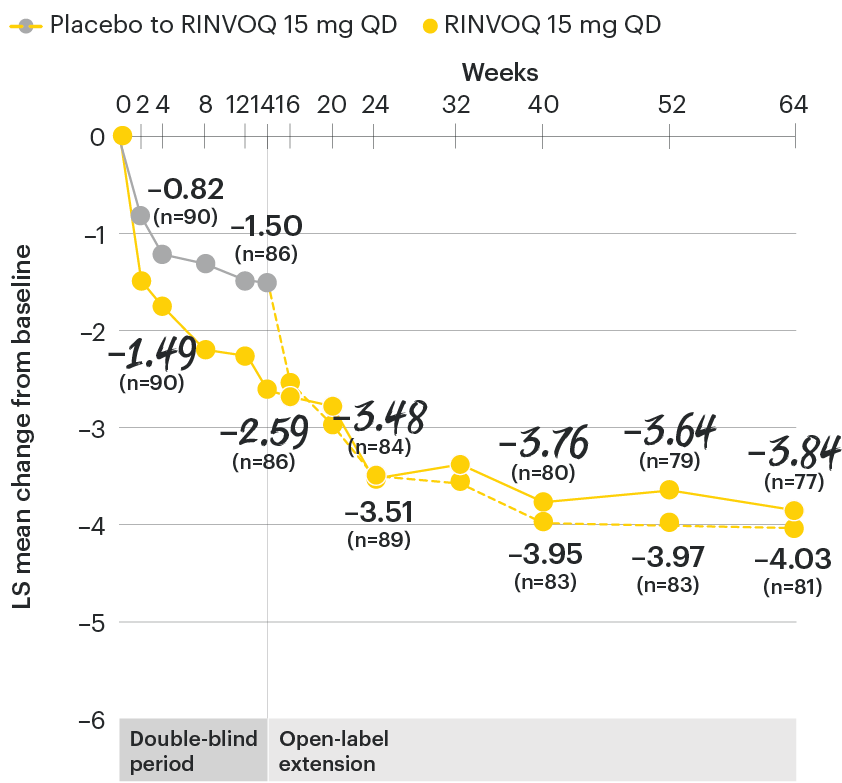
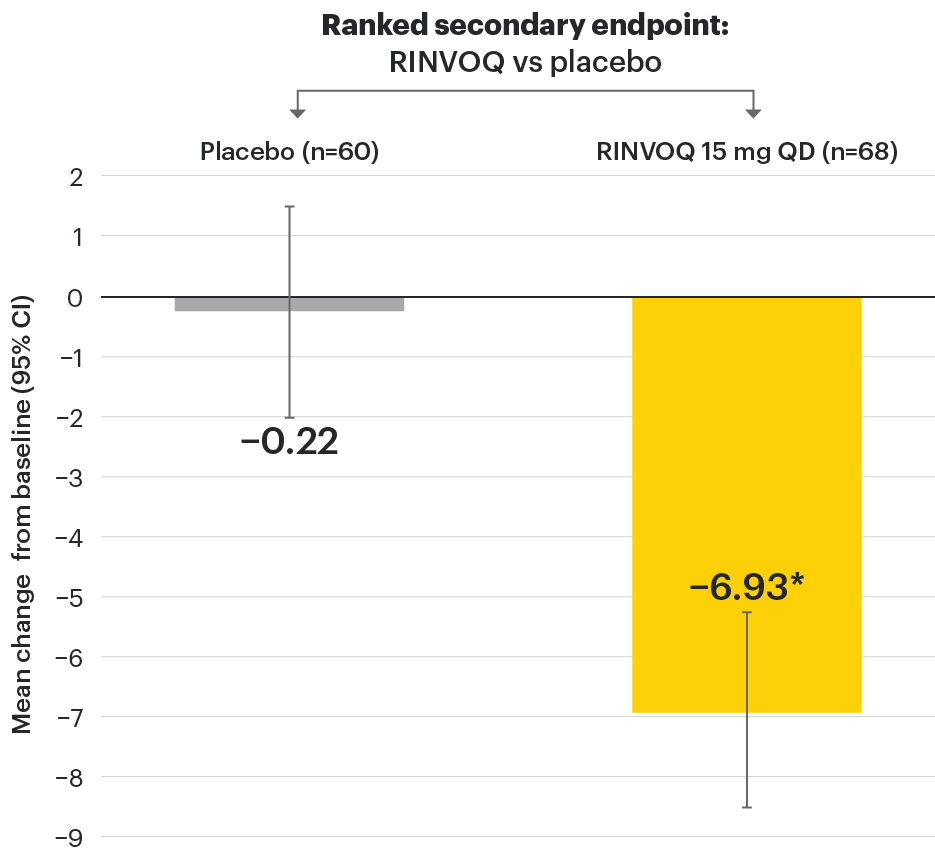
Change in back pain from baseline over time
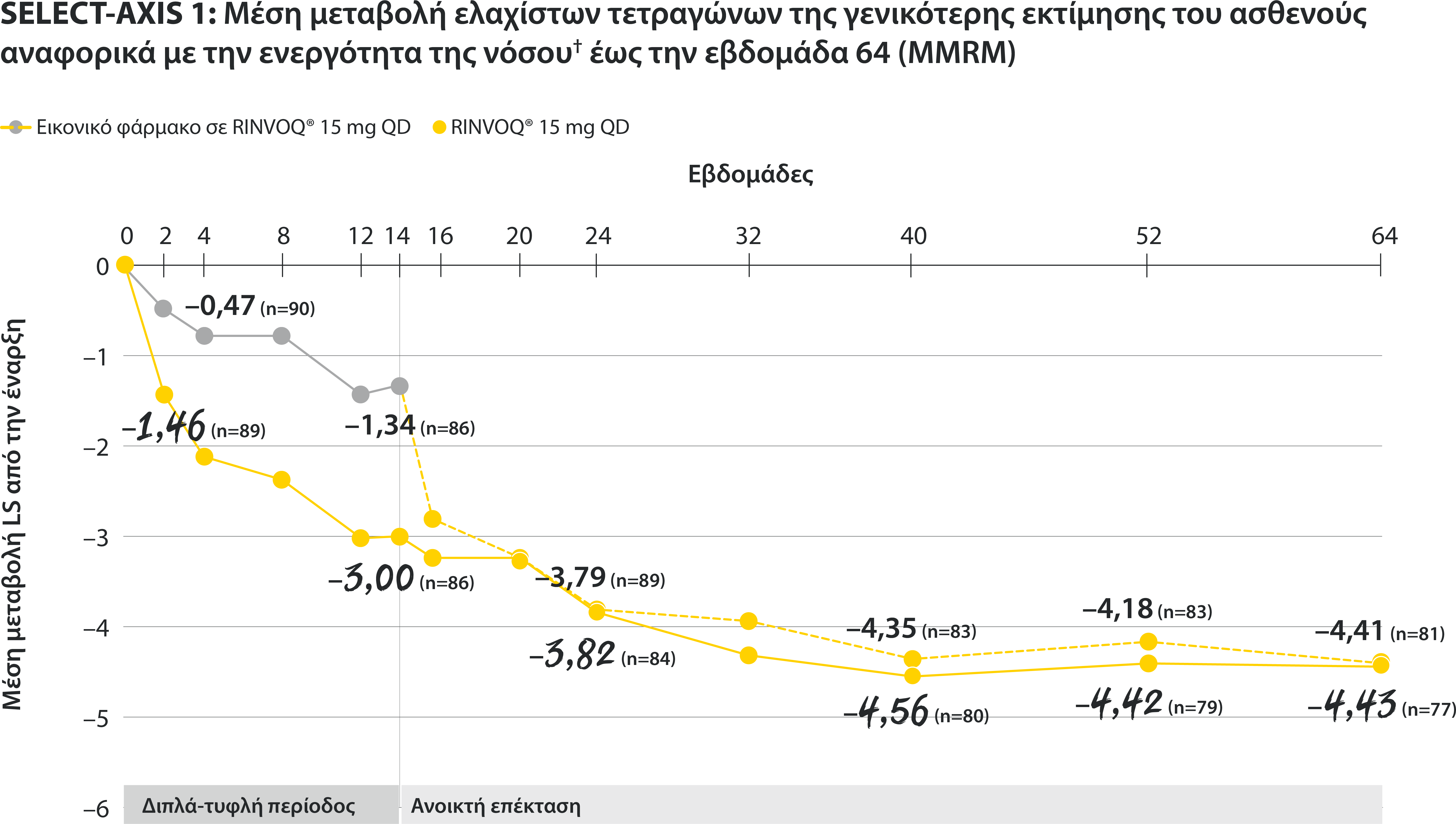
SELECT-AXIS 1: LS mean change in patient-reported back pain* from baseline to Week 64 (MMRM)3
*Back pain defined on a numerical rating scale (0–10) based on the following question: “What is the amount of back pain that you experienced at any time during the last week?”
At baseline, mean back pain scores were 6.7 for placebo and 6.8 for RINVOQ 15 mg QD.
All patients randomized to placebo received open-label RINVOQ 15 mg QD starting from Week 14. Data shown are from the 64-week analysis of SELECT-AXIS 1 using MMRM for missing data. Because MMRM utilizes all available data to estimate a value for missing data, there may be small differences in the data out to Week 64 when compared with earlier analyses.
DATA LIMITATIONS: Data not labeled as a ranked primary or secondary endpoint were prespecified, however they were not ranked or controlled for multiplicity; therefore, treatment differences could represent chance findings. No conclusions regarding these comparisons can be made.
LS: least squares; MMRM: mixed-effect model for repeated measures; QD: once daily.
Σε ενήλικες ασθενείς με ενεργό Αγκυλοποιητική Σπονδυλίτιδα και ανεπαρκή ανταπόκριση στη συμβατική θεραπεία
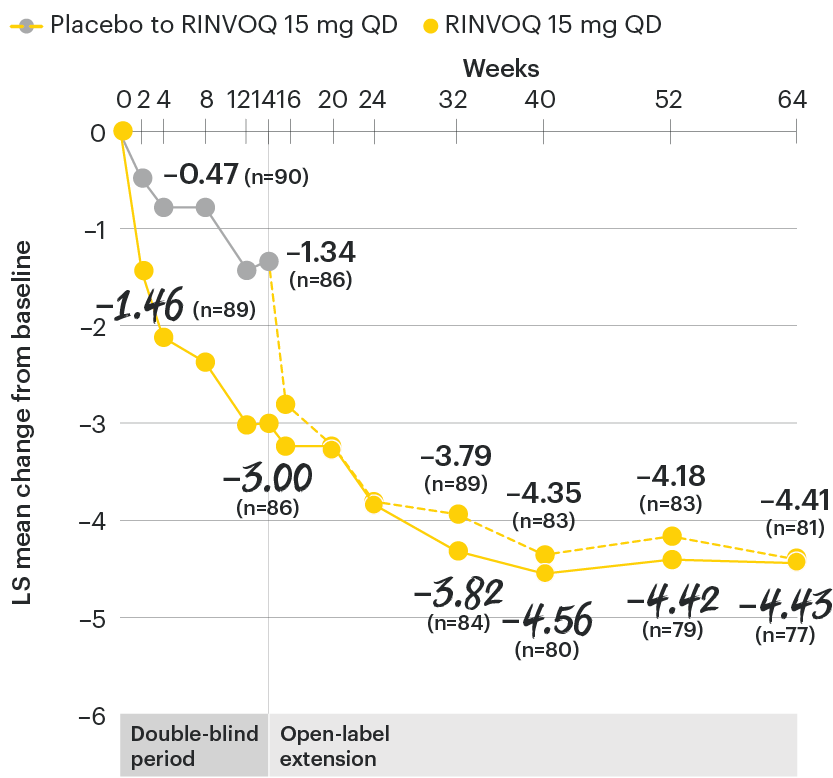
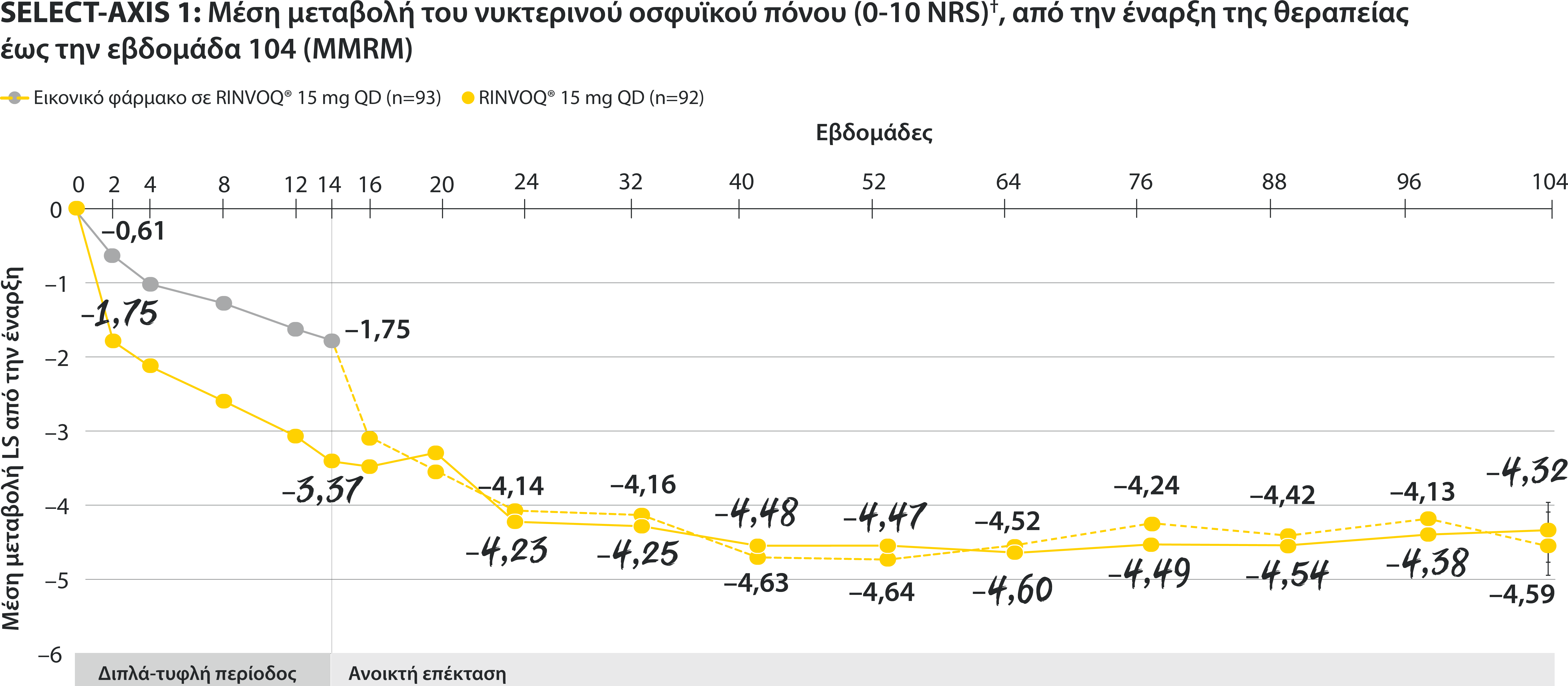
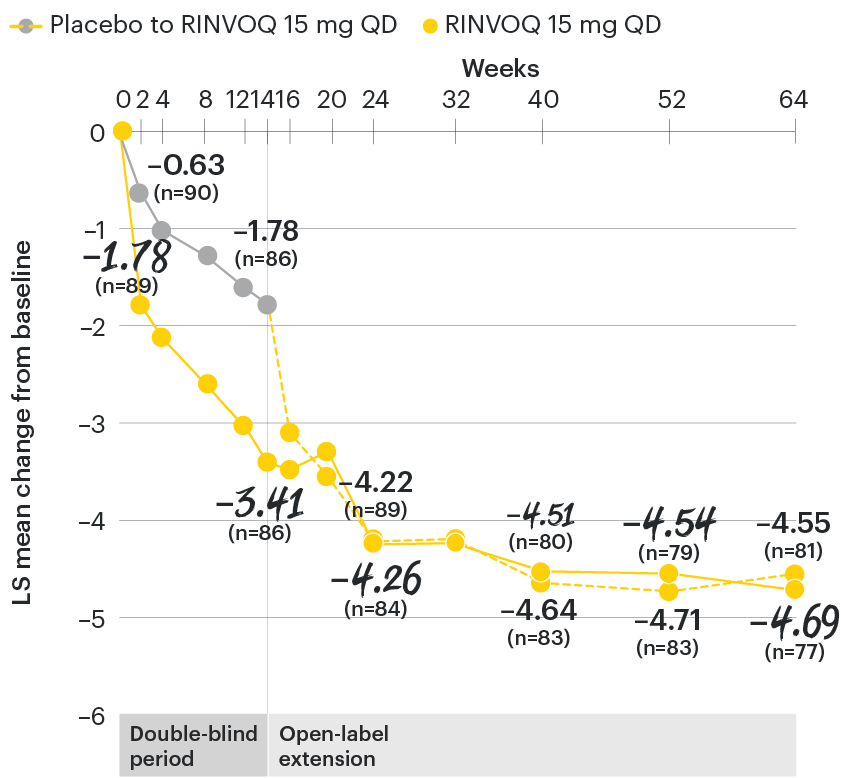
†Nocturnal back pain defined on a numerical rating scale (0–10) based on the following question: “What is the amount of back pain at night that you experienced during the last week?”
All patients randomized to placebo received open-label RINVOQ 15 mg QD starting from Week 14. Data shown are from the 64-week analysis of SELECT-AXIS 1 using MMRM for missing data. Because MMRM utilizes all available data to estimate a value for missing data, there may be small differences in the data out to Week 64 when compared with earlier analyses.
DATA LIMITATIONS: Data not labeled as a ranked primary or secondary endpoint were prespecified, however they were not ranked or controlled for multiplicity; therefore, treatment differences could represent chance findings. No conclusions regarding these comparisons can be made.
LS: least squares; MMRM: mixed-effect model for repeated measures; QD: once daily.
In patients with active AS and an inadequate response to conventional therapy
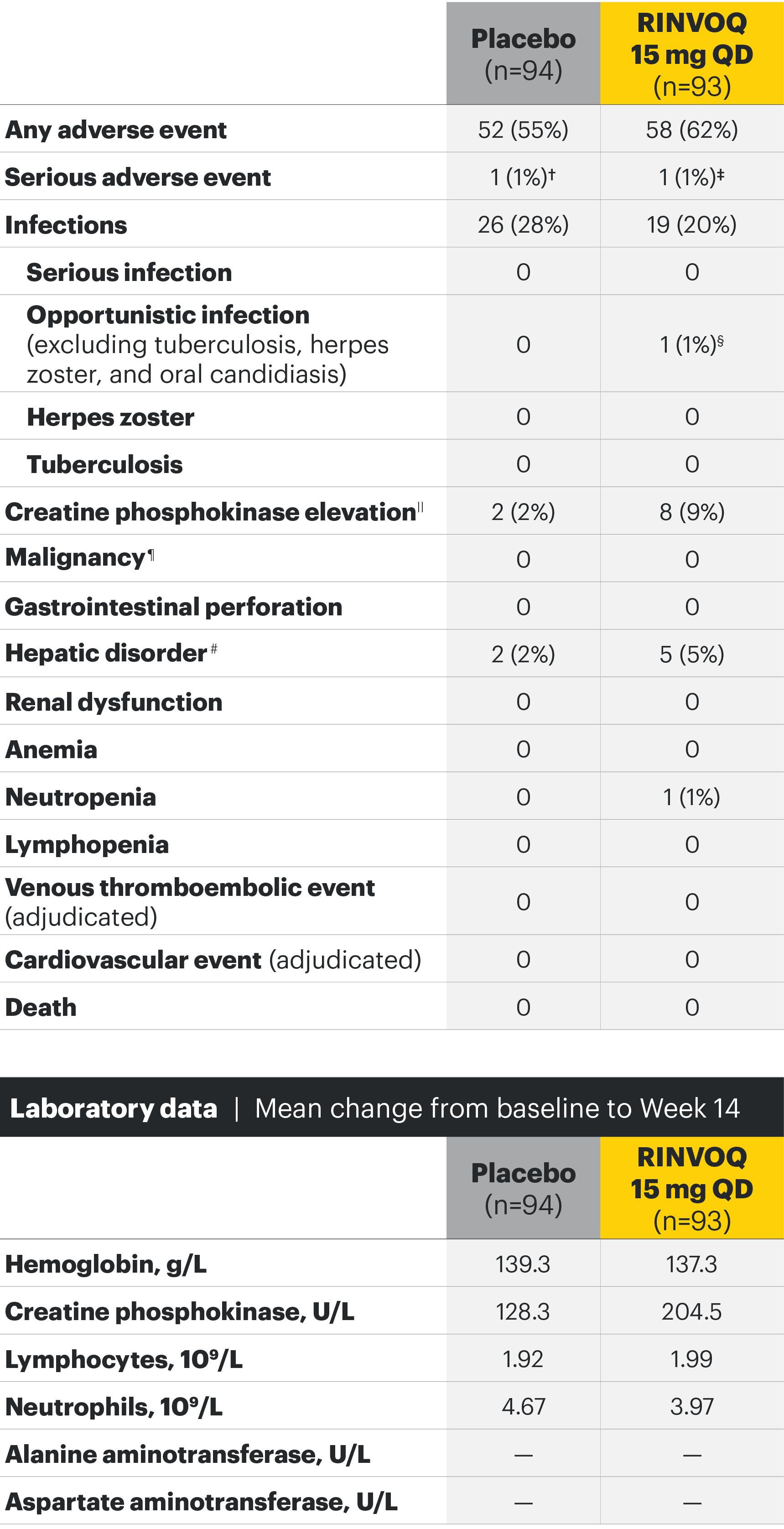
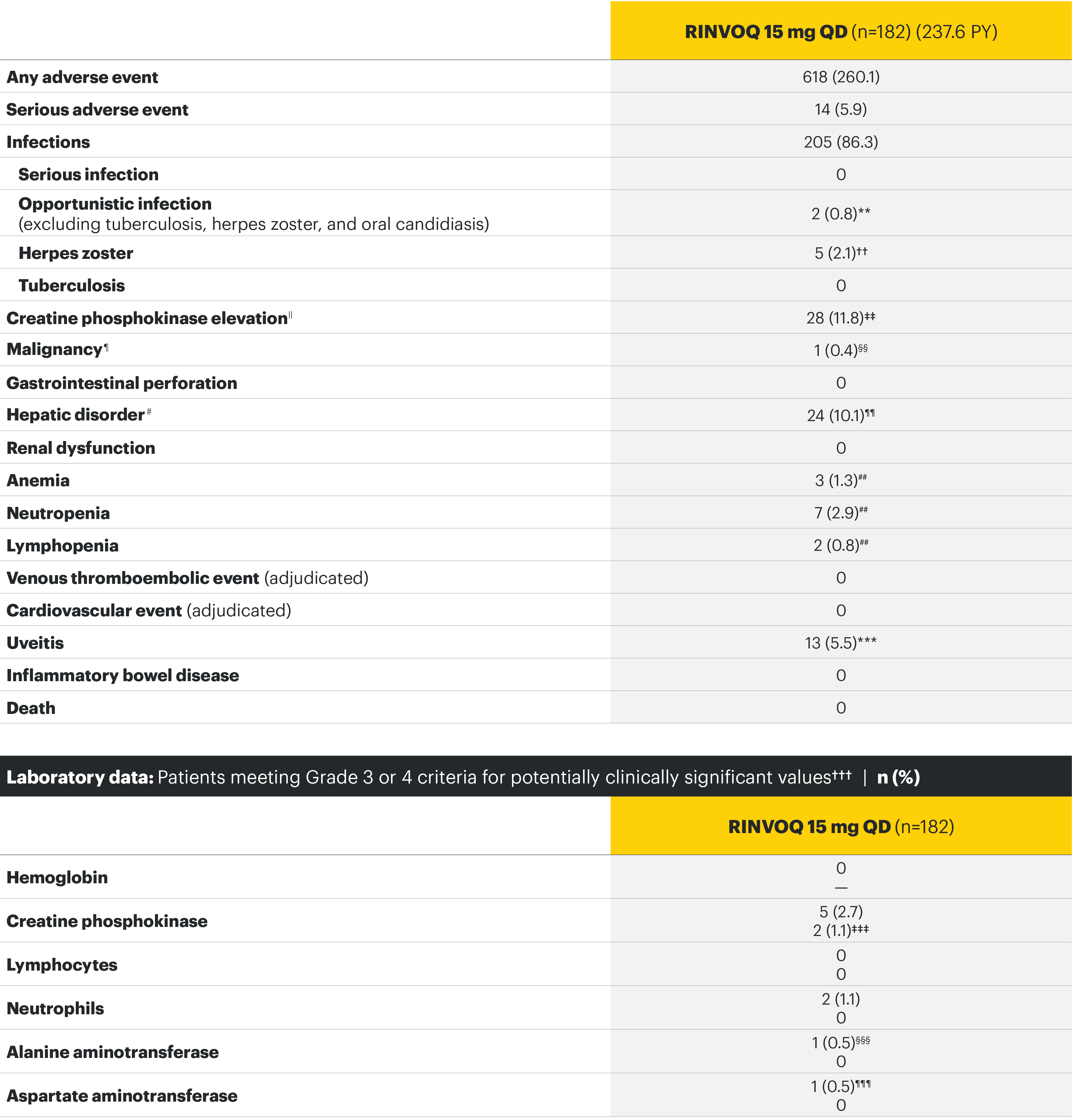
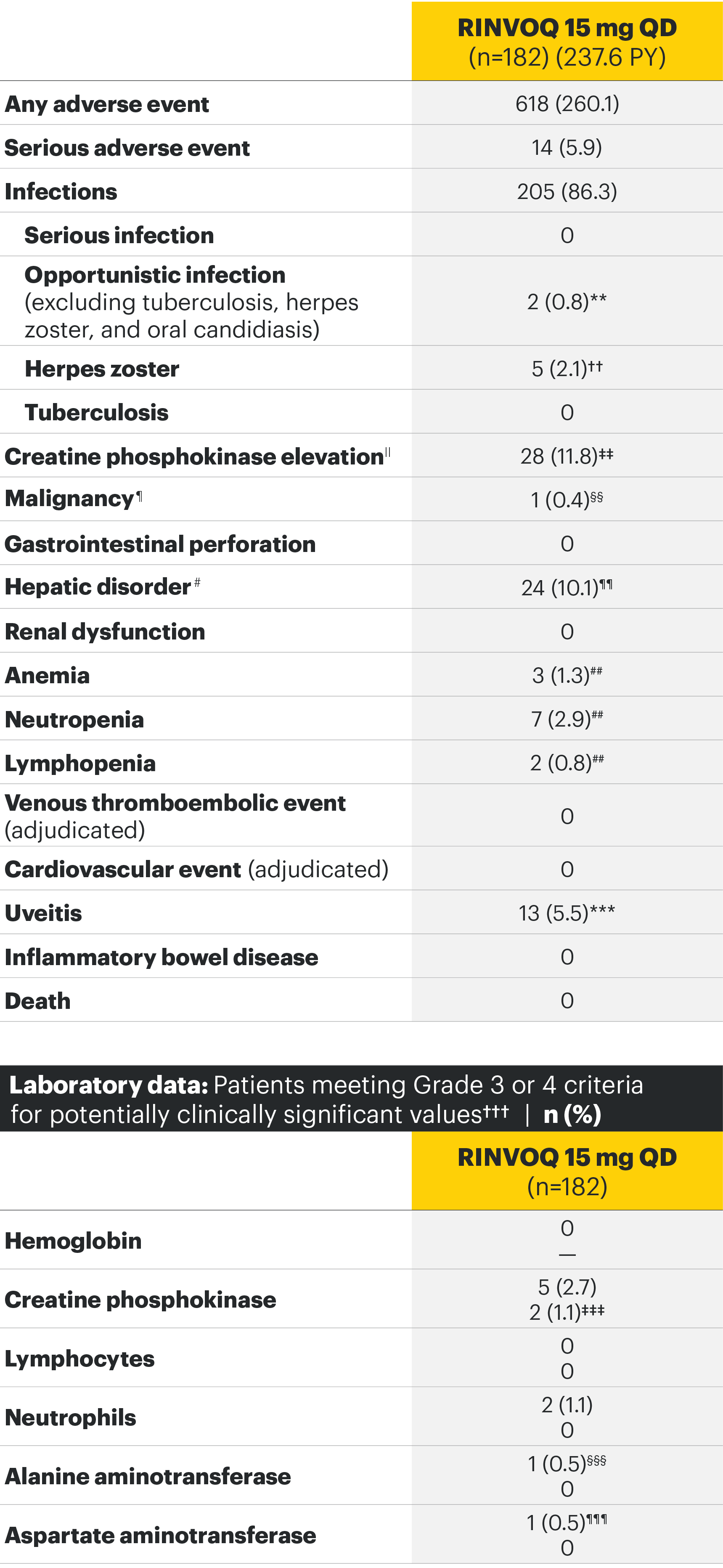
The safety profile of RINVOQ in AS was consistent with previously reported results in RA1-3
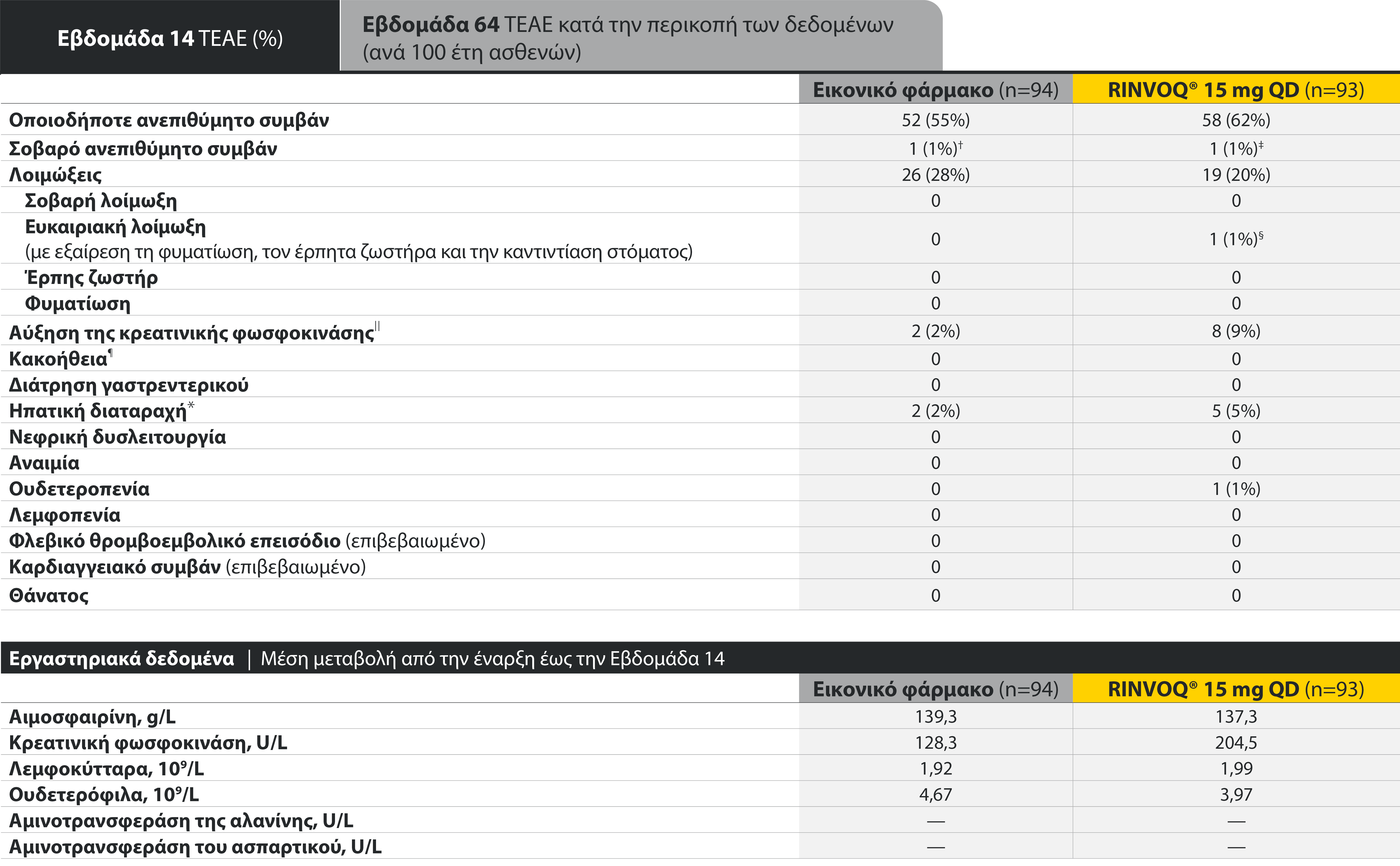
SELECT-AXIS 1: Adverse events through Week 14 and the Week 64 data cut2,3*
*ΠΕΡΙΟΡΙΣΜΟΙ ΔΕΔΟΜΕΝΩΝ: Τα δεδομένα τα οποία δεν χαρακτηρίζονταν ως πρωτεύον ή δευτερεύον ιεραρχημένο καταληκτικό σημείο ήταν προκαθορισμένα, αλλά δεν ελέγχθηκαν για πολλαπλότητα. II Αριθμητική διαφορά P≤0,001 έναντι εικονικού φαρμάκου, χωρίς έλεγχο για πολλαπλότητα.
¶ Στατιστικά σημαντική διαφορά P≤0,01 έναντι εικονικού φαρμάκου, μετά από έλεγχο για πολλαπλότητα.
* Η οσφυαλγία ορίστηκε σε κλίμακα (0–10) με βάση την εξής ερώτηση: “What is the amount of back pain that you experienced at any time during the last week?”
† Η γενικότερη εκτίμηση του ασθενούς για την ενεργότητα της νόσου του μετρήθηκε σε δεκαβάθμια κλίμακα από 0 (χωρίς ενεργότητα) έως 10 (severe activity).
‡ H μεταβολή κατά BASFI από την έναρξη έως την εβδομάδα 14 για τους ασθενείς υπό RINVOQ® έναντι εικονικού φαρμάκου ήταν δευτερεύον ιεραρχημένο καταληκτικό σημείο για την εβδομάδα 14. Η κινητικότητα μετρήθηκε με την χρήση του Bath Ankylosing Spondylitis Functional Index (BASFI), το οποίο αποτελείται από 10 ερωτήσεις που αξιολογούν την ικανότητα του ασθενούς να εκτελεί συγκεκριμένες λειτουργίες σε μια αριθμητική κλίμακα από 0 (εύκολα) έως 10 (αδύνατον).
§ Η μέτρηση της φλεγμονής προκύπτει από τον μ.ο των απαντήσεων (NRS Scores) στις 2 ερωτήσεις του BASDAI που σχετίζονται με τη πρωινή δυσκαμψία (μ.ο. των ερωτήσεων 5 και 6 του BASDAI): Ερώτηση 5: “How would you describe the overall level of morning stiffness you have had from the time you woke up?” και ερώτηση 6: “How long does your morning stiffness last from the time you wake up?”
Οι μπάρες απεικονίζουν το 95% διάστημα εμπιστοσύνης.
Η ανάλυση έγινε με τη χρήση MMRM για τα ελλιπή δεδομένα
ΣΥΝΟΨΗ ΤΟΥ ΠΡΟΦΙΛ ΑΣΦΑΛΕΙΑΣ
Στις ελεγχόμενες με εικονικό φάρμακο κλινικές δοκιμές για ρευματοειδή αρθρίτιδα, ψωριασική αρθρίτιδα και αξονική σπονδυλοαρθρίτιδα, οι συχνότερα αναφερθείσες ανεπιθύμητες ενέργειες (≥2% των ασθενών σε τουλάχιστον μία από τις ενδείξεις με το μεγαλύτερο ποσοστό μεταξύ των ενδείξεων που παρουσιάσθηκαν) με το upadacitinib 15 mg ήταν οι λοιμώξεις του ανώτερου αναπνευστικού συστήματος (19,5%), τα αυξημένα επίπεδα κρεατινικής φωσφοκινάσης αίματος (CPK) (8,6%), τα αυξημένα επίπεδα αλανινικής τρανσαμινάσης (4,3%), η βρογχίτιδα (3,9%), η ναυτία (3,5%), η ουδετεροπενία (2,8%), ο βήχας (2,2%), τα αυξημένα επίπεδα ασπαρτικής τρανσαμινάσης (2,2%) και η υπερχοληστερολαιμία (2,2%).
Στις ελεγχόμενες με εικονικό φάρμακο κλινικές δοκιμές ατοπικής δερματίτιδας, οι συχνότερα αναφερθείσες ανεπιθύμητες ενέργειες (≥2% των ασθενών) με το upadacitinib 15 mg ή 30 mg ήταν οι λοιμώξεις του ανώτερου αναπνευστικού συστήματος (25,4%), η ακμή (15,1%), ο απλός έρπης (8,4%), η κεφαλαλγία (6,3%), τα αυξημένα επίπεδα κρεατινικής φωσφοκινάσης (CPK) αίματος (5,5%), ο βήχας (3,2%), η θυλακίτιδα (3,2%), το κοιλιακό άλγος (2,9%), η ναυτία (2,7%), η ουδετεροπενία (2,3%), η πυρεξία (2,1%) και η γρίπη (2,1%).
Στις ελεγχόμενες με εικονικό φάρμακο κλινικές δοκιμές θεραπείας επαγωγής και συντήρησης για ελκώδη κολίτιδα και νόσο του Crohn, οι πιο συχνά αναφερόμενες ανεπιθύμητες ενέργειες (≥3% των ασθενών) με upadacitinib 45 mg, 30 mg ή 15 mg ήταν οι λοιμώξεις του ανώτερου αναπνευστικού συστήματος (19,9%), η πυρεξία (8,7%), τα αυξημένα επίπεδα κρεατινικής φωσφοκινάσης αίματος (CPK) (7,6%), η αναιμία (7,4%), η κεφαλαλγία (6,6%), η ακμή (6,3%), ο έρπης ζωστήρας (6,1%), η ουδετεροπενία (6,0%), το εξάνθημα (5,2%), η πνευμονία (4,1%), η υπερχοληστερολαιμία (4,0%), η βρογχίτιδα (3,9%), τα αυξημένα επίπεδα ασπαρτικής τρανσαμινάσης (3,9%), η κόπωση (3,9%), η θυλακίτιδα (3,6%), τα αυξημένα επίπεδα τρανσαμινάσης της αλανίνης (3,5%), ο απλός έρπης (3,2%) και η γρίπη (3,2%).
Οι συχνότερες σοβαρές ανεπιθύμητες ενέργειες ήταν οι σοβαρές λοιμώξεις (βλ. παράγραφο 4.4).
Το προφίλ ασφάλειας του upadacitinib υπό μακροχρόνια θεραπεία ήταν γενικά παρόμοιο με το προφίλ ασφάλειας κατά τη διάρκεια της ελεγχόμενης με εικονικό φάρμακο περιόδου σε όλες τις ενδείξεις.
- RINVOQ [Summary of Product Characteristics]. AbbVie Deutschland GmbH & Co. KG.
- van der Heijde D, Song IH, Pangan AL, et al. Efficacy and safety of upadacitinib in patients with active ankylosing spondylitis (SELECT-AXIS 1): a multicentre, randomised, double-blind, placebo-controlled, phase 2/3 trial. Lancet. 2019;394(10214):2108-2117. doi:10.1016/S0140-6736(19)32534-6
- Deodhar A, van der Heijde D, Sieper J, et al. Upadacitinib in active ankylosing spondylitis: 1-year results from the double-blind, placebo-controlled SELECT-AXIS 1 study and open-label extension [published online July 1, 2021]. Arthritis Rheumatol. doi:10.1002/art.41911
- Assessment of SpondyloArthritis international Society (ASAS). ASDAS calculator. https://www.asas-group.org/clinical-instruments/asdas-calculator. Accessed July 12, 2021.
- A study evaluating the safety and efficacy of upadacitinib in adults with active ankylosing spondylitis (SELECT-AXIS 1). ClinicalTrials.gov identifier: NCT03178487. https://clinicaltrials.gov/ct2/show/NCT03178487. Accessed July 13, 2021.