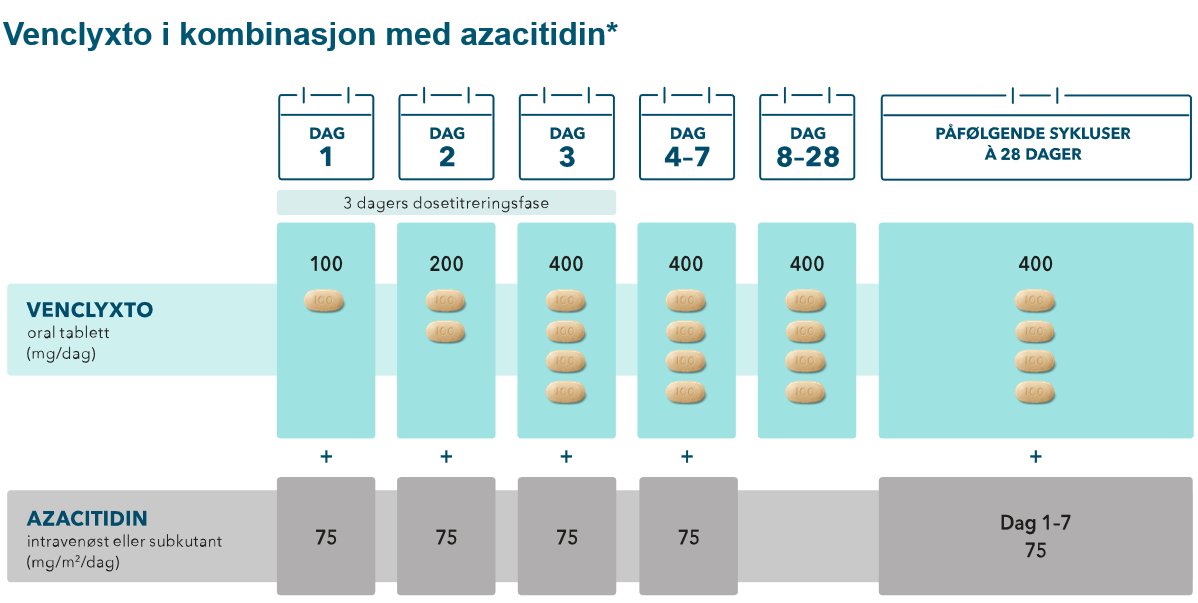
Anbefalt dosering ved behandling av AML1
Etter fullført dosetitrering er anbefalt dose av VENCLYXTO 400 mg én gang daglig. Behandling med VENCLYXTO, i kombinasjon med et hypometylerende legemiddel, bør fortsette inntil sykdomsprogresjon eller uakseptabel toksisitet er observert.
*også godkjent i kombinasjon med decitabin, for mer informasjon se preparatomtalen.
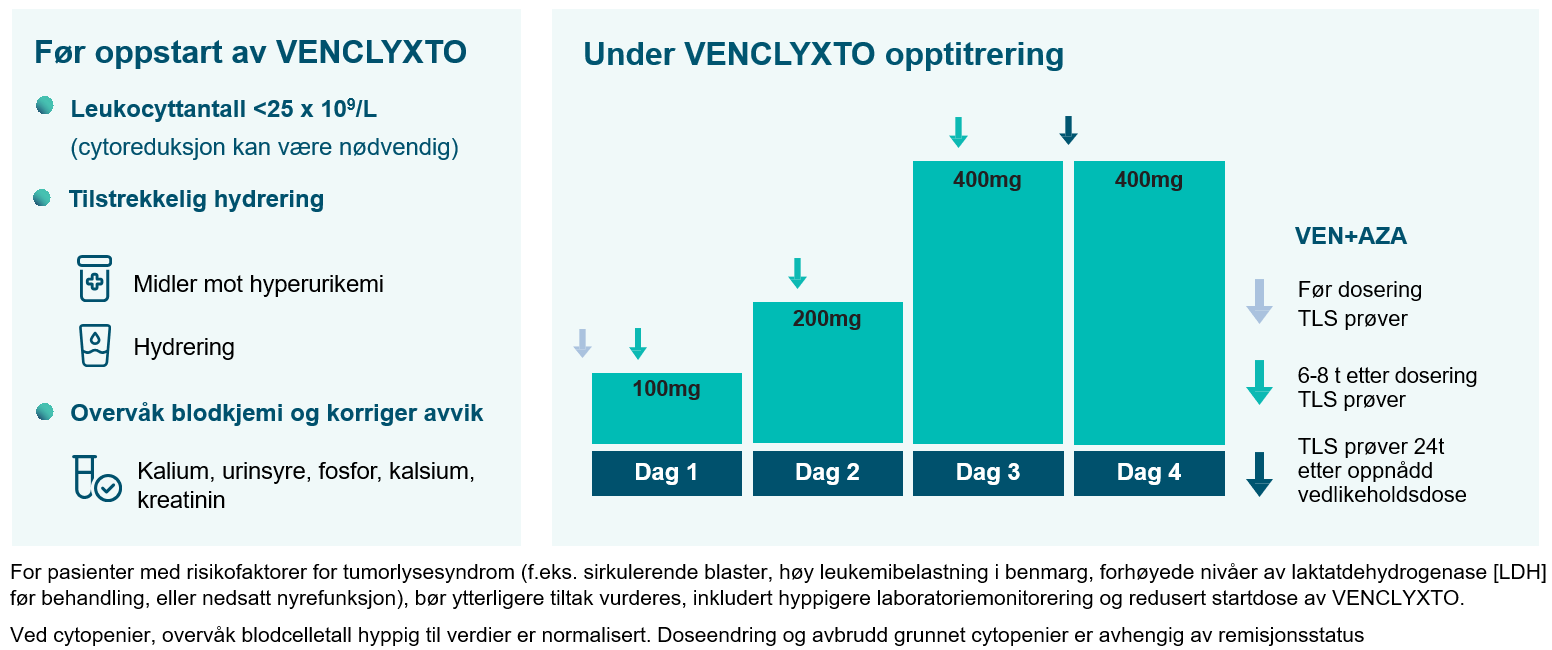
Hvilke forebyggende tiltak bør følges?
*Oral tablet.
†Administer intravenously. Dose may be split as 100 mg and 900 mg on Days 1 and 2 of Cycle 1, respectively. Graphic not to scale. Each cycle is 28 days.
Referanse: 1. VENCLYXTO SPC, avsnitt 4:2, datert 24.07.2025
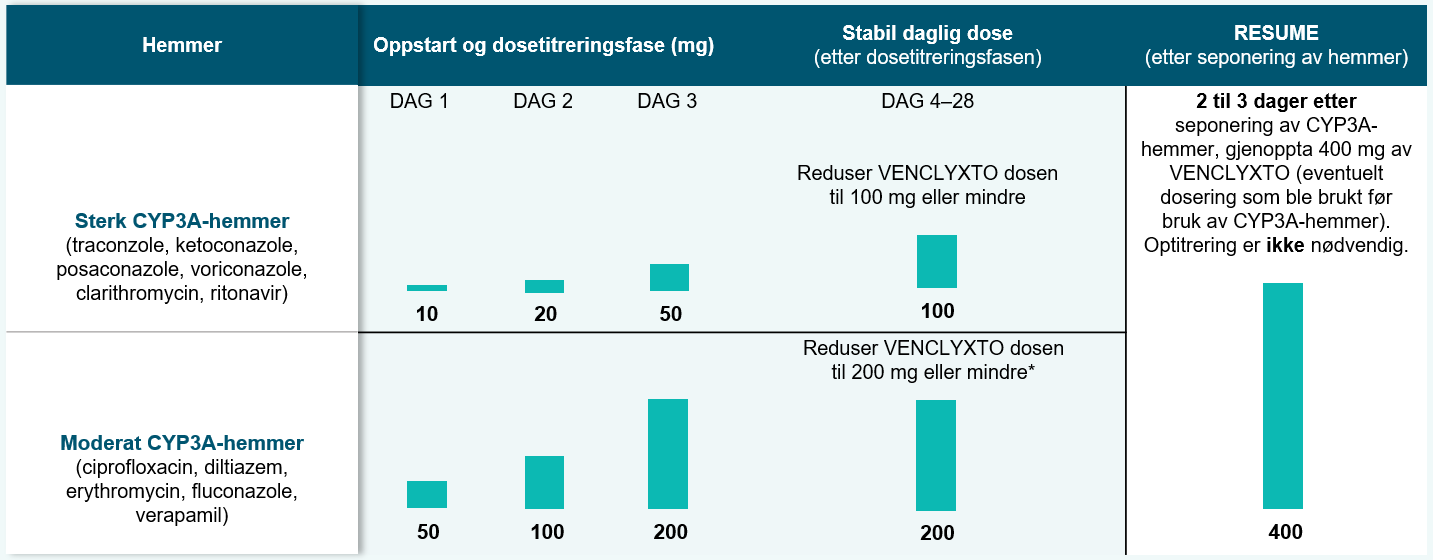
Dosejustering ved samtidig bruk av CYP3A-hemmere 1
Anbefalte doseendringer for hematologiske bivirkninger på AML1

Anbefalte doseendringer ved ikke-hematologiske bivirkninger på AML1

Referanse: 1. VENCLYXTO SPC avsnitt 4.2, datert 24.07.2025, 2. DiNardo CD, Jonas BA, Pullarkat V et al. Azacitidine and Venetoclax in Previously Untreated Acute Myeloid Leukemia N Engl J Med. 2020;383(7):617-629.
Ønsker du å holde deg oppdatert om nyheter og invitasjoner fra AbbVie Hematology?
Vil du vite mer om Venclyxto?
Utvalgt produkt- og sikkerhetsinformasjon for Venclyxto (venetoklaks)
Indikasjon: Venetoklaks i kombinasjon med et hypometylerende legemiddel (HMA) er indisert til behandling av voksne pasienter med nylig diagnostisert akutt myelogen leukemi (AML) som er uegnet for intensiv kjemoterapi.
Dosering: Dosen økes gradvis over 3 dager til en daglig dose på 400 mg (dag 1: 100 mg, dag 2: 200 mg, dag 3: 400 mg). Deretter 400 mg daglig i påfølgende sykluser à 28 dager. For mer informasjon om dosering og kombinasjon med HMA, se pkt. 4.2 i preparatomtalen.
Kontraindikasjoner: Samtidig bruk av preparater som inneholder johannesurt.
Interaksjoner: Samtidig bruk av sterke eller moderate CYP3A-hemmere øker eksponeringen av venetoklaks. Dosejustering er nødvendig, se preparatomtalen.
Tumorlysesyndrom: Det er risiko for tumorlysesyndrom ved oppstart og under dosetitreringsfasen. For informasjon om profylakse og monitorering, se preparatomtalen.
Nøytropeni: Hos pasienter med AML er grad 3 eller 4 nøytropeni vanlig før oppstart av behandling. Antall nøytrofiler kan forverres ved bruk av venetoklaks i kombinasjon med et hypometylerende legemiddel og nøytropeni kan oppstå på nytt i påfølgende behandlingssykluser. Fullstendig blodtelling bør utføres gjennom hele behandlingsperioden.
Infeksjoner: Alvorlige infeksjoner, inkl. sepsis med dødelig utfall, er rapportert. Nøye overvåking kreves.
Vanligste bivirkninger (≥ 20 %): Trombocytopeni, nøytropeni, febril nøytropeni, kvalme, diaré, oppkast, anemi, fatigue, pneumoni, hypokalemi og nedsatt appetitt (venetoklaks i kombinasjon med azacitidin).
Pris og refusjon: Venetoklaks forskrives på H-resept. Det er inngått en prisavtale med Sykehusinnkjøp HF. Venetoklaks er besluttet innført i kombinasjon med et hypometylerende legemiddel (HMA) til behandling av voksne pasienter med nydiagnostisert akutt myelogen leukemi (AML) som er uegnet for intensiv kjemoterapi (Onkologi-anbefalingene Sykehusinnkjøp HF).
Pakninger og listepriser: 10 mg: 14 stk. kr 919,60; 50 mg: 7 stk. kr 2269,50; 100 mg: 7 stk. kr 4517,50; 14 stk. kr 8998,70; 112 stk. kr 69687,10. Reseptgruppe C.
For utfyllende informasjon indikasjoner, dosering, kontraindikasjoner, interaksjoner, forsiktighetsregler, bivirkninger, pris og refusjon se Felleskatalogen.
Referanse: Venclyxto SPC datert 24.07.2025, avsnitt 4.1, 4.2, 4.3, 4.4, 4.5 og 4.8.
NO-VNCAML-230011 version 5.0 Okt 2025