Note to affiliates: This update to the venetoclax CLL AbbVie Pro site includes a homepage headline, updated CLL14 6-year, CLL13 4-year, MURANO 7-year data sets, and other streamlined content updates. CLL 13 4-year update reflects the CLL13 data from the Lancet Oncology publication. The CLL14 6-year and MURANO 7-year data have been updated based on the EHA 2023 abstracts. For countries that cannot use these data sets, please follow local regulations and MRLO guidance, and revert to CLL14 5-year and MURANO 5-year published data from the product label.
Primary analysis in ITT population for VEN+O vs O+Clb1:
INV-assessed PFS†: Reduced risk of progression or death (HR=0.35; 95% CI: 0.23–0.53 [P<0.0001]).
| • | Median follow-up of 28 months |
Additional analyses:
6-year PFS estimate (INV-assessed)2‡: 53% vs 22% (HR=0.40; 95% CI: 0.31–0.52) after 5 years off treatment.
| • | Median PFS of 76.2 months with VEN+O vs 36.4 months with O+Clb |
INV-assessed complete remission (CR/CRi)1: 50% vs 23% (P<0.0001).
| • | ORR: 85% (95% CI: 79.2–89.2) vs 71% (95% CI: 64.8–77.2 [P=0.0007]) |
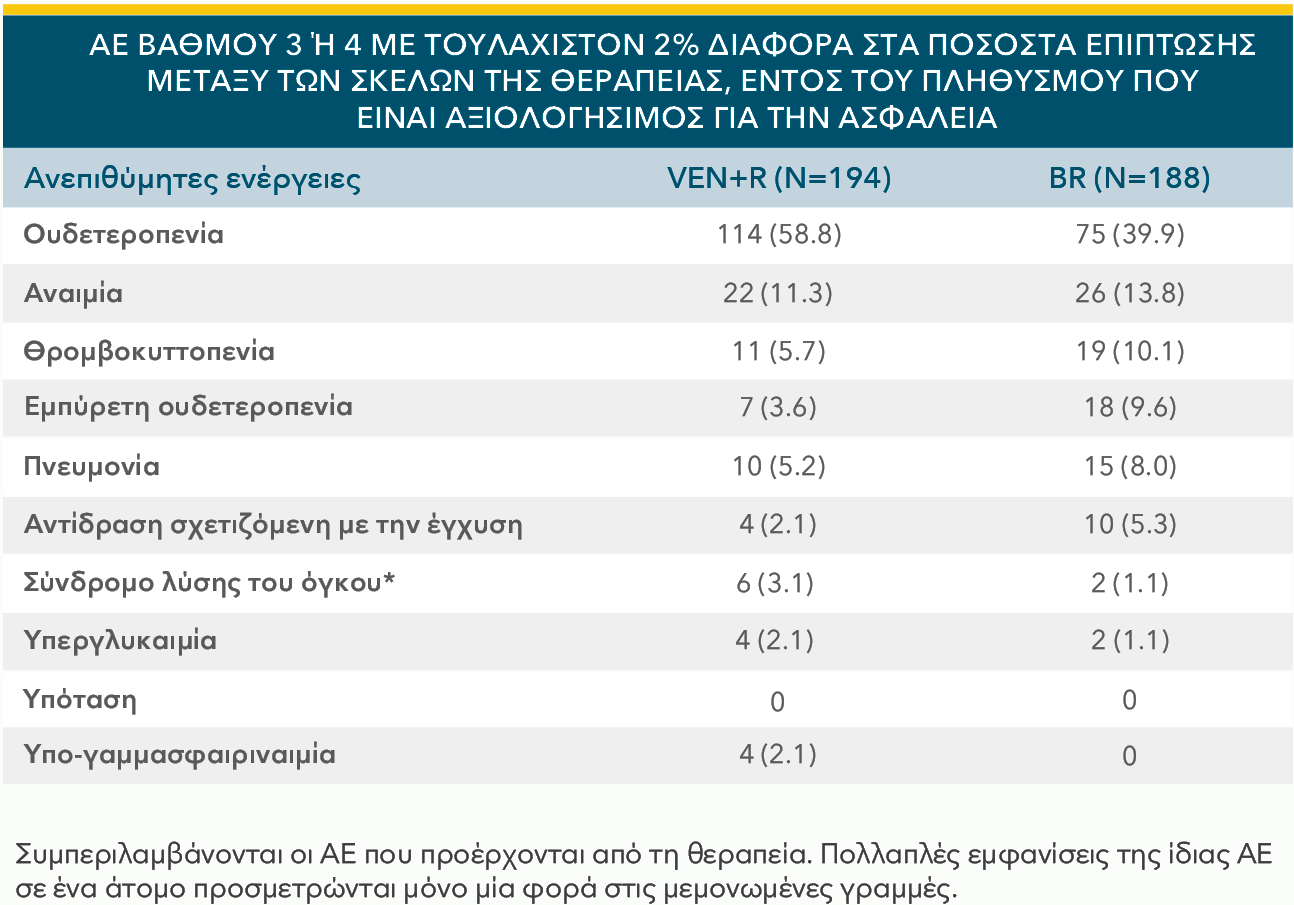
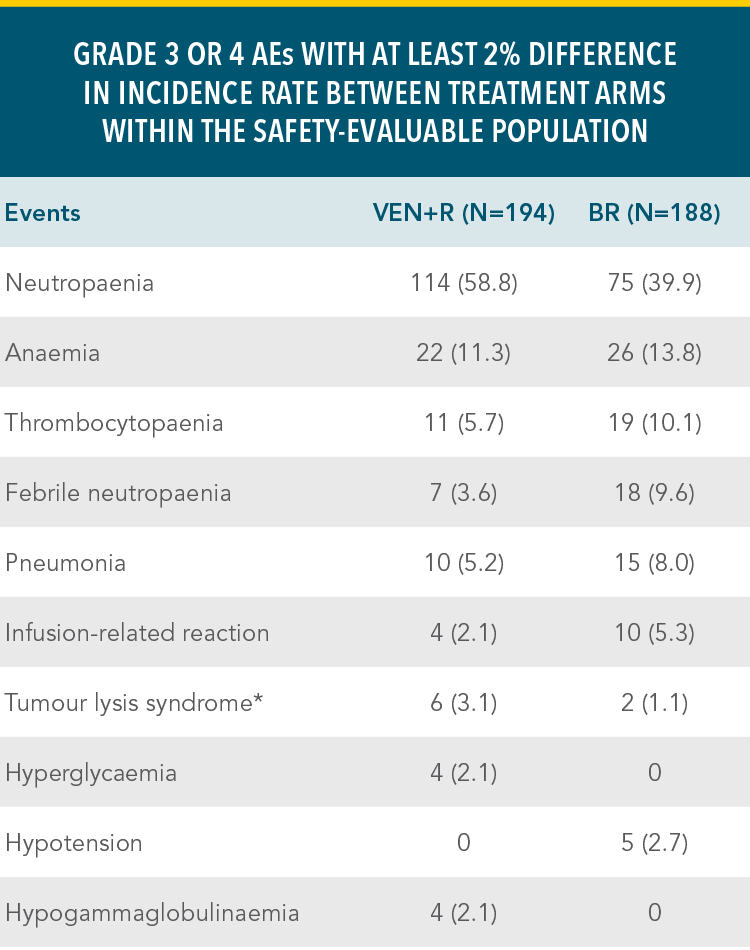
Primary analysis in ITT population for VEN+R vs BR1:
INV-assessed PFS†: Reduced risk of progression or death (HR=0.17; 95% CI: 0.11–0.25 [P<0.0001]).
| • | Median follow-up of 23.8 months |
Additional analyses:
7-year PFS estimate (INV-assessed)3‡: 23% (HR=0.23; 95% CI: 0.18–0.29) vs NE after ~5 years off treatment.
| • | Median PFS of 54.7 months with VEN+R (95% CI: 52.3–59.9) vs 17.0 months with BR (95% CI: 15.5–21.7) |
INV-assessed complete remission (CR/CRi)1‡: 27% vs 8%.
| • | ORR: 93% (95% CI: 88.8–96.4) vs 68% (95% CI: 60.6–74.2) |
*See full dosing information for VEN+O and for VEN+R in the dosing and administration section.
†Primary endpoint.
‡Results are descriptive only.
1L=first line; CLL=chronic lymphocytic leukaemia; VEN+O=VENCLYXTO + obinutuzumab; ITT=intent to treat; O+Clb=obinutuzumab + chlorambucil; INV=investigator; PFS=progression-free survival; HR=hazard ratio; CI=confidence interval; CR=complete remission; CRi=complete remission with incomplete bone marrow recovery; ORR=overall response rate; 2L+=second line + later lines of therapy; VEN+R=VENCLYXTO + rituximab; BR=bendamustine + rituximab; NE=not evaluable.
ΤΑ ΔΟΣΟΛΟΓΙΚΑ ΣΧΗΜΑΤΑ ΠΟΥ ΒΑΣΙΖΟΝΤΑΙ ΣΤΟ VENCLYXTO® ΕΧΟΥΝ ΕΝΑ ΚΑΘΙΕΡΩΜΕΝΟ ΚΑΙ ΔΙΑΧΕΙΡΙΣΙΜΟ ΠΡΟΦΙΛ ΑΣΦΑΛΕΙΑΣ ΣΤΙΣ ΜΕΛΕΤΕΣ ΤΗΣ CLL1
| • | Οι πιο συχνά αναφερόμενες σοβαρές ανεπιθύμητες ενέργειες (≥2%) σε ασθενείς που λαμβάνουν το VENCLYXTO® σε συνδυασμό με obinutuzumab ή rituximab, ήταν η πνευμονία, σηψαιμία, εμπύρετη ουδετεροπενία και το TLS |
| • | Οι πιο συχνά εμφανιζόμενες ανεπιθύμητες ενέργειες (≥20%) οποιουδήποτε βαθμού, σε ασθενείς που λαμβάνουν το VENCLYXTO® στις μελέτες συνδυασμού με obinutuzumab ή rituximab, ήταν η ουδετεροπενία, διάρροια και λοιμώξεις του ανώτερου αναπνευστικού συστήματος |
| ▼ | Το φάρμακο αυτό τελεί υπό συμπληρωματική παρακολούθηση. Αυτο θα επιτρέψει το γρήγορο προσδιορισμό νέων πληροφοριών ασφαλείας. Ζητείτα από τους επαγγελματίες υγείας να αναφέρουν οποιεσδήποτε ύποπτες ανεπιθύμητες ενέργειες. |
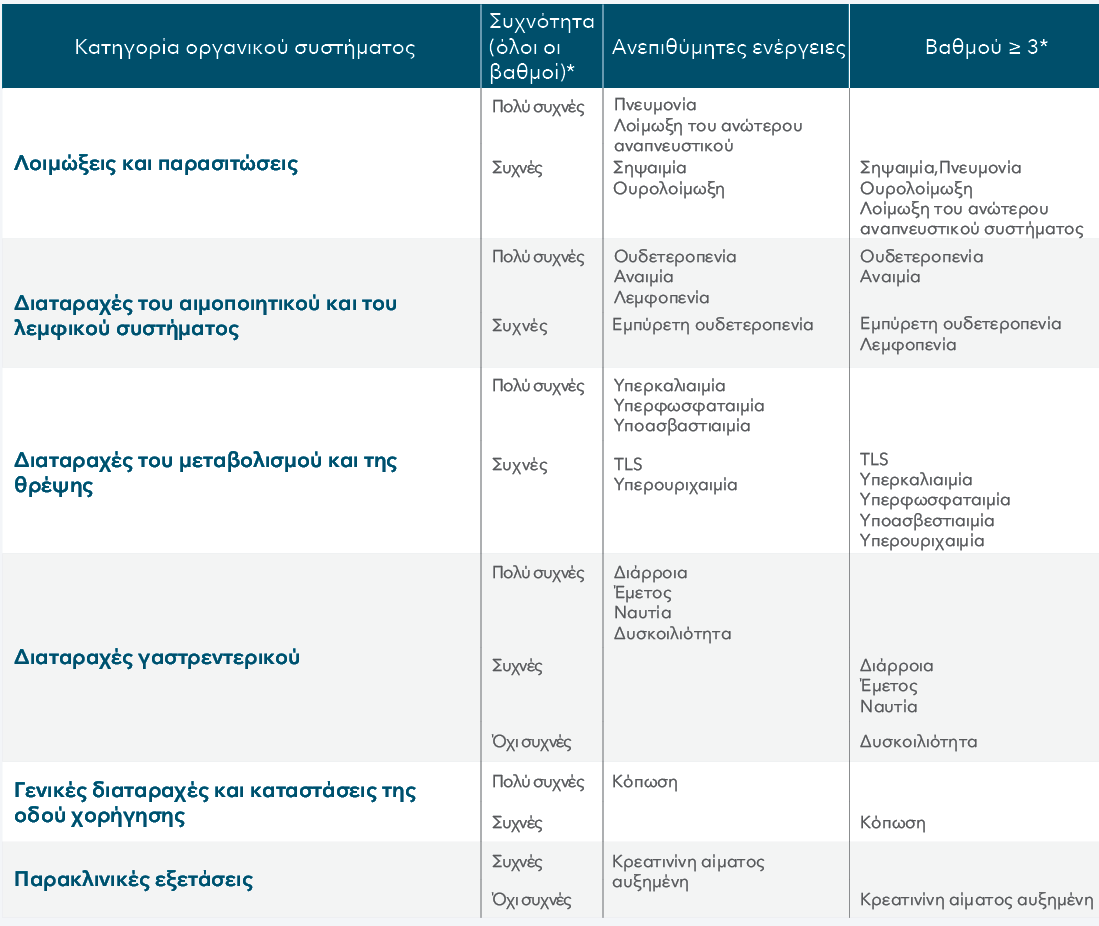
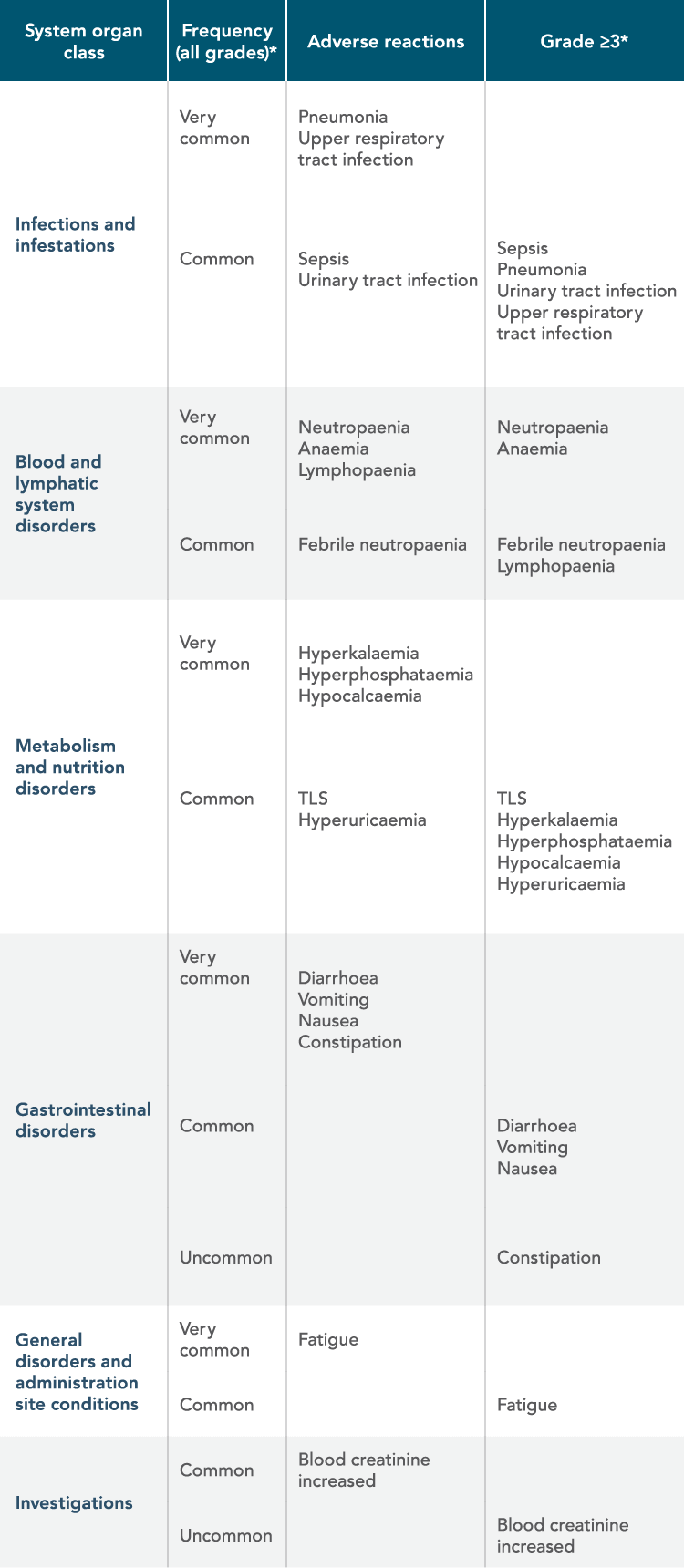
ΑΝΕΠΙΘΥΜΗΤΕΣ ΕΝΕΡΓΕΙΕΣ ΣΥΜΦΩΝΑ ΜΕ ΤΗΝ ΚΑΤΗΓΟΡΙΑ ΟΡΓΑΝΙΚΟΥ ΣΥΣΤΗΜΑΤΟΣ ΚΑΤΑ MedDRA ΚΑΙ ΑΝΑΛΟΓΑ ΜΕ ΤΗ ΣΥΧΝΟΤΗΤΑ
*Μόνο η υψηλότερη συχνότητα που παρατηρείται στις μελέτες αναφέρεται (με βάση τις μελέτες CLL14, MURANO, M13-982, M14- 032 και M12-175).
MedDRA (Medical Dictionary for Regulatory Activities): Λεξικό με τυποποιημένη ιατρική ορολογία για να διευκολύνει την κοινή χρήση των κανονιστικών πληροφοριών σε διεθνές επίπεδο
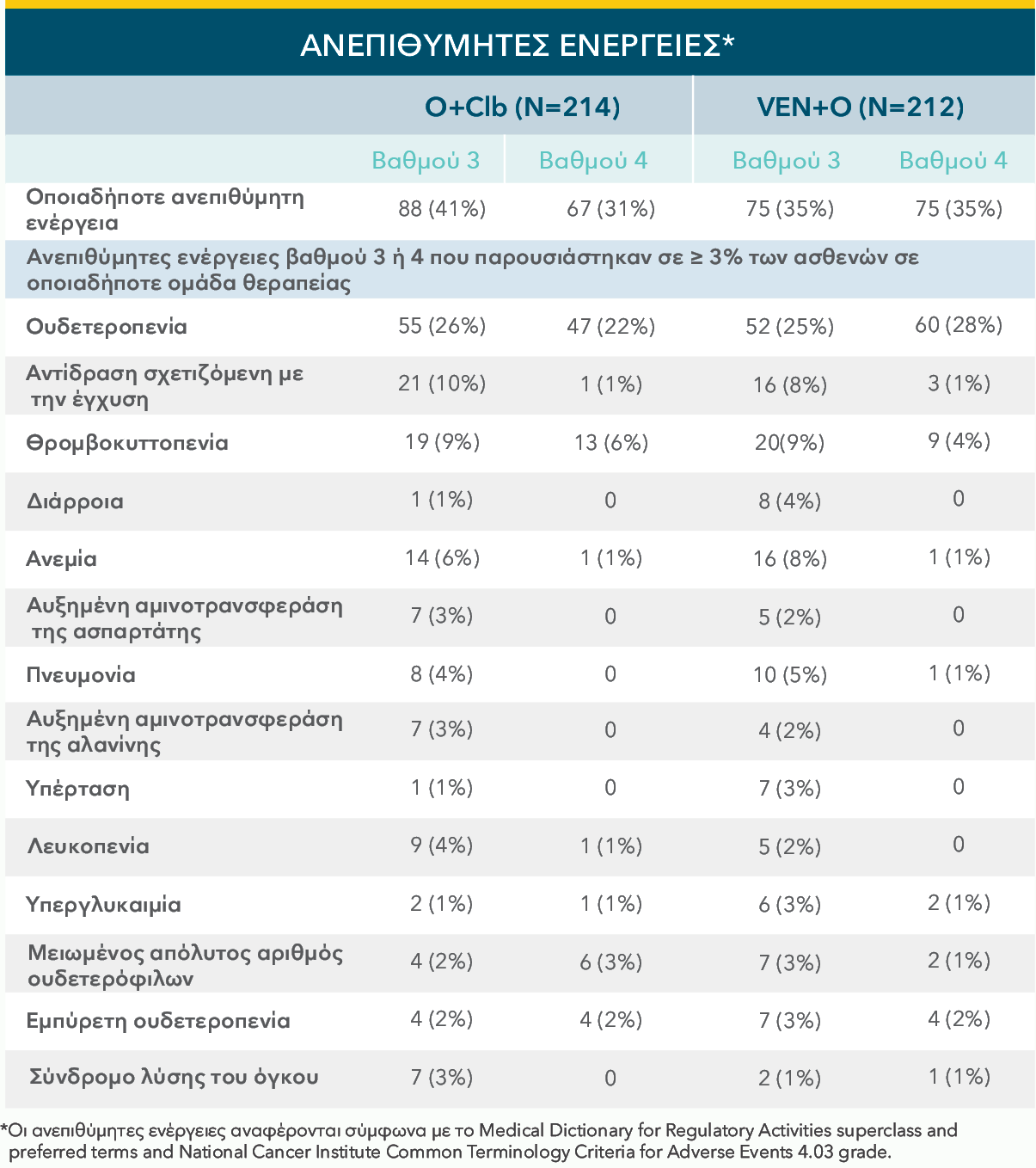
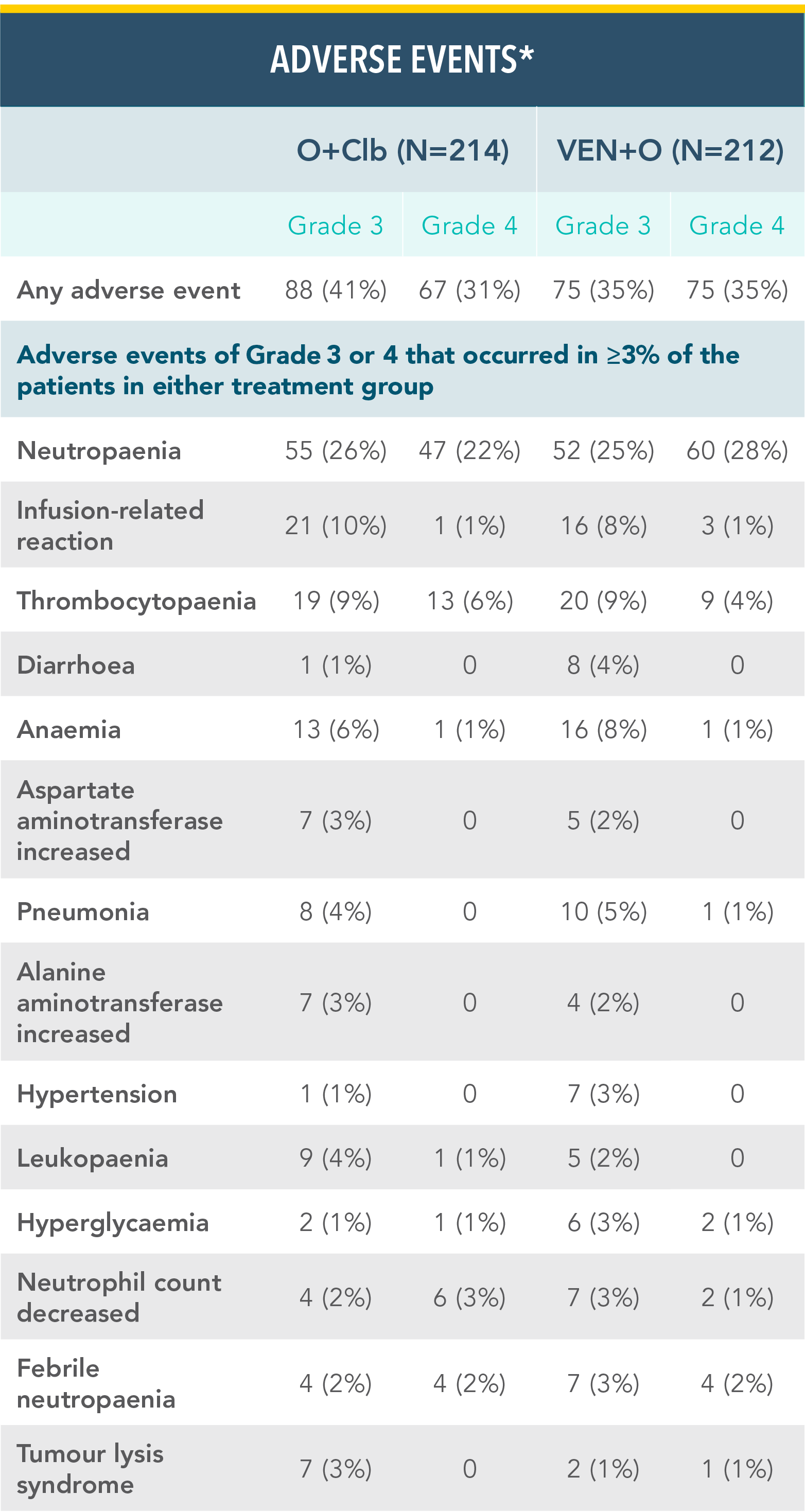
Ο ΣΥΝΔΥΑΣΜΟΣ VENCLYXTO® + OBINUTUZUMAB ΕΔΕΙΞΕ ΕΝΑ ΔΙΑΧΕΙΡΙΣΙΜΟ ΠΡΟΦΙΛ ΑΣΦΑΛΕΙΑΣ ΣΤΗ ΜΕΛΕΤΗ CLL14 ΜΕ 1 ΕΤΟΣ ΘΕΡΑΠΕΙΑΣ18‡
Ανεπιθύμητες ενέργειες Βαθμού 3 ή 4 στα σκέλη θεραπείας VEN+O και O+Clb‡
| • | Η διάρκεια της θεραπείας ήταν μεγαλύτερη στο σκέλος του VEN+R από ό,τι στο σκέλος BR1 |
*Εργαστηριακά επιβεβαιωμένο TLS.
Παραπομπή από: Kater AP, Wu JQ, Kipps T, et al. J Clin Oncol. 2020;38(34):4042-4054(suppl appendix).
Με ενδιαφέρει η βελτιωμένη
πρόγνωση ασθενών
Με ενδιαφέρει να προσφέρω
θεραπείες πεπερασμένης διάρκειας
ΠΑΡΑΠΟΜΠΕΣ: 1. VENCLYXTO® Περίληψη Χαρακτηριστικών του Προϊόντος (ΠΧΠ), Αύγουστος 2023.