Επειδή η φάση «ON» είναι η δική τους ώρα
Το Duodopa® είναι μια τεχνολογικά υποβοηθούμενη θεραπεία για την προχωρημένη νόσο Πάρκινσον:
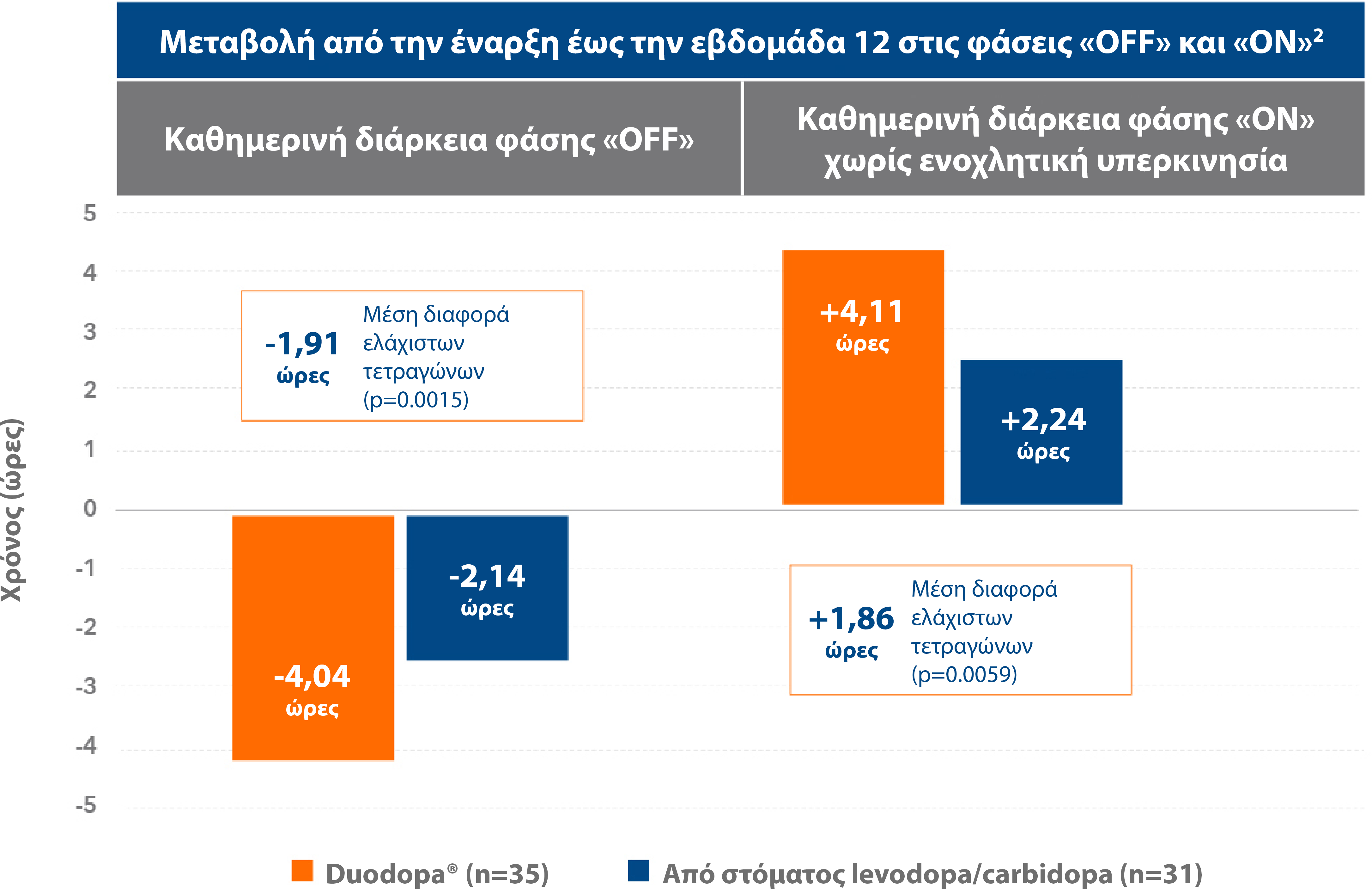
Βελτίωση των φάσεων «OFF» και «ON» χωρίς ενοχλητική υπερκινησία2
Το Duodopa® προσφέρει περίπου 4 ώρες περισσότερες στη φάση «ON» χωρίς ενοχλητική υπερκινησία και περίπου 4 ώρες λιγότερες στη φάση «OFF».2
Προσαρμογή από: Olanow CW et al. Lancet Neurol 2014;13(2):141 -149.2
Οι περισσότερες ανεπιθύμητες ενέργειες συνδέονταν με τη διαδικασία τοποθέτησης της αντλίας ή την συσκευή, οι οποίες ήταν ήπιες έως μέτριας σοβαρότητας. Παρατηρήθηκαν σχεδόν αποκλειστικά μέσα στην πρώτη εβδομάδα και απέδραμαν σε όλες τις περιπτώσεις.2
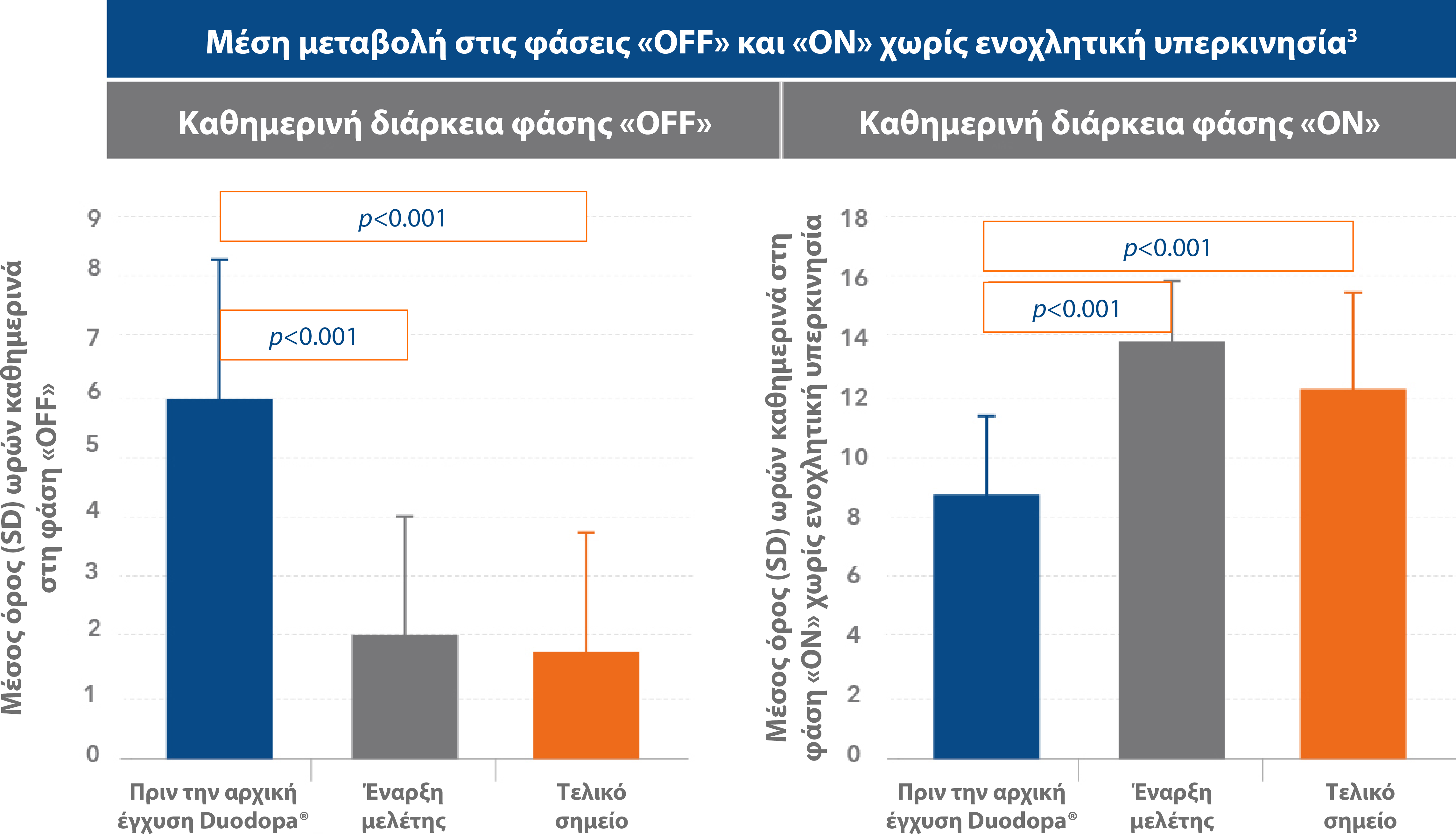
Διατήρηση της βελτίωσης στις φάσεις «OFF» και «ON» χωρίς ενοχλητική υπερκινησία3
Η μείωση του χρόνου «OFF» και η αύξηση του χρόνου «ON» με το Duodopa® διατηρήθηκε για κατα μέσο όρο 4 έτη.3
Προσαρμογή από: Fernandez HH et al. Mov Disord 2018; 33(6):928-936.3
Οι περισσότερες ανεπιθύμητες ενέργειες οφείλονταν στη διαδικασία τοποθέτησης της αντλίας ή τη συσκευή.3
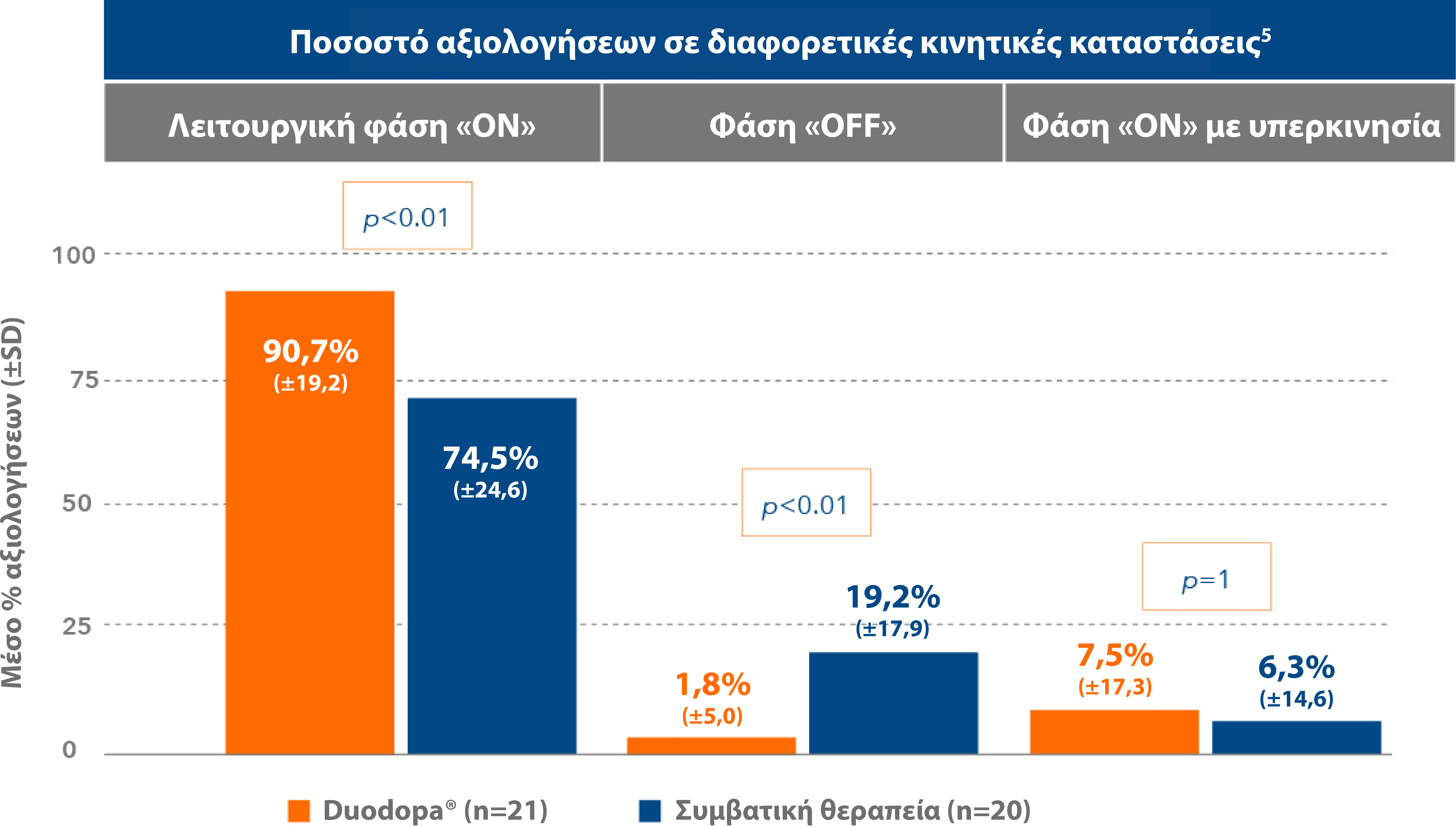
Οι ασθενείς βρίσκονται σε φάση «ON» για το μεγαλύτερο διάστημα της ημέρας5
Οι ασθενείς που έλαβαν Duodopa® για 3 εβδομάδες, πέρασαν σε φάση «ON» το 90% των ωρών κατά τις οποίες είναι ξύπνιοι στη διάρκεια της ημέρας.5
Προσαρμογή από: Nyholm D et al. Neurology 2005; 64(2):216-223.5
Aνεπιθύμητες ενέργειες παρατηρήθηκαν σε 16 ασθενείς με τη συμβατική θεραπεία και σε 17 ασθενείς με τη θεραπεία έγχυσης, οι οποίες ήταν κυρίως ήπιες. Συνολικά, παρατηρήθηκαν 3 σοβαρές ανεπιθύμητες ενέργειες.5
Προσαρμογή από: Lopiano L et al. J Neurol 2019; 266:2164-2176.4
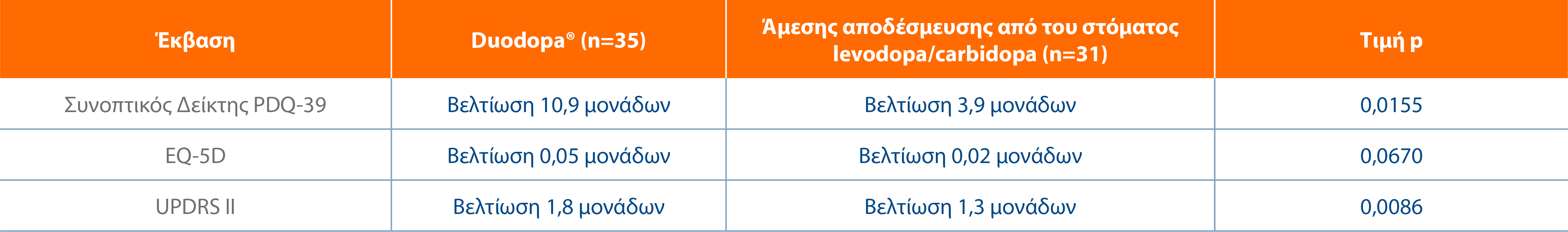
Το Duodopa® έδειξε στατιστικά σημαντικά αποτελέσματα στην ποιότητα ζωής και στις δραστηριότητες της καθημερινής ζωής1,2,6
Βελτιώσεις στην ποιότητα ζωής μετά τις 12 εβδομάδες θεραπείας με Duodopa®2
Προσαρμογή από: Kruger R et al. Adv Ther 2017; 34(7):1741-1752.6
Προσαρμογή από: Kruger R et al. Adv Ther 2017; 34(7):1741-1752.6
Το ένα τρίτο των ασθενών (32,8%) παρουσίασε μια ανεπιθύμητη ενέργεια, ενώ ποσοστό 21,9% παρουσίασαν μια σοβαρή ανεπιθύμητη ενέργεια. Ποσοστό 11,1% διέκοψε τη θεραπεία λόγω ανεπιθύμητης ενέργειας, Ποσοστό 12,7% παρουσίασε ΑΕ πιθανώς σχετιζόμενη με την εντερική γέλη levodopa/ carbidopa (LCIG) και ποσοστό 3,1% πέθαναν στη διάρκεια της μελέτης (καρδιακή ανεπάρκεια και αιφνίδιος θάνατος) 6
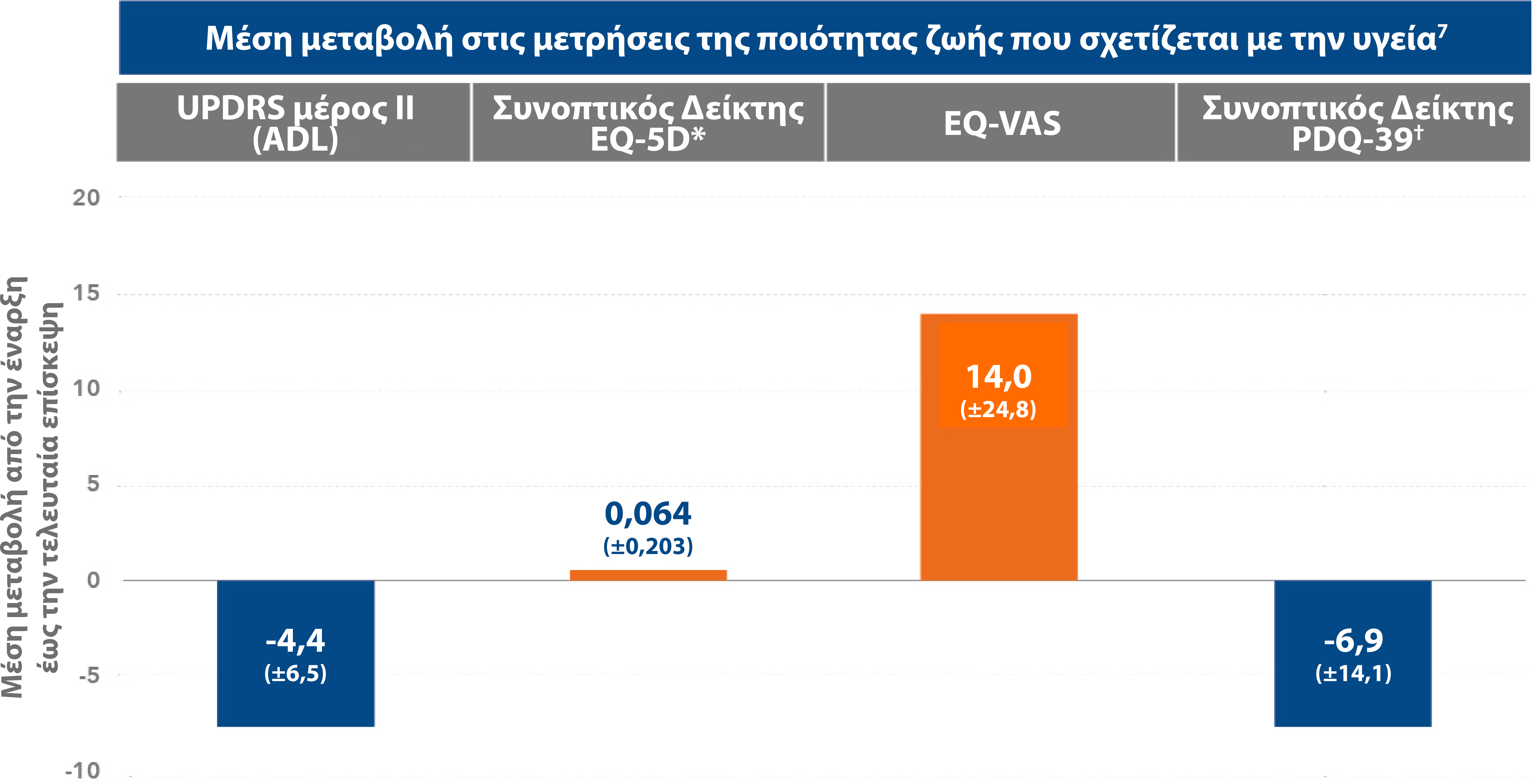
Προσαρμογή από: Fernandez HH et al. Mv Disord 2015;30(4):500-9.7
* Στην κεντρική μελέτη, ο Συνοπτικός Δείκτης EQ-5D δεν πέτυχε στατιστική σημαντικότητα με βάση την ιεραρχική διαδικασία δοκιμών.1
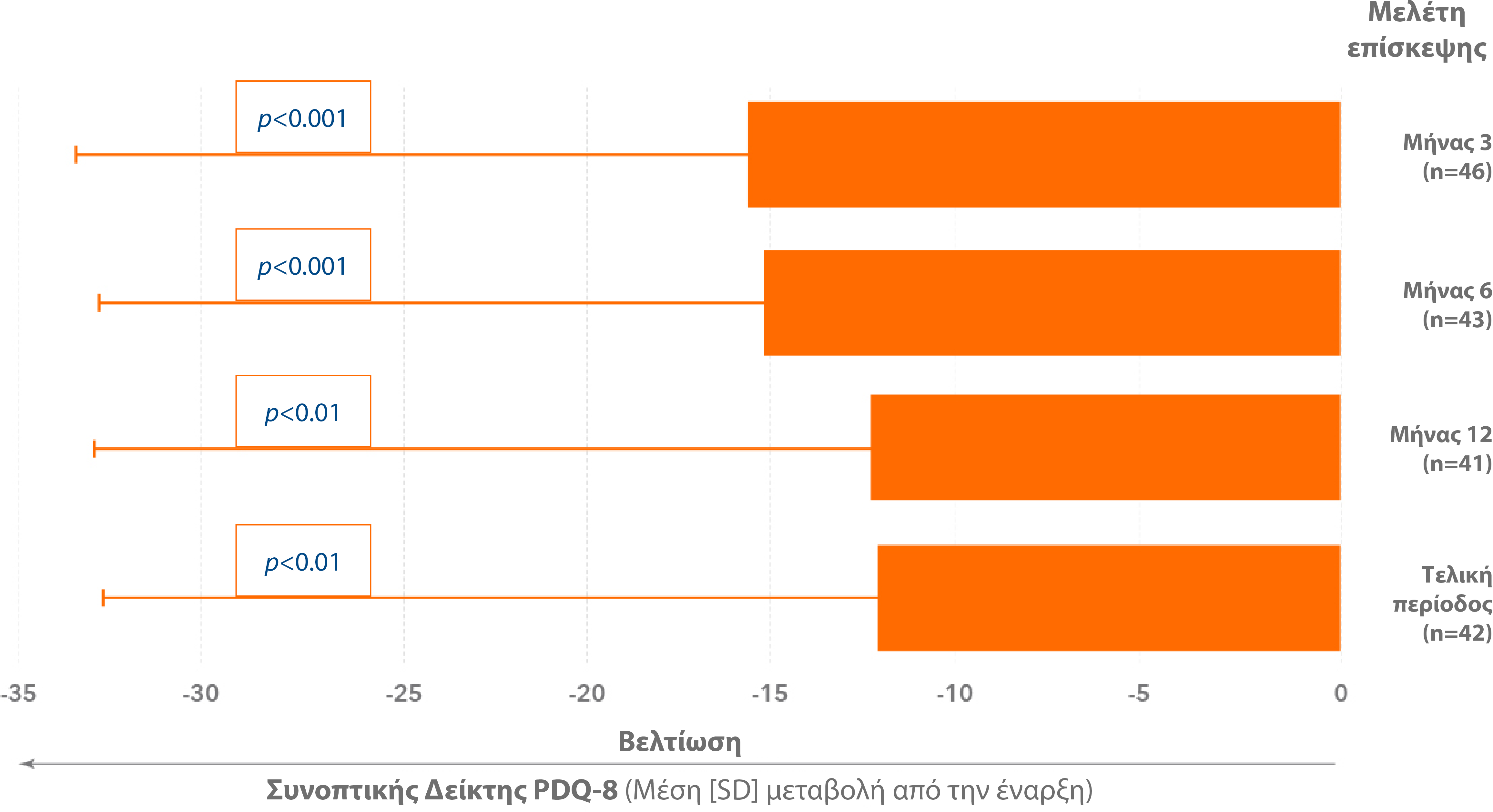
† Από τον διαγνωστικό έλεγχο έως την τελευταία επίσκεψη. Οι 7 από τους 8 τομείς του PDQ-39 (εκτός της κοινωνικής υποστήριξης) έδειξαν στατιστικά σημαντική μέση βελτίωση.7
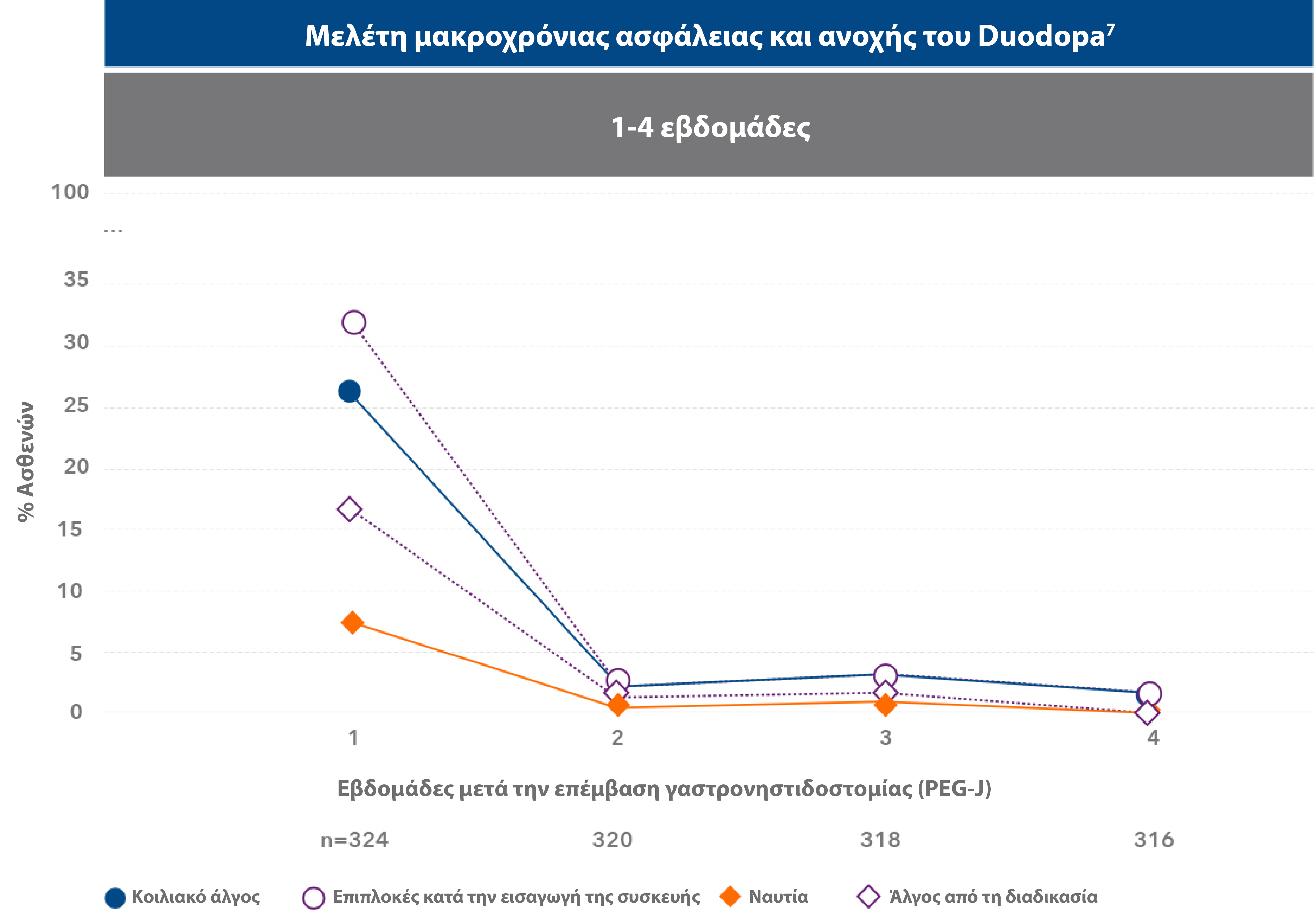
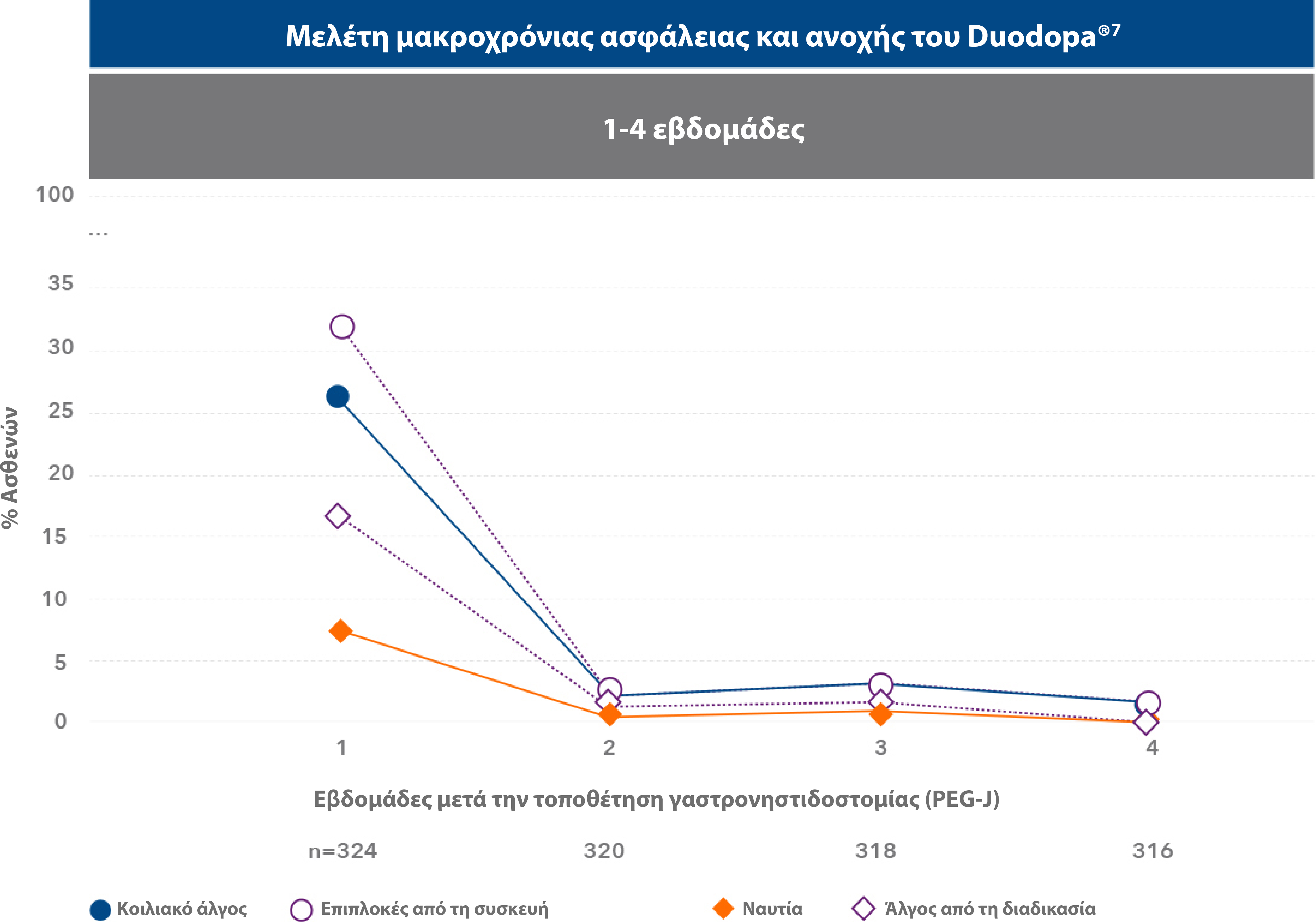
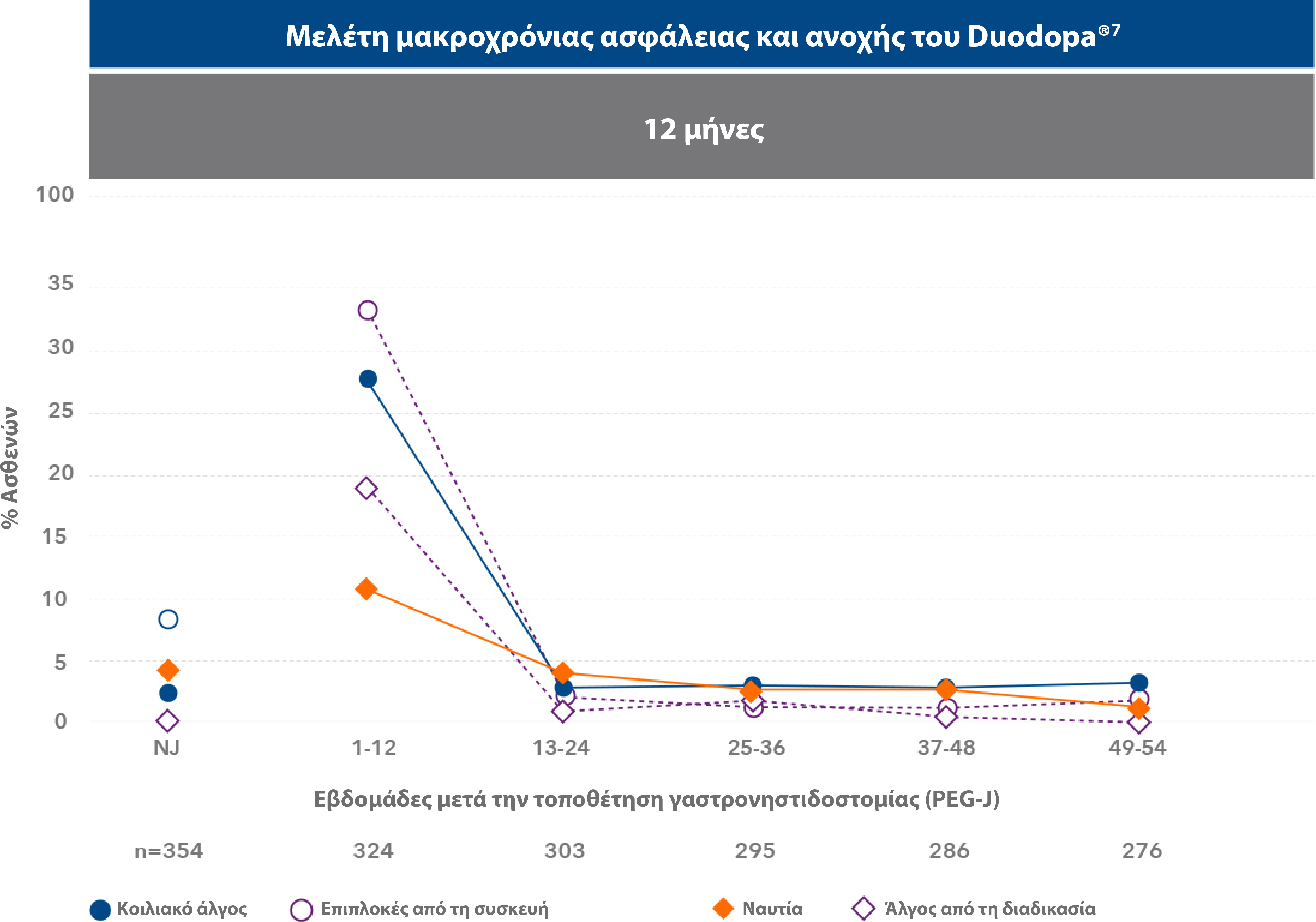
Οι πιο συχνές ανεπιθύμητες ενέργειες που παρατηρήθηκαν στη μελέτη ήταν επιπλοκές κατά την εισαγωγή της συσκευής, κοιλιακό άλγος και άλγος κατά τη χειρουργική επέμβαση.7
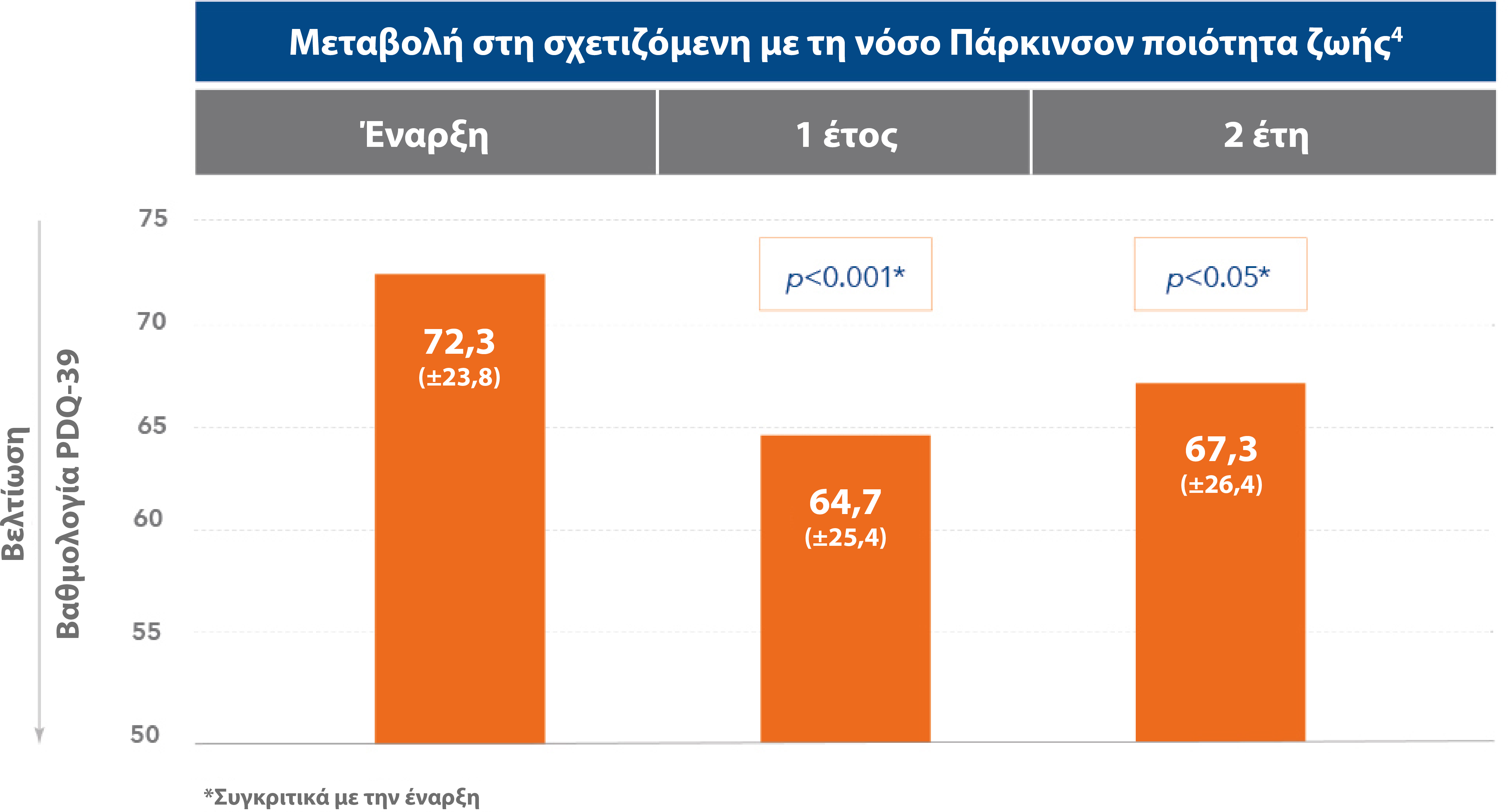
Διατήρηση της βελτίωσης στην ποιότητα ζωής των ασθενών με Duodopa®4
Στην καθημερινή κλινική πρακτική, η σχετιζόμενη με τη νόσο Πάρκινσον ποιότητα ζωής βελτιώθηκε στο πρώτο έτος θεραπείας με Duodopa® και διατηρήθηκε και για το δεύτερο έτος.
Το 91% των ασθενών αξιολογούν τη βελτίωση με θεραπεία με Duodopa®, ως προς την ποιότητα ζωής, ως «πολύ καλή» ή «ικανοποιητική».4
Προσαρμογή από: Lopiano L et al. J Neurol 2019; 266:2164-2176.4
Σύμφωνα με τη μελέτη, 40 (27,6%) ασθενείς παρουσίασαν 49 σοβαρές ανεπιθύμητες ενέργειες. Το 16,3% αυτών των περιπτώσεων θεωρήθηκαν σχετιζόμενες με την επέμβαση γαστρονηστιδοστομίας (PEG-J) ή τη συσκευή. Επιπλέον, 12 (8,3%) ασθενείς οδήγησαν σε διακοπή της θεραπείας, 54 (32,7%) ασθενείς αντιμετώπισαν κάποιο πρόβλημα που σχετίζεται με ποιοτικό παράπονο για τη συσκευή και 13 (9%) ασθενείς πέθαναν.4
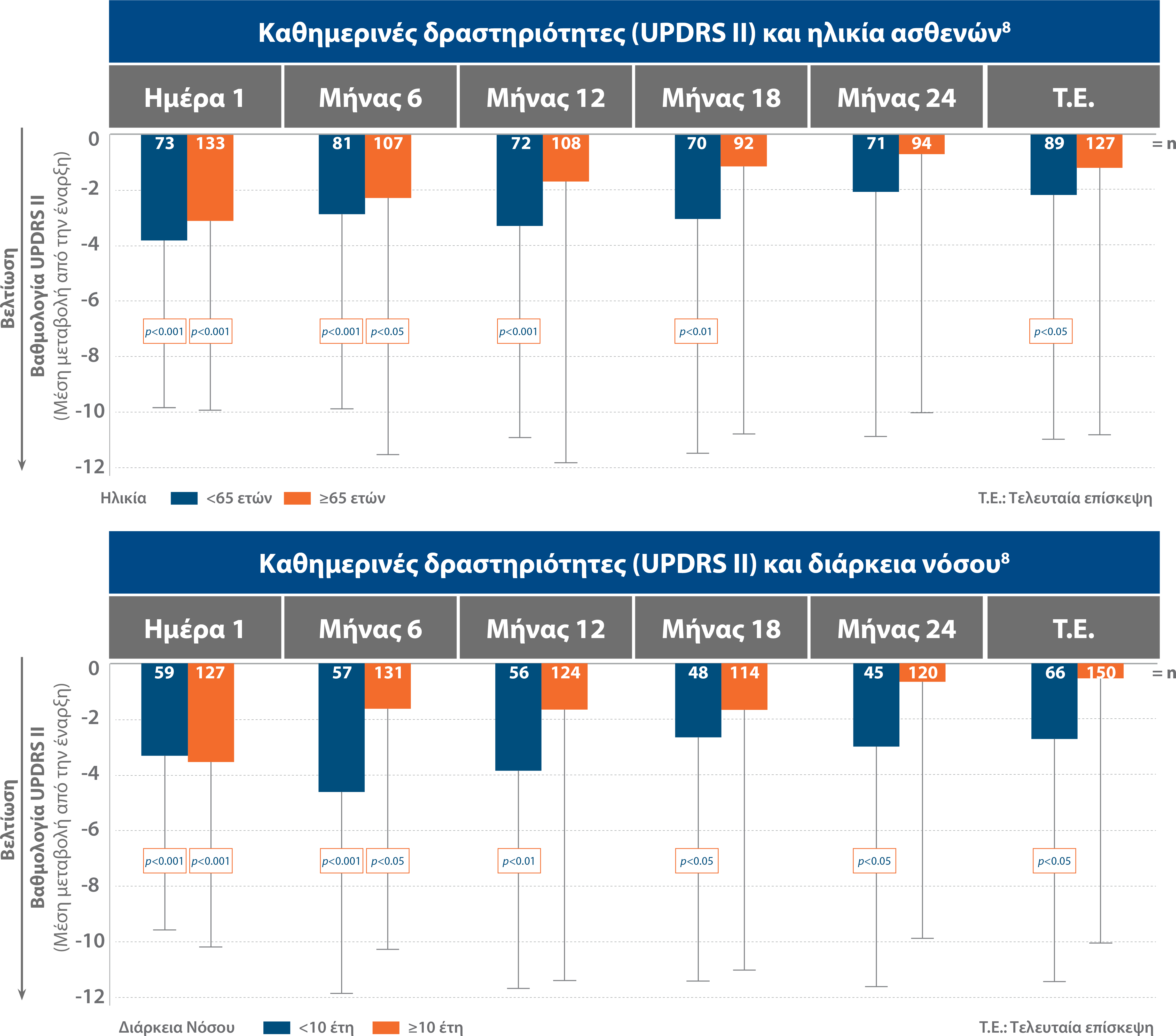
Με το Duodopa®, οι ασθενείς μπορούν να διαχειριστούν καλύτερα τις δραστηριότητες της καθημερινής ζωής8
Οι δραστηριότητες της καθημερινής ζωής βελτιώθηκαν με το Duodopa® τόσο σε ασθενείς <65 ετών, όσο και σε ασθενείς ≥65 ετών, καθώς και σε ασθενείς με διάρκεια νόσου <10 ετών και ≥10 ετών, όπως αυτές φαίνονται στα παρακάτω διαγράμματα:8
Προσαρμογή από: Antonini A et al. Neurodegen Dis Manag 2018;8(3):161-170.8
Η βελτίωση στην εκτέλεση καθημερινών δραστηριοτήτων ήταν μεγαλύτερη σε ασθενείς που έλαβαν θεραπεία με Duodopa® σε μικρότερη ηλικία και με μικρότερη διάρκεια νόσου.8
Aποτελέσματα από το μητρώο επιβεβαίωσαν το τεκμηριωμένο προφίλ ασφάλειας του Duodopa®8
Πληροφορίες για την ασφάλεια του Duodopa®7
Η μέγιστη επίπτωση των ανεπιθύμητων ενεργειών παρατηρήθηκε κατά την πρώτη εβδομάδα μετά την τοποθέτηση της γαστρονηστιδοστομίας (PEG-J). Οι πιο συχνές ανεπιθήμητες ενέργειες συνδέονταν με την τοποθέτηση της συσκευής, ήταν στις περισσότερες περιπτώσεις παροδικές και υποχώρησαν μετά την πρώτη εβδομάδα από την τοποθέτηση της γαστρονιστηδοστομίας. 7
| • | Από τους 324 ασθενείς (91,5%) οι οποίοι εισήλθαν στη φάση της τοποθέτησης της γαστρονηστιδοστομίας (PEG-J), σε μελέτη διάρκειας 54 εβδομάδων, 8 ασθενείς διέκοψαν τη θεραπεία λόγω ανεπιθύμητης ενέργειας σχετιζόμενης με τη διαδικασία ή τη συσκευή.7 |
Προσαρμογή από: Fernandez HH et al. Mv Disord 2015;30(4):500-9.7
- Το 91.5% (n=324) των ασθενών που ολοκλήρωσε τη δοκιμαστική ρινονηστιδική φάση προχώρησε σε τοποθέτηση και χορήγηση θεραπείας μέσω ενδοσκοπικής γαστροστομίας.7
- Οι Α.Ε. που αναφέρθηκαν σε ποσοστό ≥10% αφορούσαν σε κοιλιακό άλγος, επιπλοκές από την τοποθέτηση συσκευής, ναυτία, άλγος από τη διαδικασία, εμφάνιση κοκκιώδους ιστού, μετεγχειρητική λοίμωξη τραύματος και πτώση. Οι περισσότερες Α.Ε. που αναφέρθηκαν ήταν ήπιας/μέτριας σοβαρότητας. Συνολικά, 82 ασθενείς (23.2%) διέκοψαν πρόωρα τη θεραπεία, εκ των οποίων οι 27 (7.6%) το απέδωσαν σε Α.Ε.7
- Η πιο συχνή σοβαρή Α.Ε. αφορούσε σε επιπλοκή από την τοποθέτηση της συσκευής και αναφέρθηκε από το 6.5% των ασθενών.7
NJ: δοκιμαστική φάση εισαγωγής ρινονηστιδικού σωλήνα
A.E.: Ανεπιθύμητη Ενέργεια
Πληροφορίες δοσολογίας για το Duodopa®1
- Η μονοθεραπεία Duodopa® μπορεί να θεωρηθεί αποτελεσματική επιλογή θεραπείας που επιτρέπει τη μειωμένη επιβάρυνση από τη λήψη δισκίων, οδηγώντας δυνητικά σε μεγαλύτερη συμμόρφωση σε ασθενείς με προχωρημένη νόσο Πάρκινσον.34
- Η μεταβλητότητα στις συγκεντρώσεις της levodopa στο πλάσμα ανά ασθενή ήταν χαμηλότερη για τους ασθενείς που λάμβαναν θεραπεία με Duodopa (21%) από ότι σε ασθενείς που λάμβαναν θεραπεία με από του στόματος υπερ-καψακιοποιημένα δισκία levodopa-carbidopa 100/25 mg (67%).1
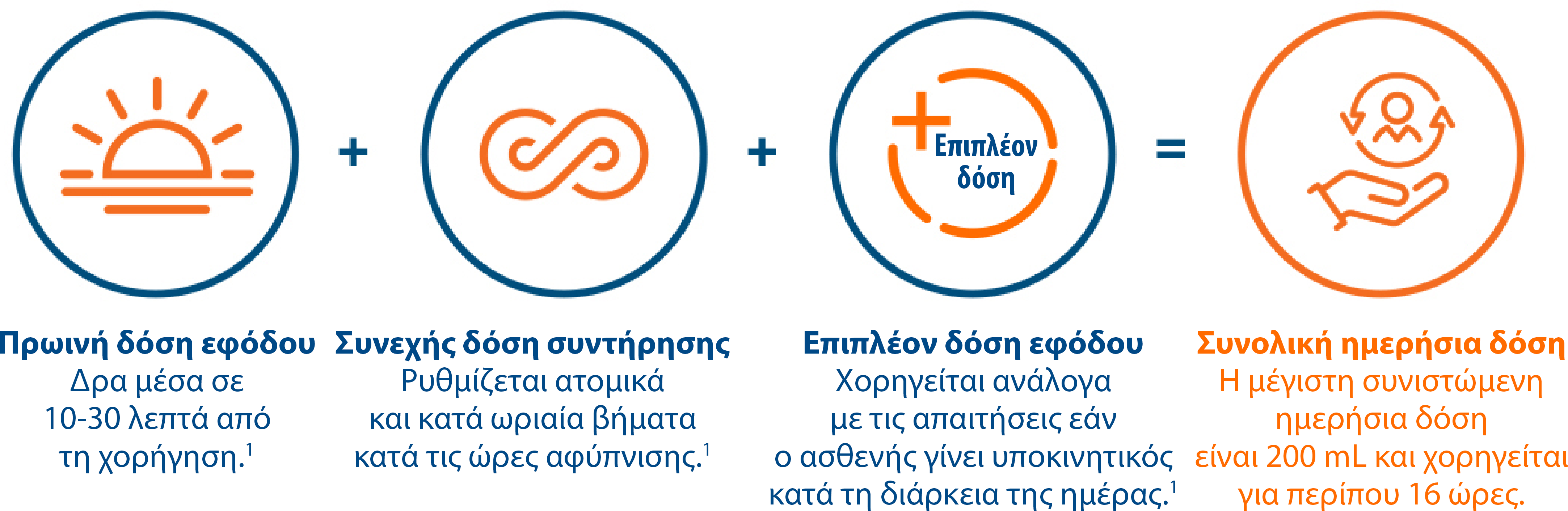
- Η συνολική δόση ανά ημέρα του Duodopa® αποτελείται από τρεις εξατομικευμένα ρυθμιζόμενες δόσεις: την πρωινή δόση εφόδου, τη συνεχή δόση συντήρησης και επιπλέον δόσεις εφόδου που χορηγούνται για περίπου 16 ώρες*1
* Η θεραπεία συνήθως χορηγείται ενόσω είναι ξύπνιος ο ασθενής. Αν δικαιολογείται ιατρικά, το Duodopa® μπορεί να χορηγηθεί για έως και 24 ώρες1
- Περίληψη των Χαρακτηριστικών του Προϊόντος για το Duodopa (εντερική γέλη λεβοντόπα/καρβιντόπα).
- Olanow CW et al. Lancet Neurol 2014;13(2):141 -149.
- Fernandez HH et al. Mov Disord 2018; 33(6):928-936.
- Lopiano L et al. J Neurol 2019; 266:2164-2176.
- Nyholm D et al. Neurology 2005; 64(2):216-223.
- Kruger R et al. Adv Ther 2017; 34(7):1741-1752.
- Fernandez HH et al. Mv Disord 2015;30(4):500-9.
- Antonini A et al. Neurodegen Dis Manag 2018;8(3):161-170.
- Slevin JT et al. J Parkinson’s Dis 2015; 5(1):165-174.
- https://www.ema europa.eu/en/ medicmes/human/orphan-designations/ eu30i035. Accessed 24 November 2020.
- LCIG Worldwide Marketing Authorization Status. Revised 20 October 2020. Data on file.
- Antonini A et a I. Curr Med Res Opin 2018; 34(12):2063-2073.
- Santos-Garcia D et al. Parkinsons Dis 2020:2020:7537924.
- Nyholm D. Parkinsonism Relat Disord 2007; 13(suppl):S13-S17.
- Nyholm D et al. AAPSJ 2013; 15(2):316-323.
- Hughes AJ et al. J Neurol Neurosurg Psychiatry 1992; 55:181-184.
- Goetz CG etal. Mov Disord 2004; 19(9):1020-1028.
- Fox SH et al. Mov Disord 2018; 33(8):1248-1266.
- Varanese S et al. Parkinsons Dis 2011; 2010:480260.
- Kulisevsky J et al. Neurologia 2013; 28(9):558-583.
- Fasano Aet al. BMC Neurology 2019; 19:50.
- Giugni JC, Okun MS. Curr Opin Neurol 2014; 27(4):450-460.
- Οδηγίες χρήσης, AbbVie Εντερικός Καθετήρας 9 FR PEG για 15 και 20 FR, Νοέμβριος 2020
- Οδηγίες χρήσης, AbbVie Κιτ διαδερμικής Ενδοσκοπικής Γαστροστομίας 15 FR / 20 FR, Νοέμβριος 2020
- Οδηγίες χρήσης, AbbVie Ρινονηστιδικός καθετήρας με στυλεό μόνο για εντερική χρήση, Νοέμβριος 2020
- Smiths Medical CADD Legacy® 1400 Operations΄Manual Εγχειρίδιο Λειτουργίας του Legacy Duodopa.
- Φύλλο Οδηγιών Χρήσης του Προϊόντος Duodopa (ΦΟΧ), Ιούνιος 2021
- Antοnini A et al Curr Med ResOpin 2018; 34(12)2063-2073
- Van der Marck MA & Bloem BR. Parkinsonism Relat Disord 2014; Suppl. 1 :S167-S173.
- Pedersen SW et al. Open Neurol 2012; 6:37-50.
- Bell RA et al. J Gen Intern Med 2002; 17(11 ):817-824.
- Markland D et al. J Social Clin Psychol 2005; 26(6):811 -831.
- Street RL et al. Patient Educ Couns 2009; 74(3): 295-301.