ΑΝΑΚΑΛΥΨΤΕ ΠΕΡΙΣΣΟΤΕΡΑ ΓΙΑ ΤΑ...
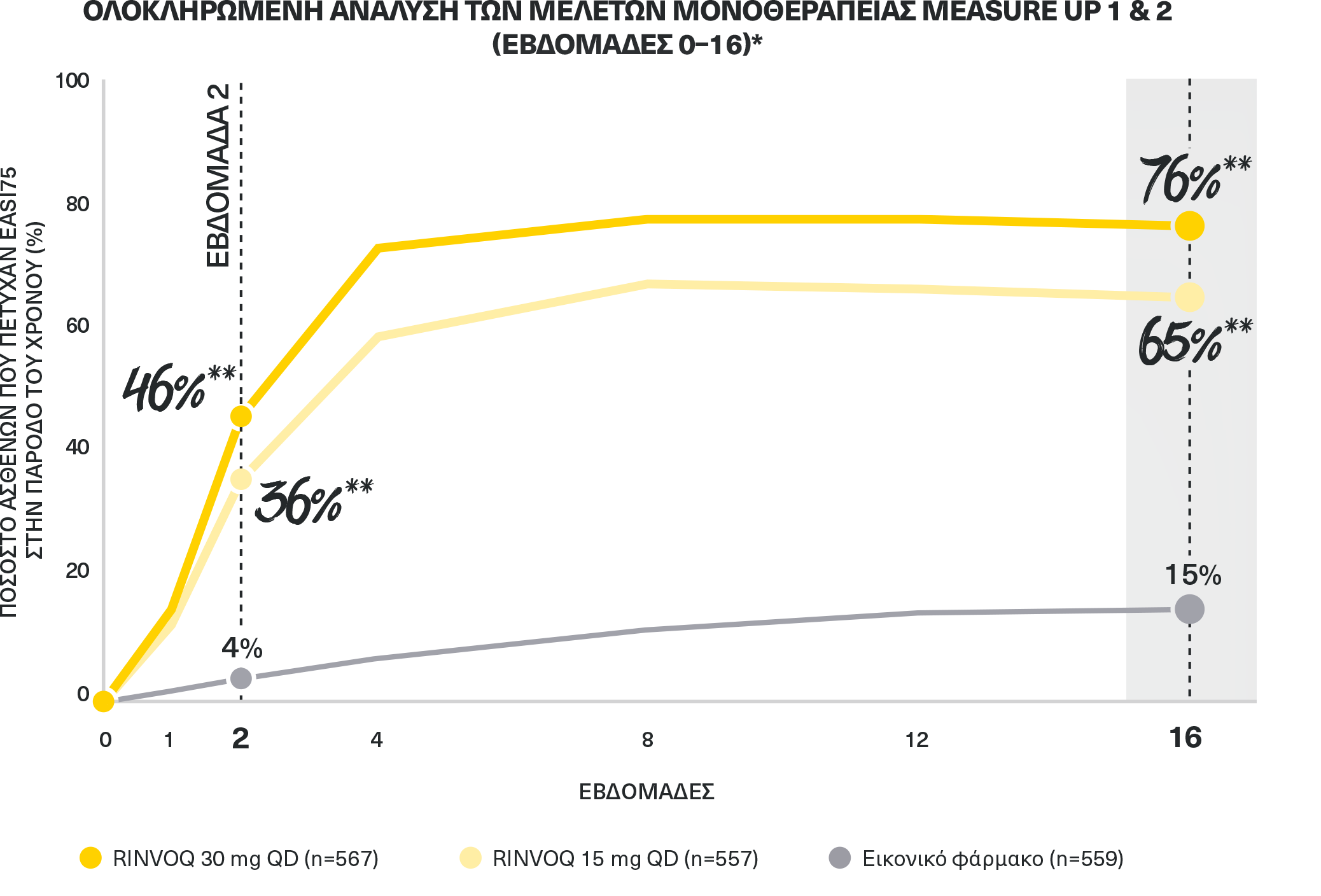
ΔΕΔΟΜΕΝΑ ΚΑΘΑΡΣΗΣ ΤΟΥ ΔΕΡΜΑΤΟΣ
ΠΟΣΟΣΤΑ ΤΑΧΕΙΑΣ ΚΑΙ ΕΝΤΟΝΗΣ ΚΑΘΑΡΣΗΣ ΔΕΡΜΑΤΟΣ ΜΕ ΒΕΛΤΙΩΣΗ EASI 75
μόλις την εβδομάδα 2* και μέχρι την εβδομάδα 161,2
*Ποσοστό ασθενών που πέτυχαν EASI 75 ανά επίσκεψη στη διπλά τυφλή περίοδο ITT (NRI-C) (πληθυσμός ελεγχόμενος με εικονικό φάρμακο).2
Ολοκληρωμένη σύνοψη της αποτελεσματικότητας δύο φάσης 3, τυχαιοποιημένων, ελεγχόμενων με εικονικό φάρμακο μελετών 847 (MEASURE UP 1) και 836 (MEASURE UP 2) ενηλίκων και εφήβων (ηλικίας ≥12 ετών) με μέτρια έως σοβαρή ΑΔ. Οι ασθενείς τυχαιοποιήθηκαν 1:1:1 σε RINVOQ 15 mg (n=281 και 276) ή 30 mg (n=285 και 282) QD ως μονοθεραπεία, ή εικονικό φάρμακο (n=281 και 278).
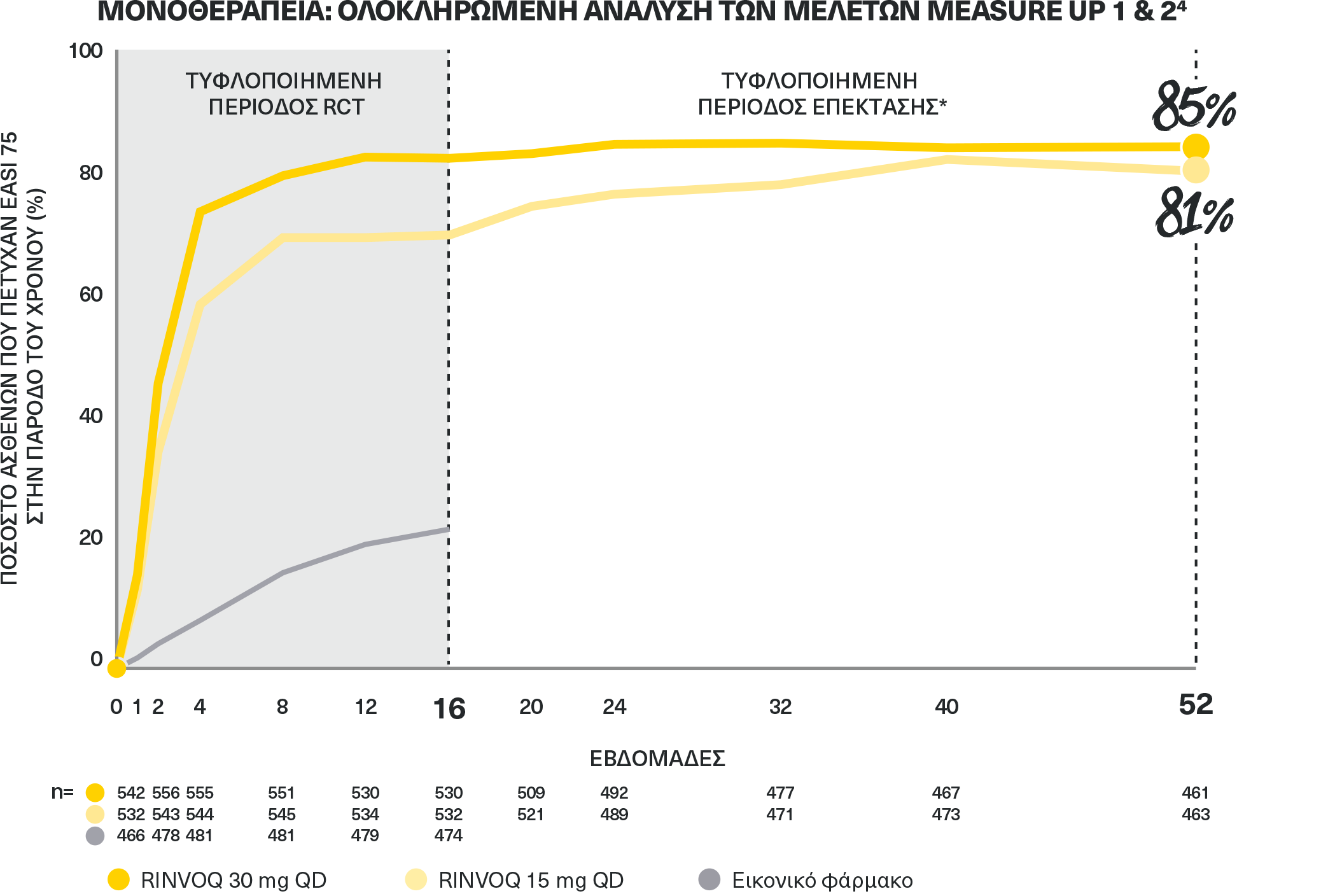
ΠΟΣΟΣΤΑ ΤΑΧΕΙΑΣ ΚΑΙ ΔΙΑΤΗΡΟΥΜΕΝΗΣ ΚΑΘΑΡΣΗΣ ΤΟΥ ΔΕΡΜΑΤΟΣ ΚΑΤΑ EASI 75
μέχρι την εβδομάδα 521,3,4
ΜΟΝΟΘΕΡΑΠΕΙΑ: ΟΛΟΚΛΗΡΩΜΕΝΗ ΑΝΑΛΥΣΗ ΤΩΝ ΜΕΛΕΤΩΝ MEASURE UP 1 & 24
Δεδομένα βάσει παρατήρησης. ΠΕΡΙΟΡΙΣΜΟΙ ΔΕΔΟΜΕΝΩΝ: Τα δεδομένα είναι προκαθορισμένη μη ιεραρχημένα καταληκτικά σημεία χωρίς έλεγχο πολλαπλότητας. Περιπτώσεις που παρατηρήθηκαν (OC): Χωρίς καταλογισμό των ελλιπών δεδομένων. Ασθενείς για τους οποίους έλειπαν δεδομένα σε μία επίσκεψη αποκλείστηκαν από την παρατηρούμενη ανάλυση για αυτήν την επίσκεψη. Υπάρχει πιθανότητα εμπλουτισμού, επειδή οι ασθενείς με δυσανεξία ή απουσία ανταπόκρισης στο φάρμακο μπορεί να αποχωρήσουν. Η επίγνωση ότι οι ασθενείς υποβάλλονται σε ενεργή θεραπεία μπορεί να οδηγήσει σε συστηματικά σφάλματα αναφορικά με το συνολικό θεραπευτικό αποτέλεσμα. Οι ασθενείς μπορεί να είχαν χρησιμοποιήσει τοπικές θεραπείες από την εβδομάδα 16, οι οποίες δεν θεωρούνταν πλέον θεραπείες διάσωσης.
*Η χρήση TCS επιτρεπόταν κατά τη διάρκεια της τυφλοποιημένης περιόδου επέκτασης και δεν αναγνωρίστηκε ως θεραπεία διάσωσης.
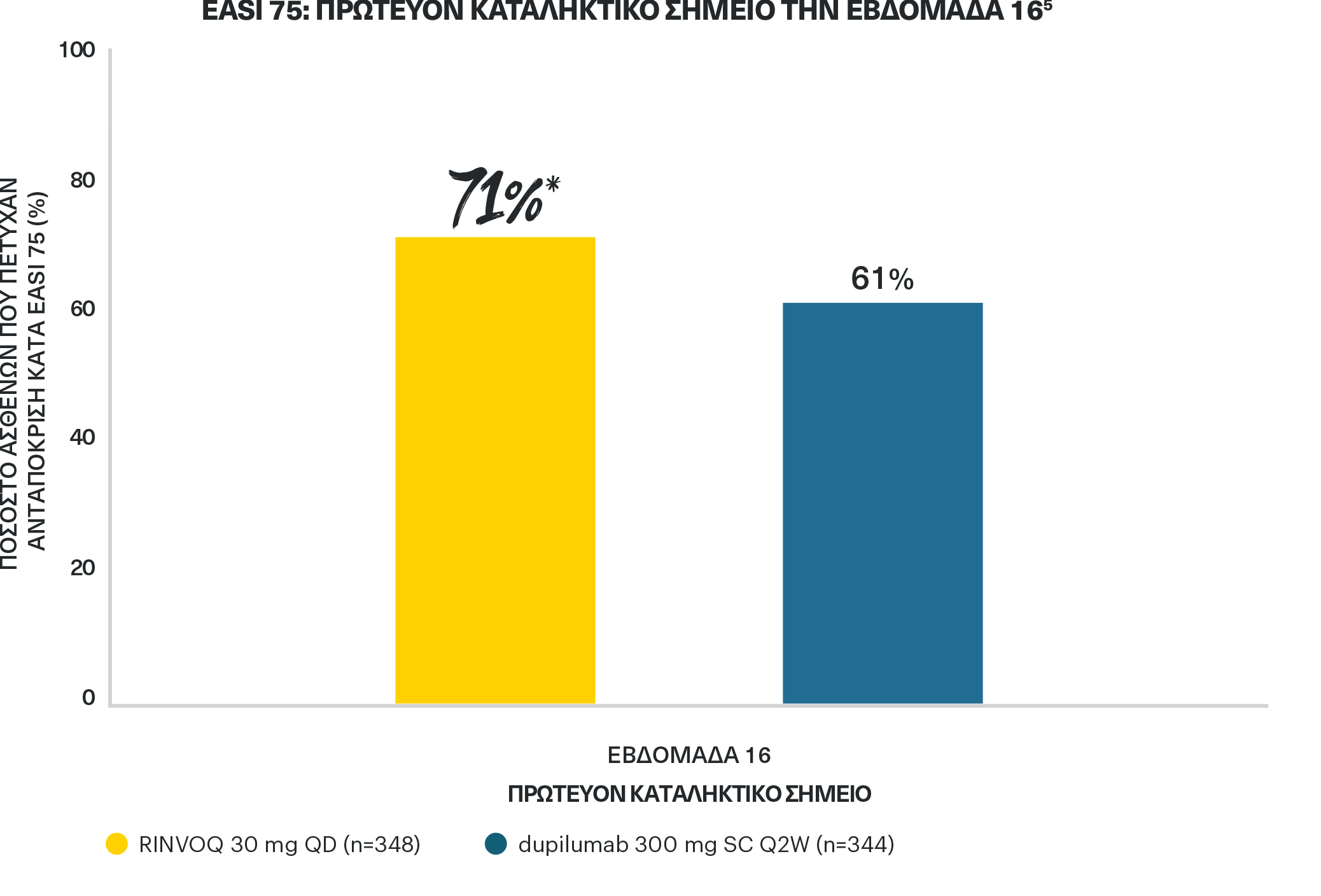
ΤΟ RINVOQTM 30 MG ΠΕΤΥΧΕ ΑΝΩΤΕΡΟΤΗΤΑ ΕΝΑΝΤΙ ΤΟΥ DUPILUMAB
στη κάθαρση του δέρματος κατά EASI 75 την εβδομάδα 165
*p=0,006 έναντι του dupilumab, ITT ανάλυσης με έλεγχο πολλαπλότητας (NRI-C).
NRI-C: καταλογισμός μη ανταποκριθέντων που περιλαμβάνει πολλαπλό καταλογισμό για την αντιμετώπιση των ελλιπών δεδομένων λόγω της COVID-19.
ΣΧΕΔΙΑΣΜΟΣ ΜΕΛΕΤΗΣ: Φάσης 3β, τυχαιοποιημένη, ελεγχόμενη με ενεργό παράγοντα μελέτη με διπλό εικονικό φάρμακο, στην οποία συμμετείχαν 692 ενήλικες ασθενείς με μέτρια έως σοβαρή ΑΔ. Οι ασθενείς τυχαιοποιήθηκαν 1:1 σε RINVOQ 30 mg QD + εικονικό φάρμακο SC Q2W για το dupilumab (n=348) ή dupilumab 300 mg SC Q2W + εικονικό φάρμακο QD για το RINVOQ (n=344). Το πρωτεύον καταληκτικό σημείο ήταν EASI 75 την εβδομάδα 16. Η μείωση του κνησμού (ποσοστιαία βελτίωση στην κλίμακα NRS χειρότερου κνησμού από την έναρξη) έναντι του dupilumab τις εβδομάδες 1, 4, και 16 ήταν ιεραρχημένα δευτερεύοντα καταληκτικά σημεία.
COVID-19: νόσος του κορονοϊού 2019, EASI: δείκτης έκτασης και βαρύτητας εκζέματος, EASI 75: ≥75% μείωση στον δείκτη έκτασης και βαρύτητας εκζέματος, ITT: με πρόθεση θεραπείας, MI: πολλαπλός καταλογισμός, NRI-C: καταλογισμός μη ανταποκριθέντων που περιλαμβάνει πολλαπλό καταλογισμό για την αντιμετώπιση των ελλιπών δεδομένων λόγω της COVID-19, QD: άπαξ ημερησίως; Q2W: κάθε 2 εβδομάδες, SC:
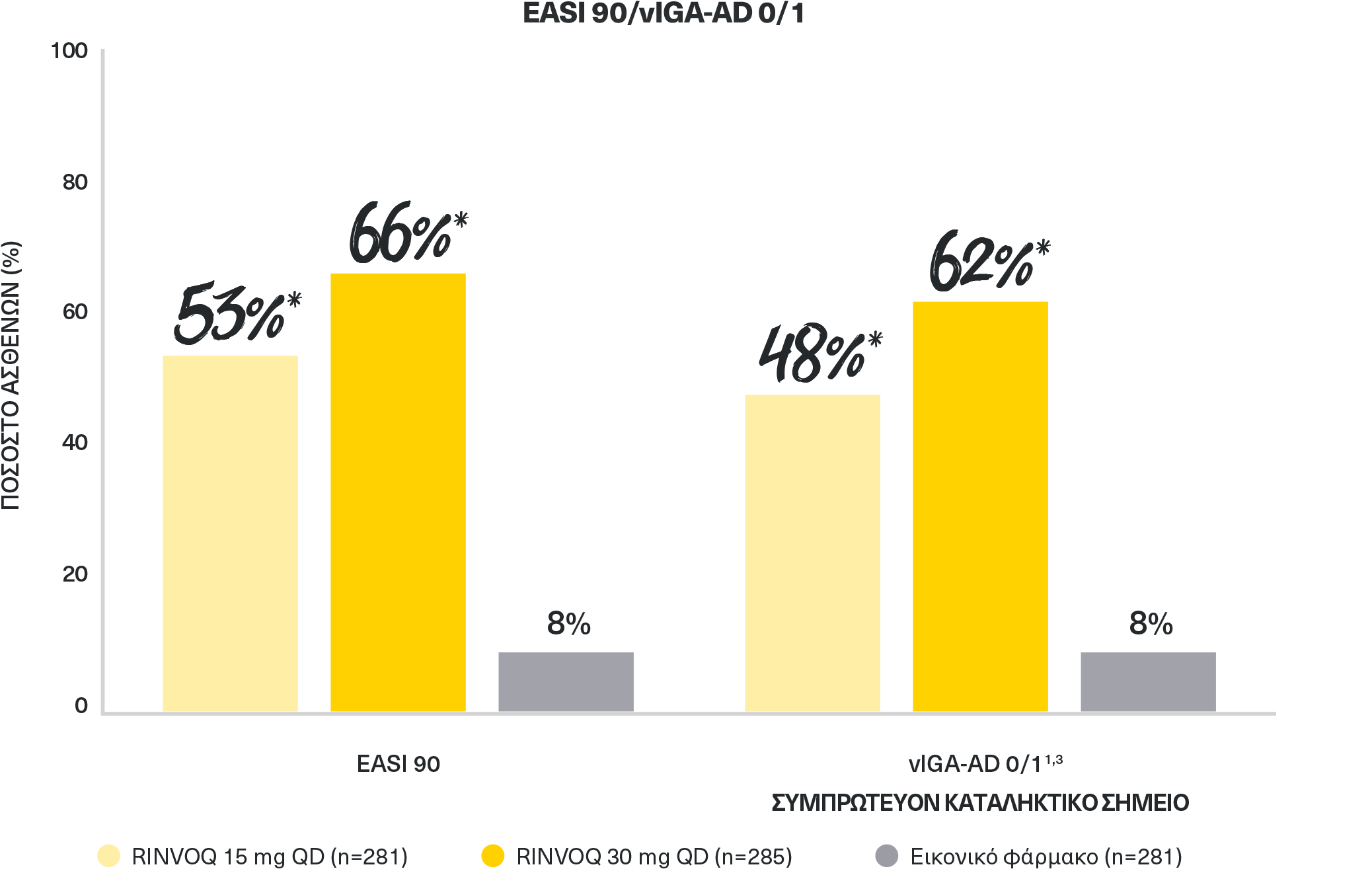
ΠΟΣΟΣΤΑ ΣΧΕΔΟΝ ΠΛΗΡΟΥΣ ΚΑΘΑΡΣΗΣ ΔΕΡΜΑΤΟΣ
συγκριτικά με το εικονικό φάρμακο και με τις δύο δόσεις την εβδομάδα 161,3
**p<0,001 έναντι εικονικού φαρμάκου, ανάλυση ITT με έλεγχο πολλαπλότητας (NRI-C). Όλα τα χρονικά σημεία
Η βελτίωση EASI 90 την εβδομάδα 16 ήταν ιεραρχημένο δευτερεύον καταληκτικό σημείο.
AΔ: ατοπική δερματίτιδα, COVID-19: νόσος του κορονοϊού 2019, EASI 75: ≥75% μείωση στον δείκτη έκτασης και βαρύτητας εκζέματος, ITT: με πρόθεση θεραπείας, MI: πολλαπλός καταλογισμός, NRI-C: καταλογισμός μη ανταποκριθέντων που περιλαμβάνει πολλαπλό καταλογισμό για την αντιμετώπιση των ελλιπών δεδομένων λόγω της COVID-19, QD: άπαξ ημερησίως.
ΠΟΣΟΣΤΑ ΣΧΕΔΟΝ ΠΛΗΡΟΥΣ ΚΑΘΑΡΣΗΣ ΔΕΡΜΑΤΟΣ
συγκριτικά με το εικονικό φάρμακο και με τις δύο δόσεις την εβδομάδα 161,3
**p<0,001 έναντι εικονικού φαρμάκου, ανάλυση ITT με έλεγχο πολλαπλότητας (NRI-C). Όλα τα χρονικά σημεία
Η βελτίωση EASI 90 την εβδομάδα 16 ήταν ιεραρχημένο δευτερεύον καταληκτικό σημείο..
ΑΔ: ατοπική δερματίτιδα, COVID-19: νόσος του κορονοϊού 2019, EASI 90: ≥90% μείωση στον δείκτη έκτασης και βαρύτητας εκζέματος, ITT: με πρόθεση θεραπείας, MI: πολλαπλός καταλογισμός, NRI-C: καταλογισμός μη ανταποκριθέντων που περιλαμβάνει πολλαπλό καταλογισμό για την αντιμετώπιση των ελλιπών δεδομένων λόγω της COVID-19, QD: άπαξ ημερησίως, vIGA-AD: επικυρωμένη συνολική αξιολόγηση της ΑΔ από τον ερευνητή.
ΤΟ RINVOQ 30 MG ΠΕΤΥΧΕ ΑΝΩΤΕΡΟΤΗΤΑ ΕΝΑΝΤΙ ΤΟΥ DUPILUMAB ΣΤΟΝ ΔΕΙΚΤΗ EASI 90
ΕΒΔΟΜΑΔΑ 16
*p<0,001 έναντι του dupilumab, ITT με έλεγχο πολλαπλότητας (NRI-C).
NRI-C: καταλογισμός μη ανταποκριθέντων που περιλαμβάνει πολλαπλό καταλογισμό για την αντιμετώπιση των ελλιπών δεδομένων λόγω της COVID-19.
Οι δείκτες EASI 90/100 (90/100% μείωση στον δείκτη EASI) αποτελούν αυστηρά κριτήρια αξιολόγησης, όπου ως EASI 100 αξιολογείται η πλήρης κάθαρση δέρματος (βαθμολογία EASI 0).
COVID-19: νόσος του κορονοϊού 2019, EASI 90: ≥90% μείωση στον δείκτη έκτασης και βαρύτητας εκζέματος, ITT: με πρόθεση θεραπείας, MI: πολλαπλός καταλογισμός, NRI-C: καταλογισμός μη ανταποκριθέντων που περιλαμβάνει πολλαπλό καταλογισμό για την αντιμετώπιση των ελλιπών δεδομένων λόγω της COVID-19, QD: άπαξ ημερησίως; Q2W: κάθε 2 εβδομάδες, SC: υποδόρια.
ΔΕΔΟΜΕΝΑ ΑΝΑΚΟΥΦΙΣΗΣ ΚΝΗΣΜΟΥ
ΤΑΧΕΙΑ ΚΑΙ ΣΗΜΑΝΤΙΚΗ ΜΕΙΩΣΗ ΤΟΥ ΚΝΗΣΜΟΥ
συγκριτικά με το εικονικό φάρμακο και με τις δύο δόσεις την εβδομάδα 161,3
ΜΕΙΩΣΗ ΤΟΥ ΚΝΗΣΜΟΥ (ΒΕΛΤΙΩΣΗ ΣΤΗΝ ΚΛΙΜΑΚΑ NRS≥4 ΧΕΙΡΟΤΕΡΟΥ ΚΝΗΣΜΟΥ)
*p<0,001 συγκριτικά με το εικονικό φάρμακο, ανάλυση ITT με έλεγχο πολλαπλότητας (NRS-C)
Μείωση κνησμού (βελτίωση ≥4 βαθμών στην κλίμακα NRS χειρότερου κνησμού από την έναρξη, όπως αξιολογήθηκε σε ασθενείς με NRS χειρότερου κνησμού ≥4 στην έναρξη) την ημέρα 1 & 2 με το RINVOQ 30 mg και 15 mg, αντίστοιχα, και την εβδομάδα 16, και για τις δύο δόσεις ήταν ιεραρχημένα δευτερεύοντα καταληκτικά σημεία..1,2
NRS= αριθμητική κλίμακα αξιολόγησης, QD=άπαξ ημερησίως
ΤΑΧΕΙΑ ΚΑΙ ΔΙΑΤΗΡΟΥΜΕΝΗ ΜΕΙΩΣΗ ΤΟΥ ΚΝΗΣΜΟΥ
και με τις δύο δόσεις μέχρι την εβδομάδα 521,3,4
ΟΛΟΚΛΗΡΩΜΕΝΗ ΑΝΑΛΥΣΗ ΤΩΝ ΜΕΛΕΤΩΝ MEASURE UP 1 & 24
ΜΕΙΩΣΗ ΤΟΥ ΚΝΗΣΜΟΥ (ΒΕΛΤΙΩΣΗ ΣΤΗΝ ΚΛΙΜΑΚΑ NRS≥4 ΧΕΙΡΟΤΕΡΟΥ ΚΝΗΣΜΟΥ)
Δεδομένα βάσει παρατήρησης. ΠΕΡΙΟΡΙΣΜΟΙ ΔΕΔΟΜΕΝΩΝ: Τα δεδομένα είναι προκαθορισμένη μη ιεραρχημένα καταληκτικά σημεία χωρίς έλεγχο πολλαπλότητας. Περιπτώσεις που παρατηρήθηκαν (OC): Χωρίς καταλογισμό των ελλιπών δεδομένων. Ασθενείς για τους οποίους έλειπαν δεδομένα σε μία επίσκεψη αποκλείστηκαν από την παρατηρούμενη ανάλυση για αυτήν την επίσκεψη. Υπάρχει πιθανότητα εμπλουτισμού, επειδή οι ασθενείς με δυσανεξία ή απουσία ανταπόκρισης στο φάρμακο μπορεί να αποχωρήσουν. Η επίγνωση ότι οι ασθενείς υποβάλλονται σε ενεργή θεραπεία μπορεί να οδηγήσει σε συστηματικά σφάλματα αναφορικά με το συνολικό θεραπευτικό αποτέλεσμα. Οι ασθενείς μπορεί να είχαν χρησιμοποιήσει τοπικές θεραπείες από την εβδομάδα 16, οι οποίες δεν θεωρούνταν πλέον θεραπείες διάσωσης.
*Η χρήση TCS επιτρεπόταν κατά τη διάρκεια της τυφλοποιημένης περιόδου επέκτασης και δεν αναγνωρίστηκε ως θεραπεία διάσωσης.
COVID-19: νόσος του κορονοϊού 2019, ITT: με πρόθεση θεραπείας, MI: πολλαπλός καταλογισμός, NRI-C: καταλογισμός μη ανταποκριθέντων που περιλαμβάνει πολλαπλό καταλογισμό για την αντιμετώπιση των ελλιπών δεδομένων λόγω της COVID-19, NRS: αριθμητική κλίμακα αξιολόγησης, QD: άπαξ ημερησίως.
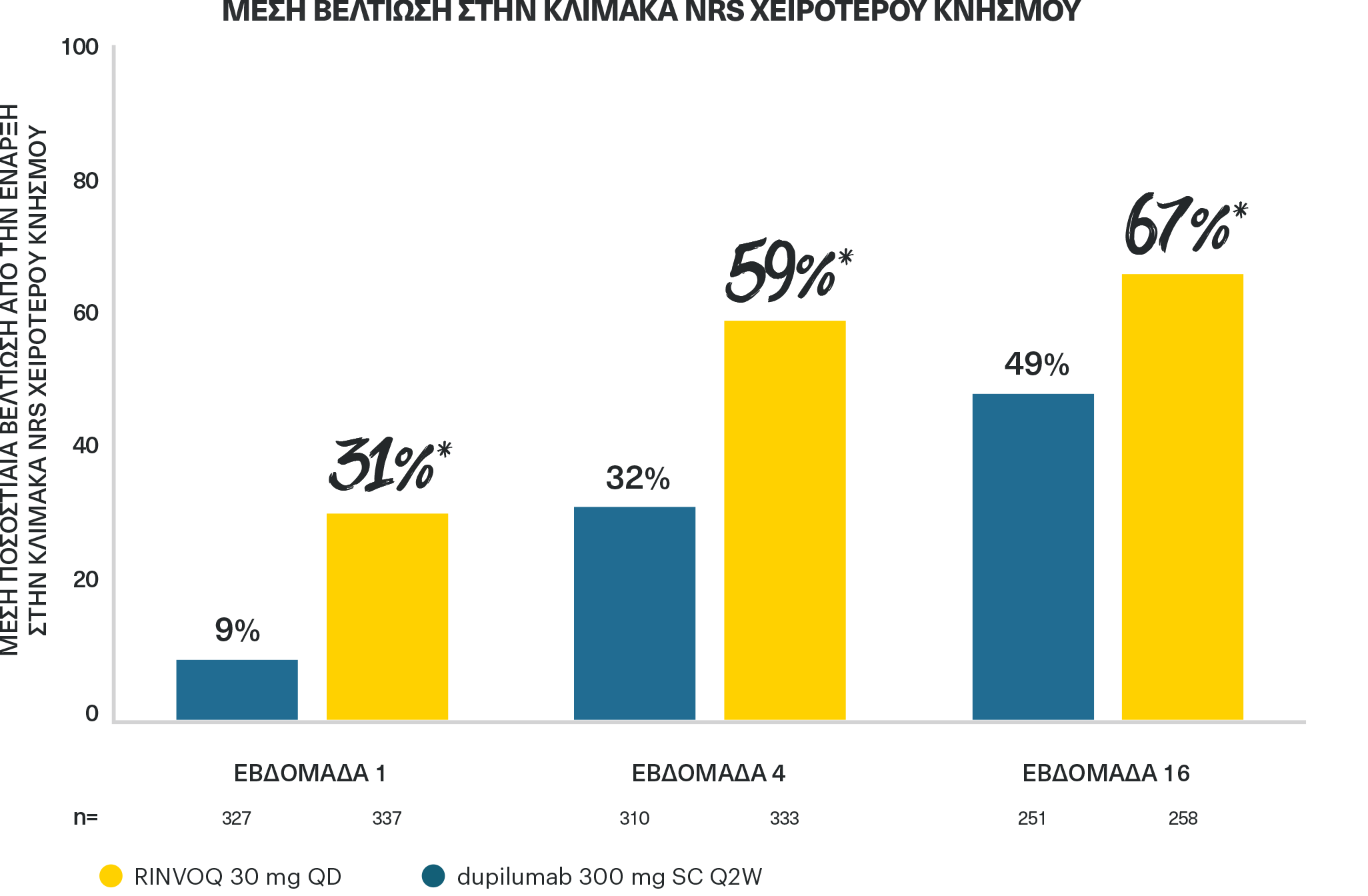
ΤΟ RINVOQ 30 MG ΠΕΤΥΧΕ ΑΝΩΤΕΡΗ ΒΕΛΤΙΩΣΗ ΤΟΥ ΚΝΗΣΜΟΥ ΕΝΑΝΤΙ ΤΟΥ DUPILUMAB
ήδη από την εβδομάδα 1 και την εβδομάδα 165
*p<0,01 έναντι του ITT του dupilumab (MMRM).
ΣΧΕΔΙΑΣΜΟΣ ΜΕΛΕΤΗΣ:
Φάσης 3β, τυχαιοποιημένη, ελεγχόμενη με ενεργό παράγοντα μελέτη με διπλό εικονικό φάρμακο, στην οποία συμμετείχαν 692 ενήλικες ασθενείς με μέτρια έως σοβαρή ΑΔ.Οι ασθενείς τυχαιοποιήθηκαν 1:1 σε RINVOQ 30 mg QD + εικονικό φάρμακο SC Q2W για το dupilumab (n=348) ή dupilumab 300 mg SC Q2W + εικονικό φάρμακο QD για το RINVOQ (n=344).Το πρωτεύον καταληκτικό σημείο ήταν EASI 75 την εβδομάδα 16. Η μείωση του κνησμού (ποσοστιαία βελτίωση στην κλίμακα NRS χειρότερου κνησμού από την έναρξη) έναντι του dupilumab τις εβδομάδες 1, 4, και 16 ήταν ιεραρχημένα δευτερεύοντα καταληκτικά σημεία.
ITT: με πρόθεση θεραπείας, MMRM: μικτό μοντέλο επαναλαμβανόμενων μετρήσεων, NRS: αριθμητική κλίμακα αξιολόγησης, QD: άπαξ ημερησίως, Q2W: κάθε 2 εβδομάδες, SC: υποδόρια.
ΒΙΒΛΙΟΓΡΑΦΙΑ
- RINVOQ Περίληψη Χαρακτηριστικών Προϊόντος 12-2023.
- Guttman-Yassky E, Teixeira H, Simpson E, et al. Once-daily upadacitinib versus placebo in adolescents and adults with moderate-to-severe atopic dermatitis (Measure Up 1 and Measure Up 2): results from two replicate double-blind, randomised controlled phase 3 trials. Lancet. 2021; 397(10290): 2151-2168.
- Simpson EL, Papp KA, Blauvelt A,et al. Efficacy and Safety of Upadacitinib in Patients With Moderate to Severe Atopic Dermatitis: Analysis of Follow-up Data From the Measure Up 1 and Measure Up 2 Randomized Clinical Trials. JAMA Dermatol. 2022 Apr 1;158(4):404-413. doi: 10.1001/jamadermatol.2022.0029.
- Blauvelt A, Teixeira HD, Simpson EL, et al. Efficacy and Safety of Upadacitinib vs Dupilumab in Adults With Moderate-to-Severe Atopic Dermatitis: A Randomized Clinical Trial. JAMA Dermatol. Published online August 4, 2021. doi:10.1001/jamadermatol.2021.3023..
- European Medicines Agency. RINVOQ EPAR: Public Assessment Report. Available at: https://www.ema.europa.eu/en/medicines/human/EPAR/rinvoq. Accessed December 2023
- Reich K, Teixeira HD, de Bruin-Weller M, et al. Safety and efficacy of upadacitinib in combination with topical corticosteroids in adolescents and adults with moderate-to-severe atopic dermatitis (AD Up): results from a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet 2021; 397: 2169–81.
- Rubbert-Roth A, Enejosa J, Pangan AL, et al. Trial of Upadacitinib or Abatacept in Rheumatoid Arthritis. N Engl J Med. 2020;383(16):1511–1521.
- Kameda H, Takeuchi T, Yamaoka K, et al. Efficacy and safety of upadacitinib in Japanese patients with rheumatoid arthritis (SELECT-SUNRISE): a placebo-controlled phase IIb/III study. Rheumatology (Oxford). 2020;59(11):3303–3313.
- Zeng X, Zhao D, Radominski SC, et al. Upadacitinib in patients from China, Brazil, and South Korea with rheumatoid arthritis and an inadequate response to conventional therapy. Int J Rheum Dis. 2021 Dec;24(12):1530-1539. doi: 10.1111/1756-185X.14235.
- ClinicalTrials.gov. A Study to Evaluate Safety of Upadacitinib in Combination With Topical Corticosteroids in Adolescent and Adult Participants With Moderate to Severe Atopic Dermatitis (Rising Up). Available at: https://clinicaltrials.gov/ct2/show/NCT03661138 Accessed December 2023
- Leshem YA, et al. What the Eczema Area and Severity Index score tells us about the severity of atopic dermatitis: an interpretability study. Br J Dermatol. 2015; 172(5): 1353–1357.
- Homeforeczema.org. EASI User Guide Dec 2016. Available at :http://www.homeforeczema.org/documents/easi-user-guide-dec-2016-v2.pdf. Accessed December 2023
- Phan NQ, Blome C, Fritz F, et al. Assessment of Pruritus Intensity: Prospective Study on Validity and Reliability of the Visual Analogue Scale, Numerical Rating Scale and Verbal Rating Scale in 471 Patients with Chronic Pruritus. Acta Derm Venereol 2012; 92(5): 502–507.
- Reich A, Heisig M, Phan NQ, et al. Visual Analogue Scale: Evaluation of the Instrument for the Assessment of Pruritus. Acta Derm Venereol 2012; 92(5): 497–501.
- Silverberg JI, Simpson EL, Calimlim BM, Litcher-Kelly L, et al. Dermatol Ther (Heidelb). 2022 Dec;12(12):2817-2827. doi: 10.1007/s13555-022-00836-5.









.png)