Colitis
Ulcerosa
Beneficios de alcanzar objetivos de tratamiento más exigentes en CU
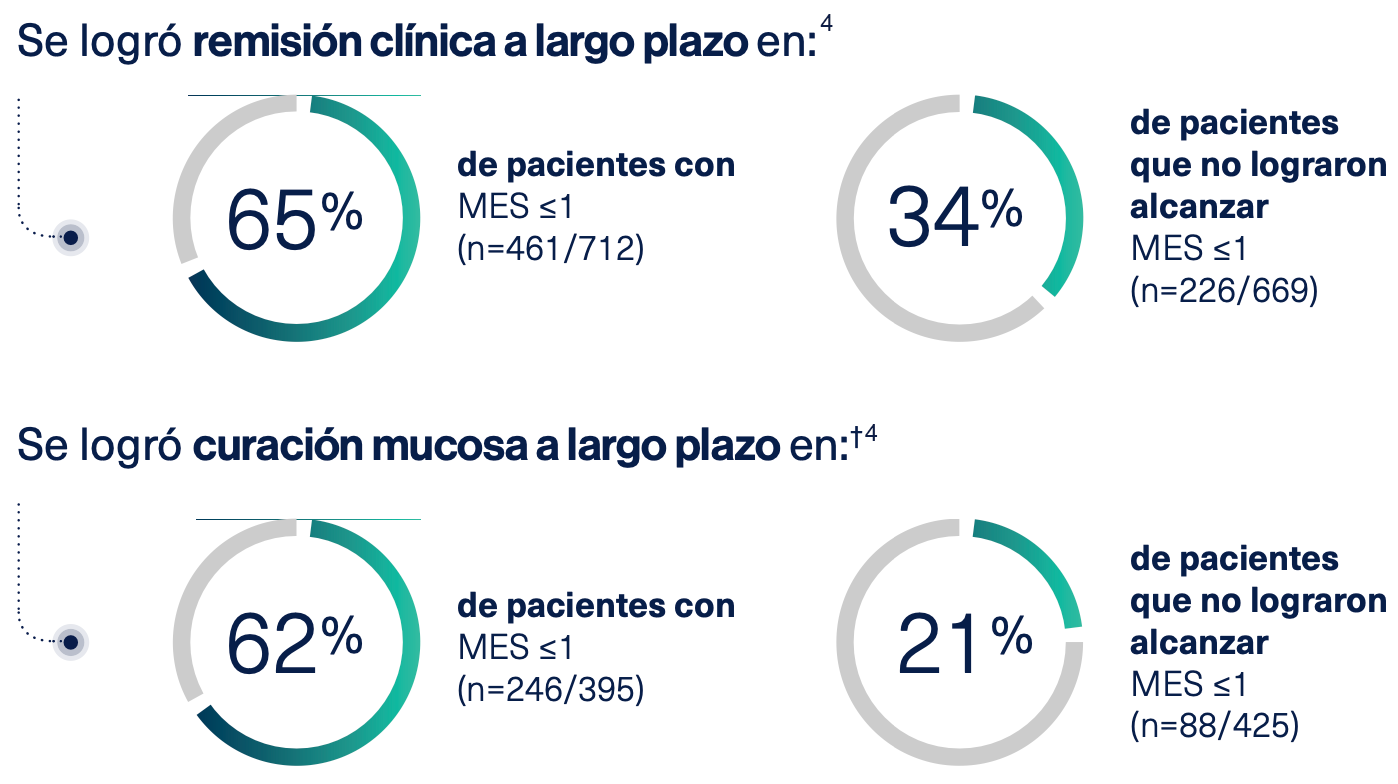
MES ≤1 como objetivo de tratamiento de la CU, ha demostrado ser un predictor de mejora del curso de la enfermedad y pronóstico a largo plazo4
* Once estudios definieron la curación mucosa como subscore endoscópico ≤1; 2 estudios utilizaron MES=0. Siete estudios incluyeron pacientes con CU tratados con fármacos biológicos; el resto incluía tratamientos no biológicos o una combinación de terapias convencionales para la CU en la era prebiológica. La mayoría de los estudios incluyeron pacientes con CU moderada a grave. Ocho estudios tuvieron seguimiento ≥2 años. Los pacientes tenían al menos 1 evaluación endoscópica después del inicio del tratamiento de la CU realizada entre 1 y 6 meses desde el inicio del estudio para evaluar la curación mucosa.Los datos de seguimiento clínico y/o endoscópico estaban disponibles ≥52 semanas desde el inicio del estudio.
† Seis estudios con 823 pacientes. Curación mucosa > 52 semanas y al menos 6 meses después de la evaluación endoscópica.
MES=0
Es el criterio de valoración más adecuado para definir la curación mucosa5,6
MES=1
Está asociado a un mayor riesgo de recaída5.6
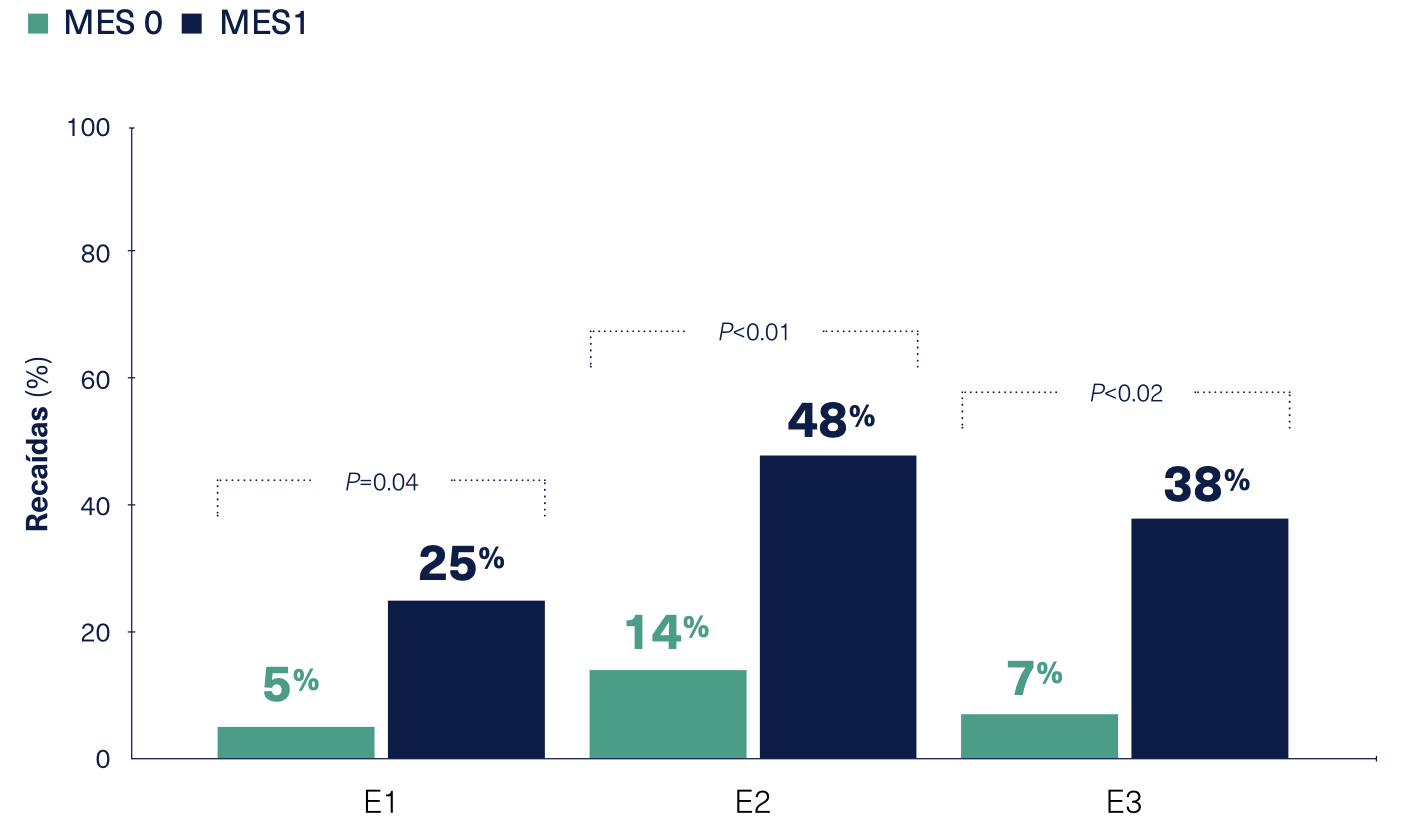
Resultados de un estudio de cohorte prospectivo longitudinal de 187 pacientes con CU (126 [67,3%] con puntuación Mayo de 0 y 61 [32,7%] con puntuación Mayo 1). Todos los pacientes con CU que presentaron curación mucosa en la colonoscopia fueron incluidos consecutivamente. Después de la colonoscopia, se registró la extensión de la enfermedad según la clasificación de Montreal (E1, proctitis ulcerosa; E2, CU del lado izquierdo; E3, colitis extensiva. La curación mucosa se definió como un subscore endoscópico de Mayo de 0 o 1. La recaída clínica fue definida como la necesidad de terapia para inducir la remisión, cualquier escalada del tratamiento, hospitalización o colectomía. Todos las recaídas se evaluaron a los 6 y 12 meses después de entrar al estudio. Los resultados se analizaron por un análisis logístico incondicional paso a paso y análisis de regresión de Kaplan-Meier.
Mirando hacia el futuro: remisión y curación histológica en pacientes con CU
• La curación histológica necesita una recuperación completa de la mucosa del colon, con ausencia de inflamación o cambios estructurales.7
• La curación mucosa se asocia con mejores resultados clínicos en pacientes con CU; sin embargo, los parámetros histológicos pueden aportar una imagen más precisa de la recuperación de la mucosa y mejorar los objetivos de tratamiento.7
Para saber más sobre CU ingrese aquí
Referencias
- Turner D, Ricciuto A, Lewis A, et al; International Organization for the Study of IBD. STRIDE- II: an update on the selecting therapeutic targets in inflammatory bowel disease (STRIDE) initiative of the International Organization for the Study of IBD (IOIBD): determining therapeutic goals for treat-to-target strategies in IBD. Gastroenterology. 2021;160(5):1570- 1583..
- Rubin DT, Ananthakrishnan AN, Siegel CA, Sauer BG, Long MD. ACG clinical guideline: ulcerative colitis in adults. Am J Gastroenterol. 2019;114(3):384-413.
- Maaser C, Sturm A, Vavricka SR, et al. ECCOESGAR guideline for diagnostic assessment in IBD part 1: initial diagnosis, monitoring of known IBD, detection of complications. J Crohns Colitis. 2019;13(2):144-164.
- Shah SC, Colombel JF, Sands BE, Narula N. Mucosal healing is associated with improved long-term outcomes of patients with ulcerative colitis: a systematic review and meta-analysis. Clin Gastroenterol Hepatol. 2016;14(9): 1245-1255.e8.
- Barreiro-de Acosta M, Vallejo N, de la Iglesia D, et al. Evaluation of the risk of relapse in ulcerative colitis according to the degree of mucosal healing (Mayo 0 vs 1): a longitudinal cohort study. J Crohns Colitis. 2016;10(1):13-19.
- Boal Carvalho P, Dias de Castro F, Rosa B, Moreira MJ, Cotter J. Mucosal healing in ulcerative colitis – when zero is better. J Crohns Colitis. 2016;10(1):20-25.
- Peyrin-Biroulet L, Bressenot A, Kampman W. Histologic remission: the ultimate therapeutic goal in ulcerative colitis? Clin Gastroenterol Hepatol. 2014;12(6):929-34.e2.
- Cohen R, Skup M, Ozbay AB, et al. Direct and indirect healthcare resource utilization and cost associates with ulcerative colitis in a privately-insured employed population in the US. J Med Econ. 2015;18(6):447-456.
- Rowe WA, Anand BS. Inflamatory bowel disease. Medscape website. https://emedicine. medscape.com/article/179037-overview#a6. Published April 10,2020.
- Crosn ́s & Colitis Foundation. About Crohn ́s disease and ulcerative colitis. http//www. crohnscolitisfoundation.org/sites/default/files/legacy/assets/pdfs/IBDoverview.pdf. Published June 2018. Accesed June 9,2021.
- Khan HM, Mehmood F, Khan N. Optimal Management of steroid-dependent ulcerative colitis. Clin Exp Gastroenterol. 2015;8:293-302.
- Piercy J, Ozbay AB, Roughley A, Chao J, Skup M. Comparison of ulcerative colitis with Crohn ́s disease from the perspective of patient burden. Poster presented at: Digestive Disease Week; May 17-19,2015; Washington, DC, Poster Tu1256.
- Ye X, Wang HHX, et al. Can fecal calprotein accurately identify histological activity of ulcerative colitis? A meta-análisis. Therap Adv Gastroenterol. 2021;14:1756284821994741. doi:10.1177/1756284821994741
- Agrawal M, Spencer EA, Colombel JF, Ungaro RC. Approach to teh Management of recently diagnosed inflammatory bowel disease patients: a user ́s guide for adult and pediatric gastorentorologist. Gastroenterology. 2021;161(1):47-65. doi:10.1053/gastro.20221.04.063
JAKa-AR-00028-MC