Πιο κάτω μπορείτε να δείτε τους σχεδιασμούς των μελετών, να ακούσετε ειδικούς και να κατεβάσετε δημοσιεύσεις.
Η HEADS UP ήταν μια φάσης 3β, τυχαιοποιημένη, ελεγχόμενη με ενεργό παράγοντα, με διπλό εικονικό φάρμακο μελέτη ενήλικων ασθενών με μέτρια έως σοβαρή ΑΔ. ΟΙ ασθενείς τυχαιοποιήθηκαν 1:1 σε RINVOQ 30 mg άπαξ ημερησίως + εικονικό φάρμακο υποδόρια κάθε 2 εβδομάδες για το dupilumab ή dupilumab 300 mg υποδόρια κάθε 2 εβδομάδες + εικονικό φάρμακο μία φορά ημερησίως για το RINVOQ.3
*Παρακολούθηση 12 εβδομάδων †Οι ασθενείς που τυχαιοποιήθηκαν στην ομάδα του dupilumab 300 mg SC Q2W έλαβαν τη δόση έναρξης των 600 mg στην αρχική επίσκεψη
AΔ: ατοπική δερματίτιδα, EASI: δείκτης έκτασης και βαρύτητας εκζέματος, Q2W: κάθε δύο εβδομάδες, QD: άπαξ ημερησίως, SC: υποδόρια, vIGA-AD 0/1: επικυρωμένη συνολική αξιολόγηση του ερευνητή για την ατοπική δερματίτιδα.
ΑΠΕΥΘΕΙΑΣ ΣΥΓΚΡΙΣΗ ΑΠΟΤΕΛΕΣΜΑΤΙΚΟΤΗΤΑΣ ΚΑΙ ΑΣΦΑΛΕΙΑΣ ΣΤΗ ΜΕΛΕΤΗ «HEADS UP»
Κύρια κριτήρια ένταξης
– 18 έως 75 ετών με χρόνια ΑΔ*
– Συμπτώματα ΑΔ ≥3 έτη
– ≥10% BSA, EASI ≥16, και IGA ≥3
– Εβδομαδιαίος μέσος όρος στην κλίμακα NRS χειρότερου κνησμού ≥4 κατά την έναρξη
– Ανεπαρκής ανταπόκριση σε TCS ή TCIc εντός 6 μηνών πριν από την έναρξη της θεραπείας
Κύρια κριτήρια αποκλεισμού
– Τοπικές θεραπείες εντός 7 ημερών πριν από την έναρξη της θεραπείαςγ
– Συστηματική θεραπεία για ΑΔ ή φωτοθεραπείαδ ή παραδοσιακή κινεζική ιατρικήε ή οποιοδήποτε ερευνητικό φάρμακοστ εντός 4 εβδομάδων πριν από την έναρξη
– Προηγούμενη έκθεση σε dupilumab ή συστηματικούς αναστολείς των JAK
αΔιάγνωση ΑΔ σύμφωνα με τα κριτήρια Hanifin και Rajka (≥3 ή 4 μείζονα χαρακτηριστικά και ≥3 από 23 ελάσσονα χαρακτηριστικά), βή για ασθενείς για τους οποίους κατά τα άλλα δεν συνιστώνται ιατρικά οι τοπικές θεραπείες, γεξαιρούνται οι τοπικοί μαλακτικοί παράγοντες, δθεραπεία με λέιζερ, θάλαμοι τεχνητού μαυρίσματος ή παρατεταμένη έκθεση στον ήλιο που θα μπορούσε να επηρεάσει τη βαρύτητα της νόσου ή τις αξιολογήσεις της νόσου. εΧορήγηση από το στόμα ή παρεντερικά. στΕντός 4 εβδομάδων ή πέντε ημίσειες ζωές φαρμάκου (όποιο είναι μεγαλύτερο) ή να είναι επί του παρόντος εγγεγραμμένοι σε άλλη κλινική μελέτη.
ΑΔ: ατοπική δερματίτιδα, BSA: επιφάνεια σώματος, EASI: δείκτης έκτασης και βαρύτητας εκζέματος, IGA: συνολική αξιολόγηση από τον ερευνητή, JAK: κινάση Janus, NRS: αριθμητική κλίμακα αξιολόγησης, TCI: τοπικός αναστολέας καλσινευρίνης, TCS: τοπικά κορτικοστεροειδή.
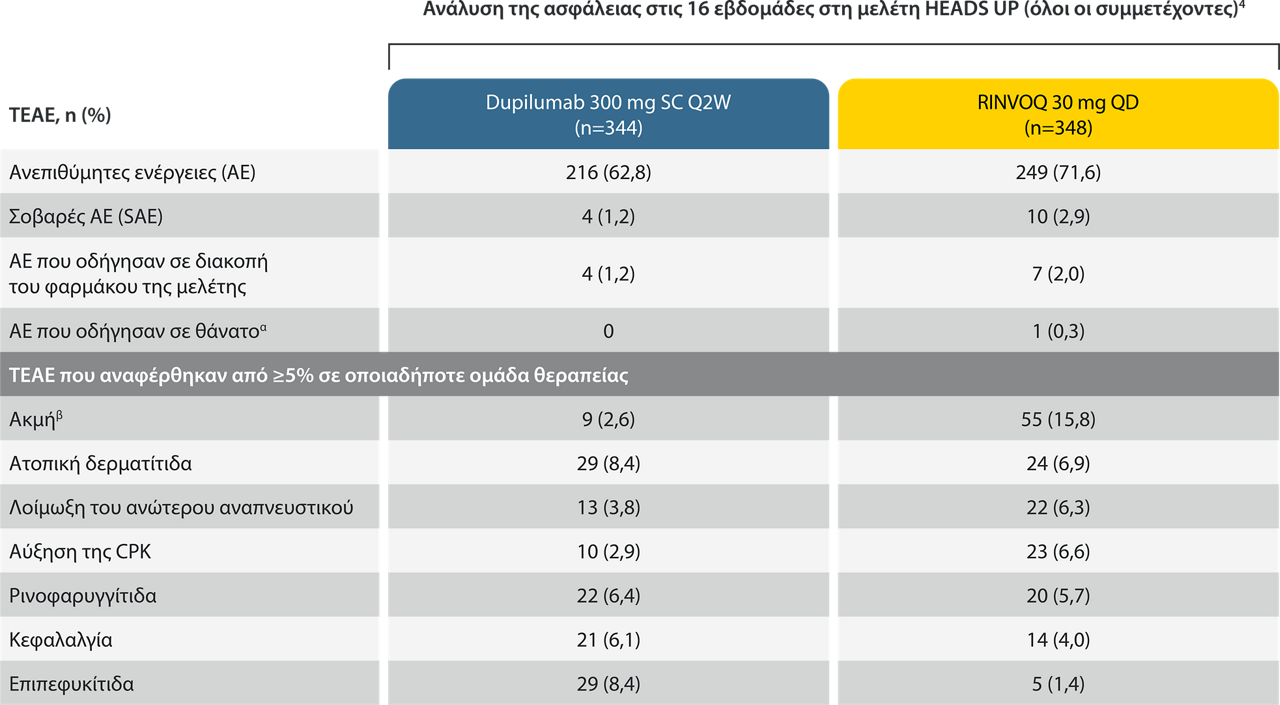
αΓυναίκα 40 ετών η οποία είχε βρογχοπνευμονία σχετιζόμενη με γρίπη Α βρέθηκε νεκρή στο σπίτι της την Ημέρα 70 της μελέτης. β Τα περισσότερα συμβάντα ακμής περιλάμβαναν κυρίως φλεγμονώδεις βλατίδες, φλύκταινες και φαγέσωρες που αφορούσαν το πρόσωπο. Όλα τα συμβάντα ήταν μη σοβαρά. Κανένα δεν οδήγησε σε διακοπή της θεραπείας.
ΒΙΒΛΙΟΓΡΑΦΙΑ
- RINVOQ Περίληψη Χαρακτηριστικών Προϊόντος 07-2023.
- Guttman-Yassky E, Teixeira H, Simpson E, et al. Once-daily upadacitinib versus placebo in adolescents and adults with moderate-to-severe atopic dermatitis (Measure Up 1 and Measure Up 2): results from two replicate double-blind, randomised controlled phase 3 trials. Lancet. 2021; 397(10290): 2151-2168.
- Simpson EL, Papp KA, Blauvelt A,et al. Efficacy and Safety of Upadacitinib in Patients With Moderate to Severe Atopic Dermatitis: Analysis of Follow-up Data From the Measure Up 1 and Measure Up 2 Randomized Clinical Trials. JAMA Dermatol. 2022 Apr 1;158(4):404-413. doi: 10.1001/jamadermatol.2022.0029.
- Blauvelt A, Teixeira HD, Simpson EL, et al. Efficacy and Safety of Upadacitinib vs Dupilumab in Adults With Moderate-to-Severe Atopic Dermatitis: A Randomized Clinical Trial. JAMA Dermatol. Published online August 4, 2021. doi:10.1001/jamadermatol.2021.3023..
- European Medicines Agency. RINVOQ EPAR: Public Assessment Report. Available at: https://www.ema.europa.eu/en/medicines/human/EPAR/rinvoq. Accessed December 2023
- Reich K, Teixeira HD, de Bruin-Weller M, et al. Safety and efficacy of upadacitinib in combination with topical corticosteroids in adolescents and adults with moderate-to-severe atopic dermatitis (AD Up): results from a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet 2021; 397: 2169–81.
- Rubbert-Roth A, Enejosa J, Pangan AL, et al. Trial of Upadacitinib or Abatacept in Rheumatoid Arthritis. N Engl J Med. 2020;383(16):1511–1521.
- Kameda H, Takeuchi T, Yamaoka K, et al. Efficacy and safety of upadacitinib in Japanese patients with rheumatoid arthritis (SELECT-SUNRISE): a placebo-controlled phase IIb/III study. Rheumatology (Oxford). 2020;59(11):3303–3313.
- Zeng X, Zhao D, Radominski SC, et al. Upadacitinib in patients from China, Brazil, and South Korea with rheumatoid arthritis and an inadequate response to conventional therapy. Int J Rheum Dis. 2021 Dec;24(12):1530-1539. doi: 10.1111/1756-185X.14235.
- ClinicalTrials.gov. A Study to Evaluate Safety of Upadacitinib in Combination With Topical Corticosteroids in Adolescent and Adult Participants With Moderate to Severe Atopic Dermatitis (Rising Up). Available at: https://clinicaltrials.gov/ct2/show/NCT03661138 Accessed December 2023
- Leshem YA, et al. What the Eczema Area and Severity Index score tells us about the severity of atopic dermatitis: an interpretability study. Br J Dermatol. 2015; 172(5): 1353–1357.
- Homeforeczema.org. EASI User Guide Dec 2016. Available at :http://www.homeforeczema.org/documents/easi-user-guide-dec-2016-v2.pdf. Accessed December 2023
- Phan NQ, Blome C, Fritz F, et al. Assessment of Pruritus Intensity: Prospective Study on Validity and Reliability of the Visual Analogue Scale, Numerical Rating Scale and Verbal Rating Scale in 471 Patients with Chronic Pruritus. Acta Derm Venereol 2012; 92(5): 502–507.
- Reich A, Heisig M, Phan NQ, et al. Visual Analogue Scale: Evaluation of the Instrument for the Assessment of Pruritus. Acta Derm Venereol 2012; 92(5): 497–501.
- Silverberg JI, Simpson EL, Calimlim BM, Litcher-Kelly L, et al. Dermatol Ther (Heidelb). 2022 Dec;12(12):2817-2827. doi: 10.1007/s13555-022-00836-5.





















