Nicht orale Folgetherapien
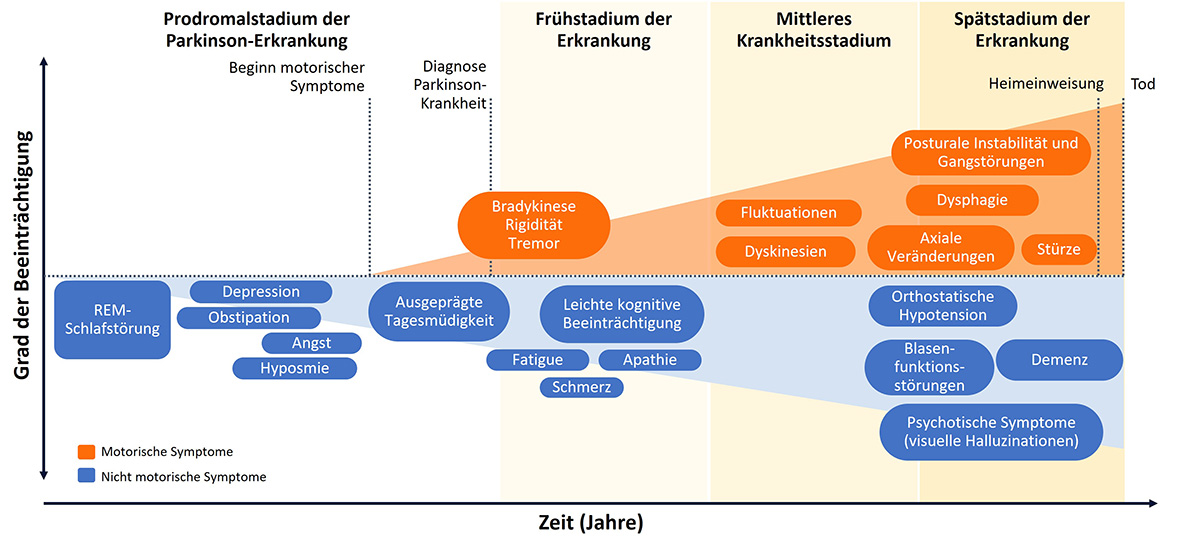
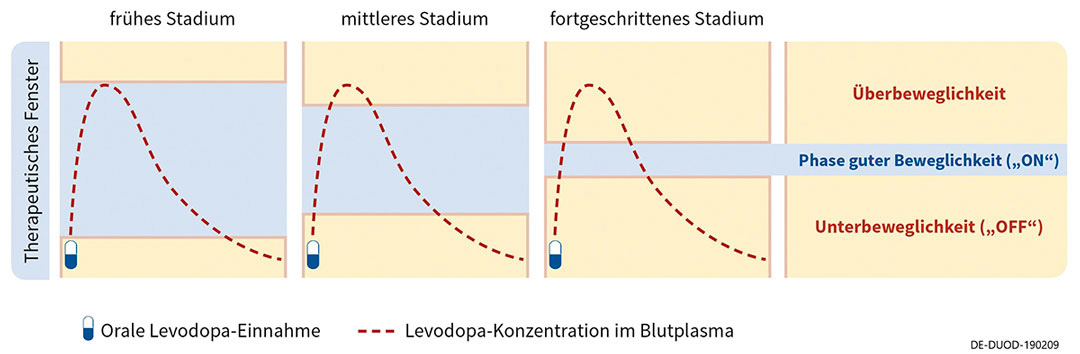
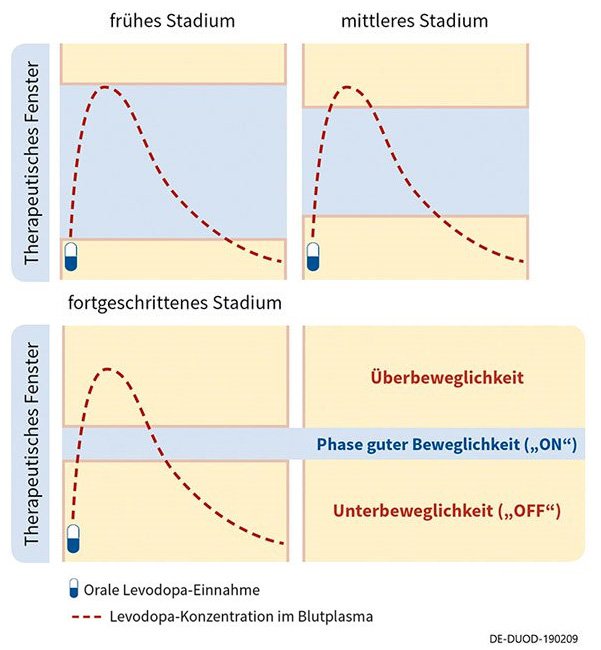
Wirkschwankungen unter oraler Therapie nehmen im Krankheitsverlauf zu und beeinträchtigen die Lebensqualität. Diese ist für Betroffene zusammen mit dem Bedürfnis nach guter Motorik der entscheidende Faktor bei der Therapieentscheidung.13 Um Einbußen in der Lebensqualität zu vermeiden, kann es bei Auftreten von Wirkschwankungen daher sinnvoll sein, eine adäquate Therapieanpassung oder Umstellung auf nicht orale Folgetherapien in Betracht zu ziehen.
Zu den nicht oralen Therapieoptionen gehören verschiedene Pumpentherapien wie die subkutane und intestinale Levodopa-Therapie und die subkutane Apomorphin-Therapie, sowie die Tiefe Hirnstimulation. Während bei den Pumpentherapien ein dopaminerger Wirkstoff (Levodopa oder Apomorphin) kontinuierlich verabreicht wird, werden bei der Tiefen Hirnstimulation elektrische Impulse im Gehirn abgegeben.
Subkutane Levodopa-Therapie
Levodopa gilt als Goldstandard in der Parkinson-Therapie. Bei dieser Therapie wird der Wirkstoff Levodopa mithilfe einer Medikamentenpumpe subkutan ohne operativen Eingriff über eine flexible Kunststoffkanüle unter die Haut verabreicht. Die Kanüle wird mit einer Applikationshilfe durch die Patient*innen selbst unter die Haut – in der Regel am Bauch – gebracht und kann bis zu drei Tage an einer Infusionsstelle verbleiben. Die Pumpe und Kanüle sind über einen dünnen Infusionsschlauch verbunden.
Durch die subkutane Infusionstherapie wird der Gastrointestinaltrakt umgangen und die kontinuierliche dopaminerge Stimulation mit der Pumpe führt zu konstanten Levodopa-Plasmaspiegel über 24 Stunden. Subkutanes Levodopa kann die OFF-Phasen reduzieren und mehr Zeit in guter Beweglichkeit für Patient*innen bieten.14
Intestinale Levodopa-Therapie
Bei der intestinalen Levodopa-Therapie wird mithilfe einer Medikamentenpumpe ein Gel mit dem Wirkstoff über eine Jejunalsonde direkt in den Dünndarm verabreicht, wodurch eine kontinuierliche Wirkstoffzufuhr gewährleistet wird. Somit können unerwünschte Wirkschwankungen reduziert werden. In der Regel ist die Einnahme weiterer Parkinson-Medikamente nicht nötig. Durch die Therapie mit der Levodopa-Pumpe können so OFF-Phasen reduziert und mehr Zeit in guter Beweglichkeit geboten werden.15
Subkutane Apomorphin-Therapie
Apomorphin zählt zur Wirkstoffgruppe der Dopamin-Agonisten. Es ahmt also die Eigenschaften des körpereigenen Dopamins nach und ist in der Lage, Dopaminrezeptoren zu stimulieren. Um eine gleichbleibende Wirkstoffkonzentration im Blut zu gewährleisten, wird Apomorphin subkutan initiiert. Das geschieht als Dauerinfusion über eine Pumpe. Oft wird die Apomorphin-Infusion durch die orale Einnahme von Levodopa ergänzt. Durch die kontinuierliche Wirkstoffversorgung können Schwankungen reduziert und die ON-Phasen verlängert werden.16
Tiefe Hirnstimulation
Bei der Tiefen Hirnstimulation werden Elektroden in die Basalganglien implantiert. Die Elektroden sind mit einem Impulsgenerator verbunden, der in der Nähe des Schlüsselbeins eingesetzt wird und elektrische Impulse sendet. So kann die Tiefe Hirnstimulation Bewegungsabläufe, die durch die Basalganglien koordiniert werden, gewissermaßen neu takten. Die behandelnden Ärzt*innen sind in der Lage, den Grad der Stimulation auch nach dem Eingriff zu verändern und den jeweiligen Bedürfnissen anzupassen. Bewegungsstörungen können damit vermindert, die zusätzliche Gabe von Parkinson-Medikamenten reduziert werden.17